Анықпаған (шектелмеген) майлы қышқылдар
Қанықпаған май қышкылдарының молекуласында бір, екі, үш және одан да көп қос байланыстар болады.
Қанықпаған (шектелмеген) майлы қышқылдар
Қанықпаған майлы қышқылдар көбінесе жануарлар ағзасында кездеседі. Олардың негізгі өнімдері:
С17Н33СООН- олеин қышқылы СН3-(СН2)7-СН=СН-(СН2)7-СООН
С17Н31СООН- линоль қышқылы СН3-(СН2)6-(СН=СН)-(СН2)6-СООН
С17Н29СООН- линолен қышқылы СН3-(СН2)5-(СН=СН)3-(СН2)5-СООН
С17Н31СООН- арахидон қышқылы СН3-(СН2)5-(СН=СН)4-(СН2)5-СООН
Молекуланың құрамында май және фосфор қышқылды глицерин қалдығы бар бөлігін фосфатидил деп атайды. Азотты негіз холин, этаноламин, серин болуы мүмкін. Холин неғұрлым кең таралған. Фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин сияқты фосфатидтер клеткада жиі кездеседі. Құрылымына қарай липидтер алуан түрлі болып келеді. Барлық липидтерге тән жалпы қасиет — олардың молекулаларының полюссіздігінде (гидрофобтылығында). Сондықтан липидтер полюссіз сұйықтықтарда: бензинде, эфирде, хлороформда жақсы, ал суда нашар ериді. Липидтердің гидрофобты қасиеті көрсетуінің жасуша тіршілігіндегі маңызы зор.
Май қышкылдарының физикалық қасиеттері. Май қышқылдарының қасиеттері оның құрамындағы коміртегі атомдары тізбегінің ұзындығына жане қанықпау дәрежесіне байланысты..Мысалы, меристин қышқылының (C14:0)балқу температурасы 54,4  .Ал С атомының тізбегі ұзарған сайын қышқылдың балқу температурасы да артады. Осыған орай, пальмитин қышқылының балқу температурасы 62,9
.Ал С атомының тізбегі ұзарған сайын қышқылдың балқу температурасы да артады. Осыған орай, пальмитин қышқылының балқу температурасы 62,9  ,стеарин қышқылында 69,6
,стеарин қышқылында 69,6  .
.
|
|
|
Қанықпаған қышқылдарда қос байланыс санының артуына байланысты балқу температурасы төмендейді.Қанықпаған май қышқылдары әдетте сұйық күйде болады.
Қаныққан май қышқылдары С4:0- C8:0 үй температурасында сұйық зат C10:0-ден бастап олар қатая бастайды. C6:0 ден бастап май қышқылдары іс жүзінде суда ерімейді.Олар сілтілердің су ерітіндісінде ериді де, сабынға айналады.
18.Күрделі липидтердің түрлер атаңыз.Фосфолипидтер молекуласының құрылысы мен түрлерін, биологиялық ерекшеліктерін көрсетіңіз.
Липидтер дегеніміз - табиғи заттар тобы. Олар іс жүзінде суда ерімейді, бірақ полярсыз еріткіштерде (хлороформ, эфир, ыстық этанол, күкіртті көміртегінде) ериді. Белоктармен, углеводтармен қатар липидтерде мал, адам және өсімдіктердің барлық тканньдері клеткаларының құрамына кіреді. Липид гректің lipos- май деген сөзінен шыққан.Күрделі липидтерге балауыз, фосфолипидтер, глицерофосфолипидтер,сфинголипидтер, стеролдар,стериндер жатады. Фосфолипидтер — майларға жатады. Майдың бір шетіндегі орналасқан май қышқылының орнына фосфор қышқылының қалдығы арқылы фосфолипидті радикал байланысқан. Фосфолипидті радикал ретінде холин, серин, инозитол немесе этаноламин болуы мүмкін. Фосфолипидтер биомембрананың маңызды құрамдас бөлігі Фосфолипидтер құрамында глицерин болады. Глицериннің екі гидроксил тобына 12-ден 22-ге дейін жұп санды көміртек атомдары бар май қышқылдары байланысады. Глицериннің үшінші гидроксил тобына фосфор қышқылының қалдығы, ал одан әрі қарай фосфолипидтің құрылымын анықтайтын арнайы радикал байланысқан. Мұндай радикалдарға: холин, инозитол, серин жөне этаноламин жатады. Фосфолипидтің жалпы құрылымын қарастырсак, оның май қышқылдарынан құралатын майлы (гидрофобты) бөлігі және фосфор қышқылының қалдығы мен радикалдан тұратын (гидрофильді) бөлігі болады. Фосфолипидтер суда бірден мембрана түзеді. Ол кезде фосфолипидтердің майлы бөліктері сумен байланысқа түспеуге тырысып, өзіне ұқсас фосфолипид бөліктерімен жақындасады. Ал гидрофильдік бөліктері сыртка суға қарай бағытталады. Осындай жолмен бірден екі қабат фосфолипидтен тұратын, екі қабатты мембрана түзіледі. Фоефолипидтер фосфатидтер, плазмалогендер және сфинголипидтер деп аталатын үш топқа бөлінеді. Фосфолипидтердщ үш тобының құрамында да фосфор қышқылының қалдығы болады. Фосфатидтер глицерин мен май қышқылдарының күрделі эфирлері болып табылады. Сонымен қатар олардың құрамында фосфор қышқылының қалдығы және онымен байланысқан азотты негіз бар. Липидтер мынадай биологиялық қызмет атқарады, липидтер энергия қорының (депосының) негізгі түрі және тірі организм үшін көміртегі атомдарын беруші; қор болып жиналған липидтердің құрамы мен мөлшері мал азықтандыруға және олардың қоңдылығына байланысты болады; Қорғаныс қызметін атқарады, организмдерді ыстық суықтан, электер және механикалық әсерлерден (соққыдан, қағылып соғылудан, қатты суықтан) қорғайды; Липидтерде көптеген витаминдер ериді, олардың құрамында алмастыруға келмейтін май қышқылдары бар, ондай қышқылдар организмнің қалыпты тіршілігі үшін қажет.
|
|
|
|
|
|
|
|
|
19.Күрделі липидтердің түрлері. Сфинголипидтер молекулаларының құрылысы мен түрлерін, биологиялық маңызын атаңыз.
Липидтерге майлар және май тәрізді заттар — липоидтер жатады. Липидтердің молекуласының құрамына C, H, O атомдары кіреді. Құрамындағы элементтердің байланысына және құрылымына қарай липидтер алуан түрлі болып келеді. Барлық липидтерге тән жалпы қасиет — олардың молекулаларының полюссіздігінде (гидрофобтылығында). Сондықтан липидтер полюссіз сұйықтықтарда: бензинде, эфирде, хлороформда жақсы, ал суда нашар ериді. Липидтердің гидрофобты (грекше hydor — су және phobos — қорқыныш) қасиет көрсетуінің жасуша тіршілігіндегі маңызы зор. Себебі жасуша мембранасының ортаңғы екі қабаты фосфолипид молекуласынан тұрады. Фосфолипид молекуласы жасушаға сырттан қажетсіз заттарды өткізбейді және сыртқы ортаға жасушадағы заттарды шығармайды. Осының нәтижесінде жасушаның химиялық ортасы тұрақты болып сақталады. Липидтердің ішінде көп таралғаны және ең негізгісі — майлар. Майлардың химиялық құрылымы күрделі болып келеді. Оның молекуласы үш атомды спирт — глицерин мен жоғары молекулалы май қышқылдарынан тұратындығы мынадай формулада бейнеленген 
Сфинголипидтер клетка мембранасынын барлық түрінен табылған. Сфинголипидтердің фосфолипидтерден айырмашылығы- оларыдың құрамында глицерин болмайды.негізгі косылыстары (холин,серин,этаноламин) май қышқылдары: пальмитин қышқылы,стеарин қышқылы, лигноцерин қышқылы кіреді. Табиғатта ең коп таралған сфинголипидтің құрамына 18 көміртек атомы бар сфингозин кіреді, құрамында 16,17,18 көміртек атомы бар сфингозин сфинголипидтерде өте сирек кездеседі. Алғашқы сфинголипид деп церамидті санайды. Ол сфингозиннен және моноқанықпаған май қышқылынан амидтік байланыстың көмегімен түзіледі.

20. Нуклейн қышқылдары,құрылысы,түрлері.Нуклеотидтер мен нуклеозидтер. Нуклеотидтер мен нуклеозидтер. РНҚ және ДНҚ молекулаларының құрамдық және құрылымдық ерекшеліктерін көрсетіңіз. Нуклетид қалдықтарынан тұратын жоғары молекулалы органикалық қышқылдар. Нуклеотидтер: пуринді немесе пиримидинді негіздерден, пентозадан (рибоза не дизексирибоза) және фосфор қышқылы қалдығынан тұрады. Азотты негіздне және пентозадан тұратын қосылыс – нуклеозид депаталады.Нуклейн қышқылдары 2-ге бөлінеді. Дезоксирибонуклеин қышқылы(ДНҚ) және рибонуклеин қышқылы(РНҚ). ДНҚ аденин, гуанин, цитозин, тимин азотты негіздерінен, пентоза- дезоксирибозадан және фосфор қышқылы қалдығынан тұратын, 2 тізбекті негізгі тұқым қуалау аппараты. РНҚ да ДНҚ-ға ұқсас, айырмашылы тазотты негіз тиминнің орнына урацил, дезокксирибоза орнына – рибоза қанты жүреді. Сондай-ақ РНҚ әрқашан 1 тізбекті.Нуклеотид-азотты негіз,пептоза,фосфор қышқылы қалдығынан тұрады.Нуклеозид-азотты негіз және пептозадан түрады.Нуклеотидтнр бір-бірімен фосфодиэфирлік байланыс арқылы ьайланысады. ДНҚ құрамына негізінен алты түрлі зат қана кіргенімен (4 азоттық негіз, дезоксирибоза және фосфор қышқылы), оның молекулалық құрылымы өте күрделі. РНҚ химиялық құрамы жағынан ДНҚ-ға ұқсайды, тек РНҚ молекуласында дезоксирибоза орнында рибоза болады, ал тимин урацилинмен алмастырылған. Сонымен РНҚ құрамына азотты негіздерден аденин, гуанин, цитозин, уроцил кіреді.ДНҚ-дан айырмасы РНҚ түрлерінің бәрі әдетте бір тезек түрінде тіршілік етеді. Өзінің түрлеріне байланысты РНҚ шамасы және молекулалық массасы әртүрлі болады.
21. РНҚ түрлері, атқаратын қызметі, клеткадағы олардың салыстырмалы мөлшері молекулаларының құрылымы мен қасиетерінің ерекшеліктерін сипаттап жаз.
Функционалдық маңызы мен молекулалық салмағы сондай-ақ клеткадағы шоғырлануы бойынша РНҚ мынандай түрлерге бөлінеді.
1.Тасымалдаушы РНҚ /тРНҚ/, олардың мол.массалары онша жоғары емес /17000-35000/ Д клетканың гиалоплазмасында, ядро сөлінде, хлоропластар мен митохондриялардың күрылысы жоқ бөлігінде шоғьфланған.
2. Рибосомалык РНҚ /рРНҚ/ негізінен молекулалық салмағының үлкен мөлшерімен сипатталады /550000-700000 рибосоманың 30-40 5 суббөліктерінде, 1,1*106-1,7*106 рибосоманың 50-60 5 суббөліктерінде, 55 рРНҚ-ның салмағы 40000 Д/ рибосоманың қүылымдық негізі.
З.Ақпараттық немесе матрицалық РНҚ /мРНК/ олардын олардың мол.салмакггары кең ауқымда өзгереді /300000-нан 4* 106 -не/ дейін, полипептидтік тізбекті жинайды.
4.Вирустық РНҚ мол.массасы бірнеше миллион дальтон, қожайын клеткаларына вирус көбейуі үшін кажетті барлык ақпаратты береді.
Рибонуклеин қышқылы (РНҚ) — жоғары молекулалық байланыс; нуклеин қышқылдарының типі. Табиғатта кеңінен таралған. РНҚ-ның көмірсу бөлігінде рибоза қанты, ал азотты негіздері ретінде аденин, гуанин, цитозин және урацил болады.
Рибонуклеин қышқылдары рибосомалық (рРНҚ), ақпараттық (аРНҚ) және тасымалдаушы (тРНҚ) болып бөлінеді. Рибонуклеин қышқылы тізбегі бірнеше ондаған нуклеотидтерден бірнеше мыңдаған нуклеотидтерге дейін созылатын біржіпшелі полинуклеотидтерден тұрады. Организмде РНҚ ақуыздармен кешенді байланысқан рибонуклеотидтер түрінде болады. РНҚ генетикалық ақпараттың жүзеге асуы мен ақуыз синтезіне қатысып, барлық тірі организмдерде аса маңызды биологиялық рөл атқарады. Көптеген вирустарда РНҚ-н жалғыз нуклеинді компонент (құраушы) құрайды. Осындай РНҚ вирустарда РНҚ биосинтезімен қатар ДНҚ биосинтезінде де матрица рөлін атқара алады (кері транскриптаза). Бактериялар, өсімдіктер және жануарлар жасушаларында құрылымы, метаболизмі және биол. қызметтері әр түрлі РНҚ типтері кездеседі. Мысалы, рРНҚ рибосоманың құрамына еніп, жасушадағы РНҚ-ның негізгі массасын құрайды және көлемі, құрылымы түрлі организмдерде әр түрлі болады. Клеткада негізінен рРНҚ-да ақуыздың биосинтезі жүреді; тРНҚ жасушада амин қышқылдары қалдықтарын жалғастырып алып, оны ақуыз синтезі өтіп жатқан жерге тасымалдайды. Әрбір амин қышқылының өзіне сай арнайы тРНҚ (әдетте бірнеше) болады. Барлық тРНҚ жоңышқа жапырағына ұқсас макромолекулалы құрылымға ие. Олардың рибосомаға және аРНҚ-на жабысатын, үш нуклеотидтен тұратын (антикодон) және амин қышқылы қалдығын жалғастыратын аймақтары бар. РНҚ-ның барлық түрлері жасушада ДНІ матрицасында синтезделеді, соның нәтижесінде ДНҚ-ндағы дезоксирибонуклеотидтер тізбегінде комплементарлы рибонуклеотидтер тізбегі құрастырылады, мұны транскрипция процесі деп атайды. Клетка ядросында матриц. РНҚ-ның (мРНҚ) бастамасы болып келетін алып молекулалар табылған, олардың көп бөлігі ядрода ыдырайды да, аз бөлігі цитоплазмаға өтіп, нағыз мРНҚ-ын құрайды.
22.ДНҚ бірінші реттік құрылымы. Чаргафф ережесі. ДНҚ құрамына 6 түрлі зат:4 азотты негіз,дезоксирибоза,фосфор қалдығы кіреді.ДНҚ екі тізбекті. 1 нуклеотидтің дезоксирибозасы 2-ші нуклеотидтің фосфат көмегімен нуклеотидтер өзара байланысып жағасады да, ұзынполинуклеотидтік тізбек түзеді. Осындай тізбектегі полинуклеотидтер орналасуын ДНҚ-ның 1-ші реттік құрылымы деп атайды. Чаргафф ережесі. ДНҚ –ның химиялық құрамын зерттеу кезінде мына жағдай анықталды: барлық ДНҚ молекуласында аденин молінің саны тимин молінің санына тең де, цитозин мөлшері гуанин мөлшеріне тең. Бұл айқындалған мынадай өрнекпен беріледі: А=T,Ц=Г немесе А/T=1, Ц/Г =1. осы айтылғандардан мынадай қорытынды шығады: қандай организмдікі болмасын кез-келген ДНҚ құрамына кіретін пурин негіздерінің қосындысы пиримидин негіздері қосындысына тең: А+Г=Т+Ц.ДНҚ 2-ші реттік құрылымы. Уотсон – Крик моделі.Комлементарлық принцип. ДНҚ құрамына 6 түрлі зат:4 азотты негіз,дезоксирибоза,фосфор қалдығы кіреді.ДНҚ екі тізбекті. ДНҚ-ның физ-хим қасиеттері. ДНҚ – ның құрылымын 1953 жылы Дж.Уотсон мен Ф.Крик анықтады. Олардың теориясы бойынша ДНҚ молекуласы кеңістікте параллель орналасқан қос қабат спиральға ұқсайды. Бұл ДНҚ-ның 2-ші реттік құрылымы деп аталады. қос қабат спиральдың диаметрі 2 нм, көрші орналасқан негіздер жұбының арасы 0,34 нм. Қосқабат спиральдағы азотты негіздер орналасуы ерекше: 1 тізбектегі аденинге2-ші тізбектегітимин, ал гуанинге цитозин қарсы тұратындығы ерекшк маңызды. Спиральдағы азотты негіздердің бұлай орналасуын ДНҚ тізбегіндегі сәйкес-үйлесімділік (комплементарллылық) деп атайды және тірі материядағы генетикалық қасиеттердің сақталуында, ұрпақтан – ұрпаққа берілуінде ерекшк маңызды.
23.Белок биосинтезінің негізгі этаптары: транскрипция және трансляция терминдеріне түсініктеме беріңіз.
Клеткада белоктың синтезделуі өте күрделі де, көп сатылы процесс. Белоктың құрылымы туралы мәлімет ДНҚ-нің ген деп аталатын бөлігінде жазылады. Транскрипция процесі арқылы генде жазылған мәлімет мРНҚ-ға көшіріледі, ал мРНҚ белоктың синтезінде матрица ретінде қызмет атқарады. Матрицалық РНҚ-ның негізінде белок сентезі трансляция аеп аталады.
ДНҚ ----транскрипция----à мРНҚ----трансляция---àБелок
Белоктың биосинтезі үшін клеткада келесі процестер іске асуы қажет: 1. Транскрипция – РНҚ-полимераза ферментінің қатысуымен РНҚ-ның синтезі. 2. РНҚ-транскриптің пісіп жетілуі. 3. Белоктың синтезі мРНҚ-ны матрица ретінде пайдалана отырып іске асады. Бұл процесті трансляция д.а. Белок молекуласының синтезі трансляция сатысында іске асады.
ТРАНСКРИПЦИЯ (лат. transcrіptіo – қайта көшіріп жазу) – тірі жасушалардағы рибонуклеин қышқылының биосинтез процесі. Ол дезоксирибонуклеин қышқылы (ДНҚ) матрицасында жүреді. Транскрипция аденин, гуанин, тимин және цитозиннің қайталанбалы тізбегінен тұратын ДНҚ молекуласындағы генетикалық ақпараттың іске асуының бірінші кезеңі. Транскрипция арнайы ДНҚ және РНҚ полимераза ферменті арқылы жүреді. Транскрипция нәтижесінде РНҚ молекуласының полимерлі тізбегі түзіледі. Бұл тізбек ДНҚ молекуласының көшірілген бөлігіне комплементарлы болады. Транскрипция процесінің өнімі әртүрлі қызметтер атқаратын РНҚ молекуласының төрт типінен тұрады:
Рибосомадағы ақуыз синтезінде матрицаның рөлін атқаратын ақпараттық немесе матрицалық РНҚ;
Рибосоманың құрылымдық бөлігін құрайтын рибосомалы РНҚ;
Ақуыз синтезі кезінде генетикалық ақпараттың РНҚ-дағы нуклеотидтік “тілді” аминқышқылдық “тілге” ауыстыруға қатысатын тасымалдаушы РНҚ;
ДНҚ молекуласының репликациясы кезінде бастама қызметін атқаратын РНҚ.
Транскрипция бірлігін атқаратын қызметі бір-біріне байланысты ферменттер синтезін анықтайтын гендер тобын ``оперон`` деп атайды. Прокариоттарда ол функционалды байланысқан бірнеше геннен, ал эукариоттарда тек бірғана геннен тұрады.
ТРАНСЛЯЦИЯ — полипептид тізбегінің гендегі иРНҚ негізінде ақпаратқа сай түзілуі. Трансляция болашақ белокқа тән иРНҚ-на жазылған нуклеотидтер кезегін түзілетін белоктардың амин қышқылдарының кезегіне айналдырады. Бұл жұмысқа иРНҚ-нан басқа рибосомалар, тРНҚ, аминоацилсинтетазалар, белоктан тұратын инициация, элонгация және терминация факторлары қосылған күрделі құрамдар қатынасады
Инициацияның бас кезінде рибосома eкi — улкен (сед- ментация коэффициенті 50S) және кіші (30S) жеке суббөліктерден тұрады. Информацияның РНҚ кіші суббөлікке бекінеді. Бул ушін Mg2+ ионы жене белоктың инициация факторы кажет. Белок сиптезінің басталуының 6i piнші б елгісі болып бастама алу АУГ кодоны саналады;
Терминация не белок синтезінің аяғы-терминациялау кодондары — УАА. УГА немеее УАГ (стоп – кадондар)триплеттерінің кызметі арқылы өтеді. Табиғатта осы кадондарға сәйкес келетін антикадондары бар тРHK молекулалары жоқ, сондыктан терминация реакциясы кодон- антикодон әрекеттесуінен мулде басқа.
Элонгация — өсin жаткан полипептидтік тізбек құрамына амин кышкылдарының тізбектеліп қосылуы. Полисомаға белок синтезі үшін кажет амин қышқылдарын тРНҚ тасымалдайды.
24) Про және эукариот клеткаларының нуклеин қышқылдары.Про және эукариот клеткаларының рибасома құрылысы, ерекшеліктеріне сипаттама
Прокариоттар-Ядросыз бір хромосомасы бар төменгі сатыдағы бактериялар сияқты организмдер.
Эукариоттар-мембранамен жабдықталған ядросында бір және оданда көп хромосомалар бар күрделі қараған жоғарғы сатыдағы организмдер.Эукариоттарда пиримидинтік нуклеотидтер түзілу үшін керек карбомоилфасфат цитоплазмада түзіледі.Амин топтарының көзі ретінде глутамин болады.Бұл реакцияны катализдейтін фермент карбомоилфосфатсинтеза жэануарлардың барлық ұлпаларында кездеседі.Ферменттің қызметі-глутаминнің гидролизін іске асырады.
Эукариот клеткаларының прокариоттардан негізгі ерекшелігі – олар жеке-жеке компартменттерге бөлшектенген, яғни көптеген мембраналық органеллалары болады. Эукариоттардың ақуызбен б Рибосомалардың негізгі қызметі белоктардың синтезі. Клеткадағы рибосоманың мөлшері клетканың түріне ж\е функцинолды белсенділігіне тәуелді. Прокариоттар мен эукариоттардың рибосомвлары үлкен ж\е кіші суббөліктерден құралған. Прокариот клеткаларының рибосомалары 60-65% рРНҚ-дан, 40-35% белоктардан құралады, жалпы мөлшері-70S. Үлкен суббөлігі екі түрлі рРНҚ-23S,5S ж\е33 түрлі белоктардан құрылады, мөлшері-50S, кіші суббөлігіндегі рРНҚ бір түрі-16S, 21 түрлі белоктармен байланысқан, жалпы мөлшері-30S. Эукариот рибосомаларының құрамында 50%-рРНҚ, 50% әр түрлі белоктар құралады. кіші суббөлігінде 18S рРНҚ-ң бір молекуласы 33 түрлі белоктармен байланысқан, бұл суббөліктің жалпы мөлшері 40S, үлкен суббөлігінің құрамында 50 түрлі белоктар, 26S(28S), 5S ж\е 5,8S рРНҚ-мен байланысады. Эукариот рибосомаларының жалпы мөлшері 80S. Рибосомада 3 маңызды функциональды аймақтары бар:А,Р сайттары ж\е трансферазалық орталығы. А аймағымен жаңа амин қышқылымен байланысқан тРНҚ, Р аймағымен биосинтез барысында өсіп жатқан полипептидтік тізбегімен байланысқан тРНҚ байланысады, яғни А сайты мен аминоацил-тРНҚ, Р сайтымен пептидил тРНҚ байланысады. Трансферазалық орталығында ерекше фермент пептидил трансфераза орналасады. Бактериялардың рибосомасы 1 сек.ішінде өсіп жатқан полипептидтік тізбегіне 20 амин қышқылы қалдықтарын байланыстырады.
25. Белок синтезіндегі транскрипция кезеңі. мРНҚ-ның ДНҚ молекуласынан генетикалық мәліметтерді көшіріп жазу. Генетикалық код, генетикалық кодтың қасиеттерін көрсетіңіз.
Информациялық РНҚ жиі жағдайда матрицалық РНҚ деп аталады, өйткені информациялық РНҚ-да матрицадағыдай, полипиптид синтезделеді. мРНҚ молекуласы тиісті гені бар ДНҚ-ның беогілі учаскесінде синтезделеді және сол геннің көшірмесін дәл түсіріп алады. Осыдан кейін мРНҚ ядродан цитоплазмаға шығады да, рибосомамен қосылады, белок синтезі осылайша басталады. Жануарлар клекасында мРНҚ тіршілігі бірнеше сағатқа, тіпті бірнеше күнге созылуы мүмкін. Осы мезгіл аралығында белоктың жүздеген, тіпті одан да көп молекулалары синтезделеді.
Клетка құрамындағы мРНҚ мөлшері шамалы ғана, бірақ ол ерекше әсерлі келеді. мРНҚ алаун текті, ол жағдай клетка синтездейтін белоктардың түрлеріне байланысты, өйткені әр мРНҚ белоктың бір түрін ғана ситездеуге жауапты.
Пре-мРНҚ гетерогенді ядролық мРНҚ деп те аталатыны, ол аса үлкен гигант молекула болып табылатынын атап айту қажет. Мұнын құрамында басқа нуклеотитдермен бірге аденильдік нуклеотидтердің 200 шамасына дейінгі қалдықтардан тұратын ұзын тізбек бар. Пре-мРНҚ прцессинг құбылысына ұшырайды. Ферменттердің әсерімен одан РНҚ-ның бір бөлшегі және поли-А бөлініп шығады, осылайша активті де дайын мРНҚ босап шығады. Бірақ мұның молекуласында да белгіленбеген учаскелер үнемі бар, атап айтқанда құрамында аденил қышқылының 50-75 қалдығынан құралған ұзын поли-А бар. Бұл жағдай гемоглобин, миоглобин, инсулин, интерферонның мРНҚ-сы бойынша тәжірибе жүзінде дәлелденген, олар таза күйінде бөліп алынған. Трансляцияға қатысты поли-А қызметі әлі толық анықталған жоқ.
ДНҚ хромомсоманың ішкі жағында, ал белоктар сыртқы жағында «орама» түрінде орналасқан. Белоктар гистон түрінде және қышқыл гистон емес түрде болады. ДНҚ мен белоктардың қосылған комплексіәрекет тұрғысынан активті емес және ДНҚ құрамындағы гендердің көпшілігі басыңқы болады. Болжамға қарағанда гендердің 20-30 пайыз шамасындайы ғана мРНҚ-ны синтездей алады. Дегенмен, активті гендердің өз клетка қажетінің өзгеруіне байланысты үзіліспен жымыс істейді.
Гендердің активтенуі ДНҚ молекуласы учаскесінің белоктан босап шығуына байланысты, осы жағдай мРНҚ транскрипциясына алып келеді. Барлық гормондар дерлік транскрипция жылдамдығын арттырады, яғни мРНҚ мөлшерін арттырады, сөйтіп, белок синтезін ұлғайтады. Мысалы, еркектердің жыныс гормоны бұлшықет белоктарының қалыптасуын, пролактин мен инсулин сүт белоктарының түзілуін қолдайды. Гормондардың ген аппаратына әсері алуан түрлі де күрделі болады.
Генетикалық код — тірі организмдерге тәннуклеин қышқылдары молекуласындағы тұқым қуалаушы (генетикалық) ақпараттыңнуклеотидтер тізбегі түріндегі біртұтас “жазылу” жүйесі. Бұл — барлық тірі организмдерге ортақ заңдылық.Генетикалық код туралы қазіргі қалыптасқан көзқарасқа 1960 жылы Америка ғалымдары М. Ниренберг, Г. Корана және П. Ледердің жүргізген зерттеулері көп әсерін тигізді. Генетикалық код бірлігі — ДНҚ мен РНҚ молекуласындағы 3 нуклеотид (триплет) тізбектерінен тұратын кодон (аРНҚ нуклеотидтерінің триплеттері)болып табылады. Гендегі кодондар тізбегі осы генді “жазатын” (кодтайтын) ақуыздағы амин қышқылдар тізбегін анықтайды. Клеткадағы генетикалық код екі сатыда іске асады:транскрипция сатысы ядрода жүреді және ДНҚ-ның сәйкес бөліктерінде ақпараттық (информациялық) рибонуклеин қышқылдарының молекулалары (аРНҚ)жасалады. Сонымен қатар, ДНҚ нуклеотидтер тізбегі аРНҚ нуклеотидтер тізбегі ретінде қайта жазылады;трансляция сатысы цитоплазмада, ақуыз синтезделетін рибосомада жүреді. Сондай-ақ, аРНҚ нуклеотидтер тізбегі, полипептидтер құрайтын амин қышқылдар қалдықтарының белгілі бір тізбегіне көшеді.Генетикалық кодтың бір ерекшелігі, әмбебап екендігі, яғни барлық организмдерде белгілі бір 3 нуклеотид (триплет) белгілі бір амин қышқылдарын “жазады” (кодтайды). Бір амин қышқылы бірнеше триплетпен “жазылуы”(кодталуы) мүмкін. Кодондар арасында “үтір” болмайды, яғни олар бір-бірінен бөлінбеген. Ол бір геннің аймағында белгіленген нүктеден бастап, бір бағытта есептелінеді. 64 кодонның 61-і ақуыз құрайтын 20 амин қышқылдарын “жазады” (кодтайды), ал қалған үш “нонсенс”(мағынасыз) кодондар (УАГ, УАА және УГА) полипептид синтезін аяқтайтын “нүкте” қызметін атқарады. Олар ақуыз биосинтезінінің аяқталғанын білдіреді.
26.Амин қышқылдарының активтенуі.Белок синтезіндегі тРНҚ-ның және аминоцил тРНҚ синтетазаның рөлі туралы толық мәлімет бер. Клеткадағы барлық РНҚ-ның 10% шамасындайы транспорттық РНҚ, тРНҚ, молекуласы құрамына 70-84нуклеотид кіреді. Оның үлкен емес 25000-30000 тРНҚ құрамынан 30шамасына дейін қалыптан тыс, минорлық затты қалдықтар деп аталатын қосылыс табылған. тРНҚ қызметі активтелген амин қышқылдарын белок синтезделетін орынға жеткізу болып табылады. Клеткада 50шамасындай тРНҚ бар, ал амин қышқылының саны 20ғана екені белгілі. Демек, бір амин қышқылын екі ж/е одан көп тРНҚ тасымалдайды екен. Сол сияқты әр амин қышқылын екі ж/е одан көп тРНҚ тасымалдайды екен. Сол сияқты әр амин қышқылын өзінің арнаулы тРНҚ-сы тасымалдайды. Барлық тРНҚ-ның жалпы жоспар бойынша құрылғаны олардың кеңістіктік құрылымы бірдей екендігі, пішінінің беде жапрағына ұқсайтыны анықталған. Барлық тРНҚ конформациясы ұқсас болғанымен, нуклеотидьердің орналасу реті әр түрлі.Амин қышқылдарының активтенуі. ТРНҚ-ның белок биосинтезі процесіндегі рөлі. Аминоацил-тРНҚ синтетазаның рөлі.Әр аминқышқылын автивтендіретін оның өзіне тән арнайф ферменті бар.Ол фермент-аминоацил-тРНҚ синтеаза деп,метионинді автивтендірітін фермент метионил т-РНҚ-синтетаза деп талады.Бұл фермент процестің келесі сатысыда аминоациладенилат пен тРНҚ өзара әрекеттесуіне қатысады.Автивтелген аминқышқылы аденозиннің 3’-он тобы бойынша тРнқ-ның акцепторлық шетіне жалғасады,және аминоацил тРНҚТүзіледі.Егер активтендіретін және тРНқ мен байланысқан амин қышқылы метионин болса,онда ол метионил тРНқ деп аталады.Бұл ферменттің байланысатын 3 учаскесі болады.Фермент молекуласының 1 учаскесі тиісті аминқышқылын таниды.,2 учаскесі тРНҚ таниды.Осы тРНҚ сол аминқышықылын ғана ковалентті байланысып жалғасуы мүмкін.3 учаскамен АТФ молекуласымен байланысады.Бұдан кейін тРНҚ амин қышқылын белок синьездейтін комплекске ауыстырады.
27. Трансляция стадиялары: инициация, элонгация, терминация. Олардың компоненттері, полипептидтік тізбектің түзілуі туралы толық мәлімет беріңіз.
Белок биосинтезінің жылдамдығын бір жағынан генегтикалық аппарат басқарса, екінші жағынан сыртқы орта факторлары басқарады. Эукариот клеткаларында белок биосинтезінің реттелуінің екі механизмі болады: трансляция және транскрипция. Трансляция негізгі үшстадиядан тұрады: инициация, элонгация, терминация. Белок синтезінің реттелуі осы сатылардың әрқайсысының кезінде-ақ орналасады. Мұнда клеткалардың амин қышқылдарымен, әсіресе ауыстырылмайтын амин қышқылдарымен қамтамасыз етілуінің маңызы бар. Белгілі бір амин қышқылдары жетіспегенде оған сәйкес аминоацил-тРНҚ түзілуі тоқталады, оның салдарынан трансляция тежеледі. Белок синтезінің әр түрлі ингибиторлары не иРНҚ-ның өзіне немесе инициация, элонгация және терминация прцестеріне әсер етеді. Бұл жағдайдың салдарынан белок синтезі тежеледі немесе мүлде тоқталып қалады. Мысалы, пуромицин антибиотигі пептид тізбегінің элонгациясын тоқтатады.
Трансляция — полипептид тізбегінің гендегі иРНҚ негі- зінде ақпаратқа сай түзілуі. Трансляция болашақ белокқа тән иРНҚ-на жазылған нуклеотидтер кезегін түзілетін белоктардың амин қьішқылдарының кезегіне ай- налдырады. Бұл жұмысқа иРНҚ-нан басқа рибосомалар, тРНҚ, аминоацил синтетазалар,белоктан тұратын инициация, элонгация және терминация факторлары қосылған күрделі құрамдар қатынасады.
Инициацияның бас кезінде рибосома eкi — улкен (сед- ментация коэффициенті 50S) және кіші (30S) жеке суббөліктерден тұрады. Информацияның РНҚ кіші суббөлікке бекінеді. Бул ушін Mg2+ ионы жене белоктың инициация факторы кажет. Белок сиптезінің басталуының 6i piнші б елгісі болып бастама алу АУГ кодоны саналады;
Терминация не белок синтезінің аяғы-терминациялау кодондары — УАА. УГА немеее УАГ (стоп – кадондар)триплеттерінің кызметі арқылы өтеді. Табиғатта осы кадондарға сәйкес келетін антикадондары бар тРHK молекулалары жоқ, сондыктан терминация реакциясы кодон- антикодон әрекеттесуінен мулде басқа.
Элонгация — өсin жаткан полипептидтік тізбек құрамына амин кышкылдарының тізбектеліп қосылуы. Полисомаға белок синтезі үшін кажет амин қышқылдарын тРНҚ тасымалдайды.
28.Белоктар мен аминқышқылдардың ыдырауы.Переаминдеу, тотыға дезаминдеу, амин қышқылдарының декарбоксилденуі, аммиактың түзілуі реакцияларын жазыңыз.
Организмде аминқышқ. қор болып жиналмайды және бос күйінде организмнен бөлініп шықпайды.Түзілген аминқышқ.мөлшері жоғары болғанда,барлығы белок синтезі үшін пайдаланылмайды,артығы ыдырайды.Адам мен сүтқоректі жануарларда аминқышқ. ыдырауының реакциялары негізінен бауырда өтеді.Аминқышқ. катаболизмі α аминотобының бөлінуінен,дезаминдеу немесе трансаминдеу процесінен басталады.Тотыға дезаминдену арқылы аминқышқ.молекуласынан амин тобы тотығу жолымен аммиак түрінде бөлініп кетеді.Реакцияны флавин тәуелді оксидаза н/е НАД тәуелдідегидрогеназа катализдейдіАминқ. Метаболизмінде ең маңызды фермент глутаматдегидрогеназа.Бұл L-глутамин қышқ. тотыға дезаминденуін катализдейтін дегидгеназа,кофермент НАД+ н/е НАДФ+ ,ортаның Рһ- ы физиологиялық мағынасына тең болғанда активті.Глутамин қышқ. тотыға дезаминденуі нәтижесінде бөлінген аминтобы бірден аммоний ионына айналады,сондықтан тотыға дезаминдену реакциясы деп аталады.Аминқышқ. шамалы мөлшері катаболизм процесінде алдымен декарбоксилдену реакциясына түседі.Декарбоксилдену реакциясында аминқышқ. СО2 түрінде бөлінеді,нәтижесінде аминдер түзіледі.Реакцияны декарбоксилаза ферменті катализдейді.Жануар ұлпаларында тирозин,триптофан,валин,гистидин,глутамин,цистеин,аргинин,орнитин окситриптофан,оксиглутамин қышқылы,α аминомалон қышқылдарының декарбоксилденуі анықталған.Адам мен жануарлар организмінде аминқышқ/ң декарбоксилдену реакция түрлерінің ең маңыздысы –α-карбоксил тоьының бөлінуі.Реакция өнімдері –аминдер.Декарбоксилдену реакциясы қайтымсыз.Аминқ-ң декарбоксилазасы күрделі ферменттер,коферменті пиридоксальфосфат.Ферменттің ерекшелігі апоферментпен белгіленеді.Аминқ-н түзілетін аминдер биологиялық активті,сондықтан биогенді аминдер деп аталады.Гистидин декарбоксилдену реакц-ң нәтижесінде гистаминға айналады.Гистаминнің биологиялық әсері кең.Гистаминнің көп мөлшері асқазанның шырышты қабатында түзіледі.Ол асқазанға пепсин мен тұз қышқ-ң бөлінуін арттырады.Биогенді аминдер –организмнің физиологиялық прцестеріне әртүрлі әсер ететін күшті фармокологиялық активті заттар.Организмде биогенді аминдер шамалы мөлшерде түзіледі.Көп мөлшерде жиналғанда олардың әсерінен әртүрлі патологиялар пайда болады.Организмде биогенді аминдерді усыздандырудыңм ерекше механизмі бар.Мыс:тотыға дезаминдеу механизмі арқылы аминдер альдегидтерге айналады.Альдегидтер тотығадыда органикалық қышқылдар түзіледі.Аминқ-ң дезаминдену нәтижесінде аммиак түзіледі.Аммиак өте улы зат,организмнен шығарылуы қажет.Қанның құрамында аммиактың концентрациясы 40-50мкмоль/л төиен болу керек.Адамда түзілген аммиактың 90% жуығы несепнәр түрінде шығарылады.Оның синтезі бауырда жүзеге асады.


Ақуыздың құрылымының деңгейлерi: 1 — біріншілік, 2 — екіншілік, 3 — үшіншілік, 4 — төртіншілік
Биiк температураның әсерiyен тауық жұмыртқасының ақуызының қайтымсыз денатурациясы
Құрлымы.
Белок жасуша құрамына кіретін тірі құрылымдар – ядро, митохондрия, рибосома, цитоплазма негіздерін құрайды. Сондықтан ол ағза құрамында үлкен орын алады. Мысалы, адам мен жануарлар денесінің құрғақ заттарында 45%, жасыл өсімдіктерде 9 – 16%, дақыл тұқымында 10 – 20%, бұршақ тұқымдастар дәнінде 24 – 35%, бактерия жасушаларында 50 – 93% ақуыздық заттар бар. Белок барлық ағзаға ортақ зат болғанымен, әр түрлі ағза ақуыздарының құрылымы түрліше болады. Сондай-ақ, ағза түрлерінің бір-біріне ұқсамауы, олардың эволюция жолымен үздіксіз өзгеріп дамуы да ақуыз қасиеттерінің үнемі өзгеріп отыруына байланысты. Белок – бүкіл тірі ағзаның негізгі қорегі. Ол жасуша протоплазмасын құрумен қатар, ағзадағы көптеген тіршілік кұбылыстарына – тамақтану,өсу, көбею, тітіркену, козғалу, тыныс алу процестеріне тікелей қатысады.
Организмнің күнделікті тіршілігі оның жасушаларында жүріп жататын көптеген биохимиялық реакцияларға негізделген. Осы реакциялар нәтижесінде өсімдіктерде, бір жағынан, тіршілікке қажетті химиялық қосылыстар – ақуыздар, нуклеин қышқылдары, көмірсулар, майлар, витаминдер синтезделетін болса, екінші жағынан, онда ферменттер арқылы күрделі заттар ыдырап, өсімдіктің қоректенуіне, тозған жасушаларын жаңартуына, ағзаға қуат беруге жұмсалады. Бұл құбылыстарды метаболизм деп атайды. Осы реакциялардың бәрінде де ақуыз катализаторлық қызмет атқарады. Қан құрамындағы ерекше ақуыз – гемоглобин бүкіл денеге оттек таратады. Клеткалардағы тотығу ферменттері – цитохромдар тыныс алу процесін реттеп отырады. Сондай-ақ ағза тіршілігіне аса кажетті заттар гормондар да ақуыздан құралған. Ерімтал ақуыздар – гидрофильді коллоидтар – суды бойына көп тартады. Олардың ерітінділері желім сияқты: осмостық қысымы төмен, қозғалу қабілеті нашар, өсімдік пен жануарлар мембранасынан өте алмайды. Белоктардың тағы бір қасиеті – олар амфотерлі электролиттер. Молекулаларында бос карбоксил және амин топтары болатындықтан, олар оң немесе теріс электр зарядты болады. Химиялық табиғаты жағынан ақуыз биополимерлер тобына жатады.
Белоктың құрамында жиырма түрлі амин қышқылдары болады. Әр түрлі ақуыздардың амин қышқылы құрамы жағынан да, олардың тізбектегі орналасу тәртібі жағынан да бір-бірінен айырмашылығы зор. Табиғатта ақуыз түрлерінің көп болуы да осыған байланысты. Мысалы, үш амин қышқылының қосылуынан алты түрлі, төрт қышкылдан жиырма төрт түрлі ақуыз изомерлері пайда болады. Белок молекуласы амин қышқылдарының өзара моншақтай тізіле байланысқан полипептидтік тізбегінен құралады. Белок молекуласының сыртқы пішіні екі түрлі болады. Біріншісі – шар тәрізді домалақ – глобулярлы ақуыздар. Бұларға альбуминдер, глобулиндер, гемоглобин, пепсин және өсімдік жасушасының ақуыздары жатады. Екіншісі фибриллярлық (талшық тәріздес) ақуыздар. Бұларға бұлшық ет ақуызы – миозин, актин, сіңір ақуызы – коллаген және малдың жүні мен піллә жібегі ақуыздары жатады. Белок молекуласының өзіне тән ерекшеліктері мен құрылымдылық дәрежелері көптеген сутектік байланыстар, электрстатикалық қуаттар, күкірттен құралатын дисульфидтік байланыстар, т.б. жағдайлар арқылы қамтамасыз етіледі. Белок ерітіндісін қыздырса немесе оған күшті кышқылмен әсер етсе, ол өзінің табиғи қасиеттерін (ферменттік, гормондық) жояды, кейде ұйып та қалады. Мұндай құбылысты денатурация деп атайды. Белок – адам тағамы мен жануарлар қорегінің, сондай-ақ тері, жүн, жібек сияқты табиғи талшық заттардың негізгі құраушысы болғандықтан, 20 ғасырдың екінші жартысынан бастап оны қолдан өндірудің (микробиологиялық синтез) маңызы артып отыр.
Түзілуі.
Ақуыз түзілу бұл өте күрделі процесс жасушадағы ұсақ бөлшектер-рибосомаларда жүреді. Қашан, қанша және қандай ақуыз түзілуі керектігі жайлы мағлұмат жасуша ядросындағы ДНҚ, РНҚ арқылы жеткізіледі.
Белоктардың құрамы және құрылысы
Белоктардың қасиеттерін олардың құрамы мен құрылымы анықтайды. Белок молекуласындағы а-аминқышқылдары қалдықтарының саны әр түрлі болады, кейде бірнеше мыңға дейін жетеді. Әр ақуызта а-аминқышқылдары тек осы ақуызға ғана тән ретімен орналасады. Олардың молекулалық массалары бірнеше мыңнан миллионға дейін жетеді. Мысалы, жұмыртқа ақуызының молекулалық массасы 36000, бұлшық ет ақуызының молекулалық массасы — 150000, адам гемоглобині 67000, ал көптеген ақуыздардікі > 300000 шамасында. Белоктар, негізінен, көміртек (50—55%), оттек (20—24%), азот (15—19%), сутектен (6—7%) тұрады. Кейбір ақуыздардың құрамына бұлардан басқа күкірт, фосфор, темір кіреді. Белоктар гидролизденгенде а-аминқышқылдарының қоспасы түзіледі. Әрбір ағзаның өзіне тән ақуыздары бар. Барлық ақуыздар 20-дан астам әр түрлі а-аминқышқылынан құралады. а-аминқышқылдарының жалпы формуласы:
R—CHNH2—COOH.
Аминқышқылдарының декарбоксилденуі:
R
H2N-CH→R-CH2-NH2+CO2COOH
29.Организмдегі аммиактың залалсыздану жолдары.Орнитин цикліндегі мочевинаның түзілуі және организм үшін маңызы. Аминқ-ң дезаминдену нәтижесінде аммиак түзіледі.Аммиак өте улы зат,организмнен шығарылуы қажет.Қанның құрамында аммиактың концентрациясы 40-50мкмоль/л төиен болу керек.Бұл деңгейден жоғары болғанда аммиактың зиянды әсерінен мидың қызметі бұзылады да,ессіз күй пайда болады.Амминдік азот әртүрлі заттар т үрінде организмнен шығарылады. Адамда түзілген аммиактың 90% жуығы несепнәр түрінде шығарылады.Оның синтезі бауырда жүзеге асады.10%жуығы глутамин ж/е аспарагин түрінде шығарылады.Сүтқоректілерде азоттың көбісі организмнен мочевина түрде шығарылады.Мочевина бұл инертті,суда жақсы еритін,усыз зат.Несепнәр түзілетін жүйе орнитин циклі д/аталады.Несепнәр синтезі 5-сатыдан тұрады:1)цитрулиннің синтезі-екі реакция,2)аргининнің синтезі-екі реакция,3)несепнәрдің түзілуі-бір реакция.1-ші кезең:аммиак ж/е СО2байланысады да,карбомоилфосфат түзіледі.КФС 1 синтаза катализдейді.Бұл реакция іске асу үшін энергия қажет,ол АТФ 2 молекуласы ыдырағанда түзіледі.Одан соң карбомоилфосфат ж/е орнитин конденсацияланады да цитруллин түзіледі.Реакция орнитинкарбомоилтрансферазаның қатысуымен іскеи асады,митохондрияда өтеді.2-ші сатысында бауырда және цитоплазмада іске асады.Цитруллин аспартатпен конденсацияланып,аргининосукцинат түзіледі.Реакцияны аргининосукцинаткиназа катализдейді. Аргининосукцинат әрі қарай аргинин ж/е фумар қышқ-на дейін аргининосукцинатлиаза қатысуымен ыдырайды.3-ші сатыда аргинин ыдырап,несепнәр ж/е орнитин түзіледі,аогиназа ферментінің қатысуымен іске асады.
30.Гликонеогенез, сатылары энергия көзі.Глюконеогенез реакцияларының ерекшеліктерін көрсетіңіз.
Гликонеогенез- бұл көмірсу емес қосылыстардан глюкозаның синтезі. Организм көп энергия шығарып ауыр жұмыс атқарған кезде глюконеогенез маңызды қызмет атқарады.Адамдардағы гликоген түріндегі глюкозаның қоры бір күнгі зат алмасуына жетеді.Глюконеогенез шамалы мөлшерде бүйректе, ішектің шырышты қабатында, өте аз мөлшерде бұлшық етте, жүрек бұлшық етінде, ми клеткаларында жүзеге асады. Гликонеогенез клетканың цитозолында өледі.Глюкозаның пирожүзім қышқылынан синтезделуіне глиеолиз процесінің 7 ферменті қатысады,3 ферменті өзгеше болады.Гликолиз процесінің 7 реакциясы қайтымды, 3 реакциясы қайтымсыз.Гликолиздің қайтымсыз реакцияларын катализдейтін ферменттер-гексокиназа, фосфофруктокиназа,пируваткиназа глюконеогенезге қатыспайды.Жануарларда глюконеогенездің негізгі орны-бауыр.Аминқышқылдарының көбісінің ыдырау процесі нәтижесінде аралық заттар ретінде пируват немесе қымыздысірке қышқылы түзіледі.Бұл қосылыстар глюконеогенез процесі арқылы глюкозаға айналуы мүмкін.Глюкоза жетпеген уақытта гликоген гидролизденеді де глюкоза түзіледі.Гликогеннің синтезі гликоногенез, ал гликогеннің гидролизі гликогенолиз деп аталады.
31. Крахмал мен гликогеннің ыдырауы, тыныс алу процестерінің түрлері. Тыныс алу процесінің жалпы схемасы. Гликлгеннің ыдырауы гликогенез деп аталынады. Гликоген фосфоролиз реакциясына ұшырап, оның молекуласынан глюкоза глюкозо-1-фосфат бөлінеді. Реакция гликогенфосфорилаза ферментінің қатысуымен жүзеге асады. Ферменттің әсерінен тармақталған полисахаридтік тізбектің соңынан моносахарид қалдықтары бөлінеді. Гликогенфосфорилазаның әсерінен а-1,4-гликозидтік байланыстары ғана гидролизге ұшырайды. Ал а-1,6-гликозидтік байланыстарт ыдырау үшінекінші фермент қызмет атқарады, бұл фермент амило- а-1,6-гликозидаза деп аталынады. Гликолизде май қышқылының тотығуында және үшкарбон қышқылдар циклнде түзілген НАДН және ФАДН2 молекулалары энергияға бай электрондарға ие. НАДН және ФАДН2 энергияға бай электрондары тыныс алу тізбегі арқылы оттек молекуласына тасымалданады, қосарланып көп энергия бөлінеді. Бұл энергия АТФ түзілуіне жұмсалады. Сонымен екі процесс НАДН және ФАДН2 тотығуы және АДФ фосфорлануы қосарланып,яғни тотыға фоффорлану жүзеге асады. Аэробтық тыныс алу кезінде пируват Кребс циклі деп аталатын өзгерістердің күрделі циклінен өтеді. Бүкіл гликолиз процесі аэробтық тыныс алу кезінде пируват Кребс циклі деп аталатын өзгерістердің күрделі циклінен өтеді. Бүкіл гликолиз процесі аэробтық тыныс алудың бірінші кезеңінде өтеді. Аэробты тыныс алу кезінде пируват ең алдымен тотығу декарбоксилдену процесіне ұшырайды. Ол клеткаларда А ацетилкоферментіне дейін тотығады. Бұл процесс бес кезеңде өтеді, оған пируват – дегидрогеназа деген аса күрделі мультиферменттік комплекс қатысады.
Қорыта айтқанда, глюкозаның бір моліне АТФ –ның 38 молі түзіле алады. АТФ –ның макроэргиялық байланысында 25,1 –58, 6 кДж /моль энергия шоғырланады. Гидролиз кезінде олар бөлініп шығады. Тұтасымен алғанда, аэробтық тыныс алудың энергетикалық тиімділігі 55 % -ке жуық болады, яғни пайдалы әсер коэффициенті 0,5 тен деген сөз. Энергияның қалған мөлшері жылу түрінде бөлініп шығады. Ал анаэробты тыныс алу- Глюкозаның анаэробты тотығып ыдырауы – оттексіз процесс, тотықтырғыш ретінде ерекше заттар қызмет атқарады. Тотықтырғыш ретінде НАД¯қызмет атқарады. Анаэробты гликолиздің реакциялары пируватқа дейін аэробты гликолизде ұқсас. Одан әрі қарай пируваттың өзгеруі өзгеше болады. Адам мен жануарлар клеткаларында және бактерияларды пируват лактатқа, ашытқы клеткаларына этанолға айналады. Пируваттың лактатқа айналуы-пируват анаэробты жағдайда НАД-Н қатысында тотықсызданып, лактатқа айналады. Бұл реакцияны лактатдегидрогеназа ферменті катализдейді. Түзілген НАД¯ гликолиз процесінде глицеральдегид-3-фосфаттың тотығуы үшін жұмсалынады. Анаэробты гликолиз адам мен жануарлардың әр түрлі клеткаларында жүзеге асуы мүмкін, мыс.эритроциттерде, бұлшықетте, бүйрек клеткаларында. Ол клетккалар үшін анаэробты гликолиздің маңызы өзгеше. Лактат сүтқышқылды микроорганизмдердің де ақырғы өнімі. Сүтқышқылды микроорганизмдерде глюкозаның лактатқа дейін ыдырауы сүтқышқылдық ашу процесі д.а. пируваттың этил спиртіне айналуы- анаэробты жағдайда ашытқы клеткаларында глюкозадан гликолиз процесі арқылы түзілген пируват этанолға айналады, бұл спирттік ашу процесі д.а. пируваттың этанолға айналу реакциялары пируватдекарбоксилаза ферменті катализдейді. Анаэробты гликолиз арқылы 1 моль глюкоза ыдырағанда 2 моль лактат сонымен бірге 4 моль АТФ түз
Тыныс алу процесіндегі гликолиздің,анаэробты және аэробты сатыларының ақырғы өнімдері,түзілетін жалпы энергия мөлшерін есептеңіз. Гликолиз-анаэробтық жағдайда бұлшық етте глюкозаның ыдырауы.Гликолиз деген термин гректің glycos-қант,тәтті, lysis-еру деген сөздерінен шыққан.Гликолиздің ақырғы өнімі пирожүзім қышқылы кейде лактат болады.Гликолиз процесі кезінде бос энергия бөлініп шығады,ол энергия АТФ молекуласында жинақталады.Гликолиз көптеген биологиялық жүйелер үшін углеводтар метоболизмінің әмбебап процесі.Гликолиз процесі бұлшық еттерден басқа ашытқы да да,бактерияларда да жүреді.Гликолиз клетка цитозольында жүреді ол аздаған энергия береді. Гликолиз нәтижесінде бөлінген қуат (энергия) организмнің тіршілігі үшін пайдаланылады. Гликолиз организмдегі тыныс алу және ашу процестерімен тікелей байланысты.Гликолиз реакцияларының түрлері.
1.Глюкозаның фосфорлануы. Гликолиз реакциясы АТФ есебінен глюкозаның С-6-жағдайын фосфорлаудан басталады,оның нөтижесінде глюкозо-6-фосфат түзіледі.Бұл реакция қайтымды емес,гны гексокиназа ферменті катализдейді.Осы реакцияны катализдейтін екінші фермент-глюкокиназа,гексоза қалыптан тыс көп болған кезде әсер ете бастайды.Гексокиназа ферменті жануарлар,өсімдіктер және микробтар клеткаларында табылған.Ал глюкокиназа тек бауырда ғана табылған.
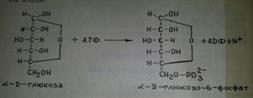
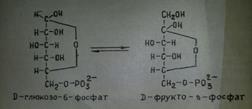
2.Глюкозо-6-фосфаттың фруктозо-6-фосфатқа айналуы. Бұл реакция қайтымды,ол фосфоглюкоизомераза ферментінің (адам ферментінің м.м 134 000) қатысында өтеді.Реакция нәтижесінде альдоза (глюкозо-6-фосфат) изомерленіп кетозаға (фруктозо-6-фосфатқа) айналады.
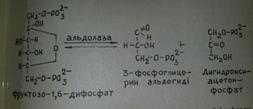
3.Фруктозо-6-фосфаттың фруктозо-1,6-фосфат түзіп фосфорлануы. Бұл гликолиздің басталу реакциясы.Фруктозо-6-фосфат АТФ есебінен фруктозо-1,6-дифосфат түзіп фосфорланады.Mg қатысында реакцияны фосфофруктокиназа ферменті катализдейді.

4. Фруктозо-1,6-диофосфаттың 3-фосфоглицерин альдегид және дигидроксиацетонфосфатқа айырылып ыдырауы. Бұл екеуінің молекуласында үш көміртегі атомы бар.Фруктозо-1,6-диофосфаттағы С-3 пен C-4 арасындағы байланысты альдолаза ферменті үзеді.Бұл реакция қайтымды,келтірілген екі фосфотриозодан фруктозо-1,6-дифосфат түзілуі мүмкін.
5.Гликолиздегі бұдан кейінгі өзекті субстрат-3-фосфоглицерин альдегиді. 3-фосфоглицерин альдегиді мен дигидроксиацетонофосфат құрылымы жөнінде жақын және тризофосфатизомераза ферментінің әсерінен өзара бір біріне айнала алады.Осылайша Фруктозо-1,6-диофосфаттың бір молекуласынан 3-фосфоглицерин альдегидінің екі молекуласы түзіледі.
6.3-фосфоглицерин альдегидінің тотығуы. Глюкозаның осы кезеңінен бастап глюкоза энергиясы АТФ-ға жинала бастайды. 3-фосфоглицерин альдегидінің тотығуы оның 1,3-дифосфоглицератқа айналудан басталады,Бұл реакцияға H3PO4 пен НАД қатысады,реакцияны глицеральдегид-3-фосфат-дегидрогеназа ферменті катализдейді.Тотығу энергиясы жоғары қуатты фосфат байланысы түрінде жинақталады.

7.1,3-дифосфоглицераттан АТФ-ның түзілуі. Жоғарғы энергиялы байланысы бар фосфат 1,3-дифосфоглицераттан АДФ-ке ауысады да,АТФ түзеді,ал АТФ те тотығудан шыққан бос энергия жинақталады.Реакция фосфоглицераткиназа ферментінің әсерімен жүреді,АТФ және 3-фосфоглицерат түзіледі.
Глюкозаның бір молекуласынан 3-фосфоглицерин альдегидінің екі молекуласы түзілетіндіктен,реакция барысында екі молекула АТФ және екі молекула НАД-H пайда болды.

8.3-фосфоглицерат 2-фосфоглицератқа айналуы. Бұл реакция молекула ішіндік қайта құру реакциясына жатады және оны фосфоглицеромутаза ферменті катализдейді.Осы фермент әсерінен фосфат 3-жағдайдан 2-жағдайға орын ауыстырады және 3-фосфоглицерат 2-фосфоглицератқа ауысады.

9.Пируваттың енольдық формасының түзілуі. 2-фосфоглицерат енолаза ферментінің әсерімен дегидратацияға ұшырайды,бұл кезде су молекуласы,бөлініп шығады және фосфоенолпируват түзіледі.Осындай молекулаішіндік қайта құру нәтижесінде жоғары энергиялы байланыс қалыптасады,Mg немесе Mn қатысқан жағдайда енолаза ферменті активтенеді.
10.Пируват пен АТФ түзілуі. Гликолиздің соңғы сатысында жоғары энергиялық байланысы бар фосфат фосфоенолопируват молекуласынан АДФ ке ауысады.Бұл кезде АТФ және пируват түзіледі.Реакция Mg және K иондары қатысында пируваткиназа ферментінің әсерімен жүреді.
11.Пируваттың лактатқа айналуы. Пируват анаэробты жағдайда НАД-Н коферменті қатысында тотықсызданып,лактатқа айналады.Бұл процесті лактатдегидрогеназа ферменті катализдейді.

12.Этил спиртінің түзілуі. Глюкозаның анаэробтық метаболизмі кезінде,ашытқы қатысқанда және гликолиз процесінде пируватдекарбоксилаза ферментінің әсерімен пируват ацетальдегидке дейін қайтымсыз декорбоксилденеді.Пируватдекарбоксилаза ферменті жануарлар тканінде болмайды.

Дата добавления: 2016-01-05; просмотров: 1; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
