Катиондарды талдаудың қышқылды-сілтілік жүйесі. Жүйе бойынша катиондардың жіктелуі,топтық реагенттері.
Катионды талдаудың бірнеше түрі бар:
1. Сілтілік жүйе – сульфид, хлорид, карбонат тардың ергіштігіне негізделген.
2. Амиакты фосфадты жүйе карбонаттарды 5 топқа бөледі. Бұл жүйемен талдау өте күрделі және өте көп уақытты алады.
3. Қышқылдық сілтілік жүйе – амиак ертіндісіне, тұз қышқылы, күкірт қышқылы ертінділеріне байланысты катиондарды 6 топқа бөледі.
1) Na+, K+, NH4+ топтық реагенті жоқ, барлығы суда ериді.
2) [Hg2+], Ag+, Pb2+ топтық реагенті HCL
3) Ca2+, Ba2+, Sr2+ топтық реагенті H2SO4
4) Al3+, Zn2+, Cr3+, As3+, As5+, Sn2+, Sn4+ топтық реагенті NaOH, KOH артық мөлшерде.
5) Mn2+, Mg2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb5+ топтық реагенті NaOH, KOH артық мөлшерде
6) Cu2+, Cd2+, Hg2+, Ni2+, Co2+ ортақ реагенті NH4OH артық мөлшерде
29 Коллоидты ертінділер,пептизация, коагуляция процестеріне түсінік. Коллоидты жүйе туралы зерттеулерді итальян оқымыстысы Ф Сельми 1845 жылы жүргізді.Ол белгілі көлемдегі суда таралған күкірт, хлорлы күміс, берлин көкшіл бояуы сияқты жүйелерді зерттеді. Ол басқа мысалы ас тұзы ерітіндісіне қарағанда бұл ерітінділердің бөлшектерінің үлкен ірілеу екенін байқады. Ал 1861 жылы Томас Грэм коллоидты химияның дамуы үшін өте маңызды зерттеулер жүргізіп, дисперсті жүйені диффузия жылдамдығына қарап, жақсы және нашар еритін диффузияланушы деп екі класқа бөлді. Оларды крисаллоидтар және коллоидтар деп атады. Т.Грэм кристаллоид пен коллоидты бір-бірінен бөліп алу әдісін ашты және бұл әдісті диализ деп атады. Бір зат өте майда түрде /дисперсті фаза/ басқа бір зат / дисперсті ортада/ көлемінде біріңғай таралса, ол жүйені дисперстік жүйе дейді.
Дисперстік фаза мөлшеріне орай ірі және майда дисперсті жүйе болады.Егер бөлшекткрдің мөлшері 10 -3-10 -5см болса, оларды ірі дисперстік жүйе дейді. Оларға суспензиялар (қ/с), эмулсиялар (с/с) және көбіктер жатады. Дисперсті фазаның бөлшектерінің мөлшері 10 -5-10 -7см болса, майда дисперстік жүйе дейді. Оларды коллоид ерітінділер немесе зольдер дейді. Зольдерді диспергирлеу (майдалау)және конденсациялау/ұлғайту/ әдістерімен алады.Екі жағдайда да дисперстік фаза дисперстік ортада ерімеуі тиіс. Зольдің құрамында дисперстік фазаның бөлшектері үлкен агрегаттарға бірікпеуі үшін арнайы зат- стабилизатор қосады. Золь арқылы /суспензия мен эмульсия арқылы да/ сәуле өткізгенде жарқыраған конус байқалады. Оны Тиндаль конусы дейді. Бөлшектердің бір- бірімен бірігіп үлкен бөлшекке айналуы және олардың тұнбаға түсуі коагуляция деп аталады. Бұған қарама – қарсы процесті пептизация дейді.
|
|
|
|
|
|
30 Комплексондар туралы түсінік. Комплексономертрия әдісінде эквивалент нүктесін қалай анықтайды. Комплексон деп аталатын кейбір органикалық реактивтермен комплекстік қосылыстар түзетін иондарды анықтау реакцияларына комплексонометрия негізделген. Мұнда өте берік, суда жақсы еритін комплекстік қосылыстар түзеді. Әдіс тездігімен және жоғары дәлдігімен ерекшеленеді. Комплексондар аминополикорбон қышқылдарының туындысы болып табылады.
31 Комплексонометрия әдісіне түсінік.Комплексонометрия әдісінде қолданылатын индикаторлар. Комплексонометриялық титрлеу ертеректен белгілі (150 жылдан астам). Алғашқы жұмыстар иодид ионын анықтауға жатады. KI+Hg(NO3)2=K2[Hg]4+2KNO3 Бейорганикалық титранттар қазіргі уақытта шектеулі қолданылады. Оларды ішінен ең кең тарағаны хлоридтерді, бромидтерді, роданидтерді, цианидтерді және тиомочевинаны миркуриметриялық титрлеу әдісі. 4KX+Hg(NO3)2=K2[HgX4] +2KNO3 органикалық титранттар айтарлықтай көп тараған. Соңғы уақытта тиолдар, купферсон, дитизон және басқалар қолданып жүр. Комплексонометрия реакцияларына қойылатын жалпы талаптар барлық титриметриялық әдістегілерге ұқсас: - олар тез, соңына дейін, қосымша процесстерсіз және т.с.с. өтуі керек.Комплексонометрия әдісінде эквиваленттік нүктені анықтау үшін арнайы қолданылатын индикаторлар металлды индикаторлар деп аталады. Олардың ішінде аса маңызды хромоген қара, қышқылдық хром қара – көк және мурексид.Бұл индикаторлар металл иондарымен әрекеттесіп, боялған комплексті қосылыс түзеді. Бұл қосылыстың түсі бос индикатордың түсінен өзгеше болуы керек. Трилон бмен титрлегенде, ол металл ионымен бпйланысып, индикатор бос күйінде бөлініп шығады. Мысалы:
|
|
|
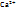 + 2HJnd
+ 2HJnd 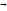
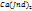 +
+ 
Түссіз көк қызғылт
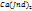 +
+ 
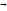
 + 2HJnd
+ 2HJnd
Қызғылт түссіз түссіз күлгін
Металл иондары сілтілік ортада көбірек байланысады. Ең қолайлы шама болып рН = 10 есептеледі, сондықтан да титрлеу үрдісі аммиакты буферде жүргізіледі.
Дата добавления: 2016-01-03; просмотров: 1; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
