Решение задач на определение молекулярных формул веществ по массам, или объёмам продуктов сгорания и относительной плотности.
Практическое занятие: «Расчёты массы или объёма продукта реакции, если одно из исходных веществ дано в избытке»
Первое действие.
Изучить условие задачи, записать краткое условие (что дано и что неизвестно); составить уравнение реакции;
над формулами веществ записать значения, данные по условию задачи и неизвестное с единицами измерения, под формулами веществ записать значения согласно уравнению реакции.
Второе действие.
Значение одного из исходных веществ принять за неизвестное, хотя оно дано по условию задачи, и рассчитать, сколько моль, г или л этого вещества требуется для реакции.
Третье действие.
Сравнить значение исходного вещества данное по условию задачи с тем значением, что требуется для реакции и сделать вывод в избытке или в недостатке дано вещество (если значение по условию задачи больше того, что требуется, пишем, что вещество дано в избытке; при этом значение второго исходного вещества будет в недостатке и полностью вступит в реакцию; если значение по условию задачи меньше того, что требуется, пишем, что вещество дано в недостатке).
Четвёртое действие.
Рассчитать значение продукта реакции по значению исходного вещества, данного в недостатке. Записать ответ.
! Если в условии задачи даны количества исходных веществ, или количество одного из исходных веществ, то лучше все расчёты выполнять через количества веществ и только в последнем действии перевести количество продукта реакции в те единицы измерения, которые требуются по условию задачи.
|
|
|
Решите задачи:
1. Сколько л этана в перерасчёте на нормальные условия можно получить из газовой смеси, содержащей 1,12 л ацетилена и 3,36 л водорода?
2. Сколько г бромбензола можно получить при нагревании смеси, содержащей 3,9 г бензола, 0,1 моль брома и примесь бромида железа (III)?
3. Сколько г нитробензола можно получить при нагревании смеси, содержащей 7,8 г бензола, 9,45 г азотной кислоты и примесь серной кислоты?
4. Сколько г хлорэтена можно получить из газовой смеси, содержащей 1 моль хлороводорода и 16,8 л ацетилена?
«Решение задач на определение молекулярных формул веществ по массовым долям химических элементов в нём и относительной плотности»
Основные величины и формулы, необходимые для решения задач:
Аr(х.э.) - относительная атомная масса химического элемента;
Мr(в-ва) - относительная молекулярная масса вещества;
ω(х.э.) % - массовая доля химического элемента в молекуле ω(х.э.) % = 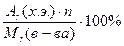
n - число атомов химического элемента в молекуле;
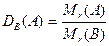 - относительная плотность газа А по газу B
- относительная плотность газа А по газу B
Изучите алгоритмы решения на примере задач:
Задача 1. Плотность паров алкана по водороду равна 50. Выведите молекулярную формулу алкана.
|
|
|
Решение: Общая формула алканов СnН2n +2. Относительная атомная масса углерода Аr(С) = 12, относительная атомная масса водорода Аr(Н) = 1.
Относительная молекулярная масса алкана: Мr(СnН2n+2)=12n + 2n + 2 = 14n + 2
По плотности газа по водороду и относительной молекулярной массе водорода вычисляем относительную молекулярную массу искомого алкана:
Мr(СnН2n+2)=DH2(СnН2n+2) . Мr(Н2) = 50 .2=100. Составляем уравнение: 14n + 2 = 100 n = 7.
Ответ: молекулярная формула вещества: С7Н16.
Задача 2. Относительная плотность паров углеводорода по азоту равна 3. Массовая доля углерода в нём равна 85,71%, а водорода - 14,29%. Выведите молекулярную формулу вещества.
Записываем краткое условие задачи:
Дано: ω(C) = 85,71%, ω(H) = 14,29%, DN2(CxHy) = 3.
Найти молекулярную формулу.
Решение:
1. Вычисляем относительную молекулярную массу углеводорода по его относительной плотности: Мr(СхНу) = DN2 (СхНу) . Мr(N2) = 3 . 28 = 84 .
2. Находим число атомов углерода в молекуле(Y), используя формулу для определения массовой доли химического элемента в веществе: 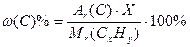 , следовательно
, следовательно 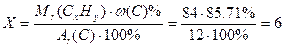
3. Аналогично определяем число атомов водорода в молекуле (Y):
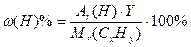 , следовательно
, следовательно 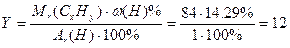
Ответ: молекулярная формула вещества: С6Н12
|
|
|
Решение задач на определение молекулярных формул веществ по массам, или объёмам продуктов сгорания и относительной плотности.
Основные величины и формулы, необходимые для решения задач:
М(в-ва) - молярная масса вещества (г/моль)
Vм=22,4 л/моль – молярный объём газа (при н.у.)
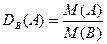 - относительная плотность газа А по газу B.
- относительная плотность газа А по газу B.
m = 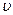 ∙M – масса вещества; V(газа) =
∙M – масса вещества; V(газа) = 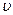 ∙VM – объём газа
∙VM – объём газа
Изучите алгоритм решения на примере задачи:
Относительная плотность паров органического вещества по водороду равна 51. При сжигании 30,6 г этого вещества образовалось 79,2 г углекислого газа и 37,8 г воды. Определите молекулярную формулу вещества.
Запишем краткое условие задачи.
По продуктам сгорания вещества, очевидно, что оно состоит из атомов углерода, водорода и кислорода. Запишем его формулу в виде СXНYОZ.
Дано: DH2(СXНYОZ) = 51, m(СXНYОZ) = 30,6 г, m(CO2) = 79,2 г, m(H2O) = 37,8 г
Найти молекулярную формулу вещества.
Решение:
1. Найдём молярные массы сгоревшего вещества, углекислого газа и воды:
M(СXНYОZ) = DH2(СXНYОZ) ∙ M(H2)=51 ∙ 2 = 102( г/моль); M(СО2) = 12+ 16 ∙ 2 = 44 (г/моль);
M(Н2О) = 1∙ 2 +16 = 18 (г/моль)
2. Составим уравнение реакции горения и расставим коэффициенты, уравнивающие число атомов углерода и водорода:
|
|
|
СXНYОZ + О2à ХСО2 +Y/2Н2О
Над формулами веществ запишем данные задачи. Под формулами веществ – количества веществ и соответствующие им массы.
30,6 г 79,2 г 37,8 г
СXНYОZ + О2à ХСО2 + Y/2Н2О.
ν =1 моль ν =Х моль ν =Y/2 моль
M = 102 г/моль М = 44 г/моль М = 18 г/моль
m = 102 г m = 44 Х г m = 9 Y г
3. Составим и решим пропорцию для поиска значения «Х»:
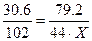 ;
; 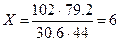
Аналогично найдём значение «Y»:
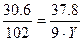 ;
; 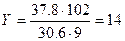
Промежуточный результат – С6Н14Оz .
4. Зная относительную молекулярную массу вещества, составим уравнение для поиска
значения Z: 102=12 ∙ 6 + 14 + 16∙Z
(где, Аr(C) = 12, Ar(H) = 1, Ar(O) = 16)
Решим уравнение: 16 ∙ Z = 102 - 72 – 14; 16 ∙ Z = 16; Z = 1
Ответ: формула органического вещества - С6Н14О
Решите задачи:
1. Относительная плотность паров алкина по кислороду равна 2,125. Выведите молекулярную формулу алкина.
2. Относительная плотность паров углеводорода по углекислому газу равна 2,41. Массовая доля водорода в нём равна 9,43%. Выведите молекулярную формулу углеводорода.
3. Относительная плотность углеводорода по водороду равна 15. Массовая доля углерода в нём равна 80%. Выведите молекулярную формулу углеводорода.
4. Плотность паров органического соединения по кислороду равна 4,25. При сжигании 13,6 г этого вещества образуется 39,6 г оксида углерода(II) и 10,8 г воды. Выведите молекулярную формулу органического вещества.
5. Плотность паров органического вещества по воздуху равна 3,31 (относительная молекулярная масса воздуха - 29). При сжигании 24 г этого вещества образовалось 39,2 л углекислого газа (н.у.) и 27 г воды. Выведите молекулярную формулу этого вещества. 
6. При сжигании 7 г органического вещества получили 22 г оксида углерода (IV) и 9 г воды. Плотность паров этого вещества по водороду равна 42. Какова его молекулярная формула?
7, При сжигании 20,4 г органического вещества получили 66 г оксида углерода(IV) и 21,6 г воды. Плотность паров этого вещества по водороду равна 34. Какова его молекулярная формула?
8. При сжигании 0,29 г газообразного органического вещества получили 0,88 г оксида углерода (IV) и 0,45 г воды. Плотность этого газа по воздуху равна 2. Какова его молекулярная формула?
9. При сжигании 20,4 г органического вещества получили 66 г оксида углерода(IV) и 21,6 г воды. Плотность паров этого вещества по водороду равна 34. Какова его молекулярная формула?
2. Самостоятельно изучить темы: Алкины, Арены, природные источники углеводородов. Составить конспект.
Номер варианта в контрольной работе №5 выбрать следующим образом:
номер варианта определяется по Вашему номеру в списке группы: если номер от 1 до 14 и нечетный - вариант 1, четный – вариант 2; номер 15 и далее нечетный – вариант 3, четный – вариант 4.
3. Выполнить контрольную работу и прислать для проверки.
Дата добавления: 2023-01-08; просмотров: 14; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
