Ответ на вопрос 4. Изохорный процесс, Изобарный процесс, Адиабатный процесс, Политропный процесс, процесс преобразования , удельная теплота парообразования , теплопроводность.
Лекция № 1 (ЭСЭУ-33, Диордица А.Ю 30.11.16г - 6.12.16г.)
Тема: «Основные сведения из теплотехники»
Рассматриваемые вопросы:
1) Температура, количество теплоты, удельная теплоемкость и показатель адиабаты.
2) Энтальпия и энтропия.
3) Закон Бойля – Мариотта, Закон Гей – Люссака, Закон Шарля, Закон Авогадро, уравнение состояния, основные процессы идеальных газов.
4) Изохорный процесс, Изобарный процесс, Изотермический процесс, Адиабатный процесс, Политропный процесс, процесс преобразования, удельная теплота парообразования, теплопроводность.
5) Диаграмма Молье
Ответ на вопрос 1. Температура, количество теплоты, удельная теплоемкость и показатель адиабаты.
Все рабочие тела состоят из мельчайших частиц- молекул . Энергия кинетического движения и взаимодействия частиц, из которых состоит тело, называется тепловой энергией тела. Тепловая энергия тела зависит от его состояния и может быть преобразования энергии характеризуется рядом понятий, физических велечин , зависимостей.
Основные из них применительно к рабочему телу , находящемуся в газообразном состоянии , приведены ниже.
Температура t - величина, характеризующая тепловое состояние тела. Температура измеряется в градусах. В единицах СИ предусматривается применение двух температурных шкал : абсолютной шкалы Кельвина ( К ) и шкалы Цельсия ( оС ). Шкалы отличаются началом отсчета. Температура по шкале Кельвина (абсолютная температура, К) отсчитывается от температуры абсолютного нуля, при которой не должно быть теплового движения молекул . Температура по шкале Цельсия (оС) отсчитывается от температуры таяния льда, которая равна 273,16 К,
|
|
|
t = T-273,16 К
где t – температура по шкале Цельсия, оC;
T - температура по шкале Кельвина , К;
Количество теплоты Q - количество внутренней энергии, которое рабочее тело получает или теряет при теплопередаче. Единица измерения в СИ- джоуль ( Дж ), т.е. количество теплоты, эквивалентное механической работе в 1 Дж. На практике применяют единицу – калорию (кал).
Калория – это количество теплоты, которое необходимо затратить для нагревания 1г воды на 1 оС. 1 кал = 4,19 Дж.
Удельная теплоемкость с – количество теплоты, которое необходимо затратить для нагревания единицы массы тела на 1 К. Измеряется в джоулях на килограмм – кельвин – Дж/(кг∙К). Взависимости от условий нагревания теплоемкость при постоянном объеме сv.
Отношение сp/сv = К называют показателем адиабаты. Для двухатомных газов К = 1,4 , для перегретого пара К = 1,3 , для сухого насыщенного пара К = 1,135.
Внутренняя энергия U – кинетическая энергия микроскопических тепловых движений молекул и потенциальная энергия их взаимодействия, рассчитывается на единицу массы. Для любого состояния газа U = cv∙T. Измеряется в джоулях на килограмм (Дж/кг).
|
|
|
Ответ на вопрос 2. Энтальпия и Энтропия.
Энтальпия I – сумма внутренней энергии U газа и работы p∙V, которую может совершить 1 кг газа, расширившись при постоянном давлении p от объема, равного 0, до величины V. Для любого состояния газа.
I = U + pV = cpT.
Измеряется в джоулях на килограмм (Дж/кг).
Энтропия S – функция, косвенно характеризующая состояние газа. Связана с параметрами газа следующим образом:
dS = 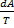 = cv
= cv  + R
+ R  ,
,
где d – знак дифференциала;
A – работа, совершаемая газом , Дж;
R – газовая постоянная.
Для конечного измерения состояния 1 кг газа, имевшего первоначальную температуру T1 и удельный объем  1 и окончательную температуру T2 и удельный объем
1 и окончательную температуру T2 и удельный объем  2, разность энтропий рассчитывается по формуле
2, разность энтропий рассчитывается по формуле
S2 – S1 = cv ln 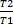 + R ln
+ R ln  .
.
Формула используется для проведения аналитических расчетов и удобна для геометрического описания процессов на диаграмме, по оси абсцисс которой отложена величина энтропия S, на оси ординат – величина температуры T ( диаграмма T – S ). Измеряется в джоулях на килограмм ( Дж/кг ).
|
|
|
Ответ на вопрос 3. Закон Бойля – Мариотта, Закон Гей – Люссака, Закон Шарля, Закон Авогадро, уравнение состояния, основные процессы идеальных газов.
Закон Бойля – Мариотта. Произведение давления p данной массы газа на его объем V при неизменной температуре постоянно: pV = const , или p  = const, где
= const, где  – удельный объем.
– удельный объем.
Иначе говоря, для данной массы газа при неизменной температуре объема газа уменьшится во столько раз, во сколько увеличится давление. Если первоначальное давление газа p1 и он занимал объем V1, то при давление p2 газ будет занимать такой объем V2, при котором справедливо равенство
p1V1 = p2V2.
Закон Гей – Люссака. Для данной массы газа при постоянном давлении изменение объема газа при постоянном давлении изменения объема газа прямо пропорционально температуре:
V = V0 (1 +  t), или
t), или 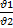 =
=  ,
,
где V – объем газа при температуре tоC, м3;
V0 – объем газа при температуре 0оС, м3;
 – термический коэффициент объемного расширения
– термический коэффициент объемного расширения
(  =
=  К-1 );
К-1 );
 1,
1,  2 – удельные объемы газа при абсолютных температурах T1 и T2 соответственно, м3/кг.
2 – удельные объемы газа при абсолютных температурах T1 и T2 соответственно, м3/кг.
Закон Шарля. При постоянном объеме и неизменной массе давление газа изменяется прямо пропорционально изменению абсолютных температур:
|
|
|
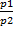 =
=  .
.
Закон Авогадро. Моли различных газов при одинаковых температуре и давлении занимают одинаковые объемы. Моль  (грамм-молекула) – масса вещества в граммах, численно равная молекулярной массе. В одном моле любого вещества число молекул одинаково. Это число называется числом Авогадро (NA). NA = 6,022 × 1023 моль-1.
(грамм-молекула) – масса вещества в граммах, численно равная молекулярной массе. В одном моле любого вещества число молекул одинаково. Это число называется числом Авогадро (NA). NA = 6,022 × 1023 моль-1.
Уравнение состояния – это уравнение, определяющее связь температуры T, объема V и давления p газа , имеющего массу m. Наиболее общая форма уравнения состояния Менделеева – Клапейрона:
p ∙V = 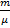 R0 ∙ T,
R0 ∙ T,
где  - масса грамм – молекулы газа;
- масса грамм – молекулы газа;
R0 – универсальная газовая постоянная , численно равная работе расширения 1 моля газа при нагревании его на 1оС.
Для 1 кг газа уравнения состояния имеет вид
p ∙V = 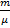 R0 ∙T,
R0 ∙T,
где  – масса грамм – молекулы газа ;
– масса грамм – молекулы газа ;
R0 – универсальная газовая постоянная , численно равная работе расширения 1 моля газа при нагревании его на 1оС.
Для 1 кг газа уравнение состояния имеет вид
p∙V = R ∙ T,
где R – газовая постоянная (различная для разных газов ) .

Основные процессы идеальных газов. Описывая процессы изменения состояния газов в корабельных устройствах в первом приближении считают, что газы идеальны , т.е. что силы сцепления между молекулами газов отсутствуют , а сами молекулы представляют собой материальные точки , не имеющие объема. Основные процессы идеальных газов:
Изохорный, изобарный, изотермический, адиабатный, и охватыващий, все остальные – политропный процесс.
Процессы анализируют аналитически, с помощью формул и изображают графически на различных диаграммах. На рис. 1.8 основные процессы изображены в диаграмме p – V.
На рис. 1.9 основные процессы изображены в диаграмме T – S.
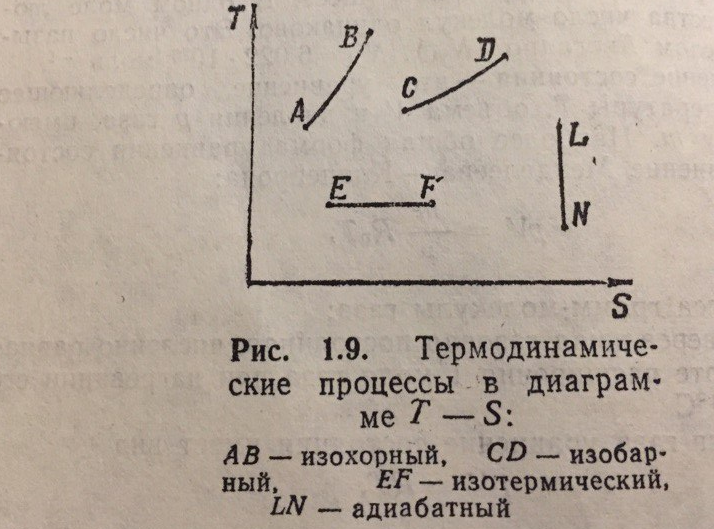
Ответ на вопрос 4. Изохорный процесс, Изобарный процесс, Адиабатный процесс, Политропный процесс, процесс преобразования , удельная теплота парообразования , теплопроводность.
Изохорный процесс – это процесс, протекающий при постоянном объеме. Линия AB, изображающая процесс графически, называется изохорой. Связь между параметрами газа при изохорном процессе определяется законом Шарля. При изохорном процессе все подводимое тепло расходуется на изменение внутренней энергии газа. Газ не изменяет своего объема, и работа расширения равна нулю
Изобарный процесс – это процесс, протекающий при постоянном давлении. Линия CD , изображающая процесс графически, называется изобарой. Связь между параметрами начального Vc , Tc и конечного состояния VD , TD выражается законом Гей – Люссака. При изобарном процессе газ изменяет свой объем и совершает работу расширения A:
A = p (VD – VC ).
Изотермический процесс – это процесс, протекающий при постоянной температуре. Линия EF, изображающая процесс графически , называется изотермой. Связь между параметрами состояния при изотермическом процессе определяется законом Бойля – Мариотта . При изотермическом процессе газ изменяет свой объем и совершает работу А:

Дата добавления: 2023-01-08; просмотров: 33; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
