Следовательно, кинетическое уравнение:
0 41,59
6,5 54,38
13 65,05
19,9 74,91
Найти константу скорости реакции 1го порядка.
Решение

14. Эфир разлагается в газовой фазе, образуя этилен и воду С2Н6О à Н2О + С2Н4
При конверсии 100% общее давление (∑Р) смеси равно 310 кПа (см. табл.).
Время, мин ∑Р(t), кПа
6,5 168
12 178
18 188
∞ 310
Найти константу скорости реакции 1го порядка.
Решение
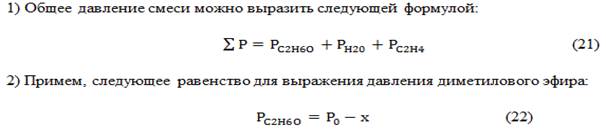


15. В газовой фазе протекает реакция 2 С4Н6 à винилциклогексен.
Общее давление (∑Р) реакционной смеси уменьшается во времени, как показано в табл.
Время, мин ∑Р(t), кПа
0 84,2
6,1 80,9
22 74,2
38 69,5
Найти константу скорости реакции 2го порядка.
Решение

В вакуумированном реакторе емкостью 100 мл протекает реакция разложения мела
(Sп= 0,1 м2/г): СаСО3 à СаО + СО2
В таблице указан объем выделившегося диоксида углерода (V) при НТД.
Время, мин V, мл
9 26
12,5 35,6
16,0 46,5
∞ 58,2
Найти константу скорости реакции (моль/(м2.мин)).
Решение



17. Хлористый азот разлагается в газовой фазе по уравнению: 2NCl3 à N2 + 3Сl2.
Концентрация азота в сосуде при конверсии 100% равна 20 ммоль/л; прочие данные см. табл.
|
|
|
Время, мин 10 30 ∞
Концентрация N2, ммоль/л 2 4,6 20,0
Найти константу скорости реакции 2го порядка.
Решение
2NCl3=N2+3Cl2
α(альфа)(t)=1/(1+kC0t)
α=V/V0=C/C0
При t=∞ C(N2)=20
C0(NCl3)=2*20=40
При t=10 мин
α=С(NCl3)/C0(NCl3)=40*2-2*3/40=0,8
0,8=1/(1+k*40*10)
k= 0,000625мин^-1
При t=30 мин
α=С(NCl3)/C0(NCl3)=40*4,6-4,6*3/40=0,54
0,8=1/(1+k*40*10)
k= 0,000709мин^-1
18.Н2О2 разлагается в газовой фазе по уравнению: Н2О2 à Н2О + ½ О2
Объем образовавшегося О2 при конверсии 100% равен 15,6 мл; прочие данные см. табл.
Время, ч 10 30 ∞
Объем О2, мл 3,3 8,1 15,6
Найти константу скорости реакции 1го порядка.
Решение
1) Для реакции первого порядка:
K=-lnα(альфа)/t; α=(V∞ - V∑(t))/V∞
2) Найдем α для различных t:
t= 0ч; α=1
t=10ч; α=(15,6-3,3)/15,6=0,788
t=30ч; α=(15,6-8,1)/15,6=0,481
t= ∞; α=0
3) Найдем k для различных t
t=0ч; k=-lnα/t=0
t=10ч; k=-lnα/t=0,2383/10=0,02383ч^-1
t=0ч; k=-lnα/t=0,02441ч^-1
t=0ч; k=-lnα/t=0
19. Константа скорости разложения органической перекиси при 293 К и 313 К равна 4,75.10-4 и 5,76.10-3 мин-1 соответственно. Найти константу скорости и время полураспада перекиси при 303К
Решение
k2/k1=(e^(-Ea/RT2))/(e^(-Ea/RT1))=e^(Ea/R(1/T1-1/T2))
|
|
|
12,13= e^(Ea/8,314(1/293-1/313))
Ln 12,13=2,5= Ea/8,314(1/293-1/313)
Ea=95308 Дж/моль
K303=k293* e^(Ea/R (1/293-1/303))
K303=k293* e^(95308/8,314 (1/293-1/303))=1,73*10^-3 мин^-1
t0,5=ln2/k=400мин
20. Константа скорости омыления этилацетата щелочью k=2,38.10-4 (М.с)-1 при 283 К Найти время полупревращения 1 л 0,1 н. раствора эфира при смешении с 1 л 0,2 н. раствора щелочи.
Решение

21. Константа скорости разложения N2О при 1173 К равна 0,85.10-5 мин-1. Найти время разложения N2О на 80% и скорость реакции в этот момент времени.
Решение


ДЗ2
22. Константы скорости разложения СН3СНО при 733 и 791 К равны 0,035 и 0,343 с-1 соответственно. Найти предэкспоненциальный множитель, энергию активации и константу скорости при 760 К.
Решение
Из уравнения Аррениуса:
k1 /k2 = exp[-E(T2-T1)/RT1T2] (1)
Выразим из (1) и найдем энергию активации E
E= -RT1T2/(T2-T1)*ln(k1 /k2)
E= -8,314*733*791/(791-733)*ln(0,035 /0,343)
E=189692,8 Дж/моль
Аналогично (1) имеем выражение для k3
k3 /k2 = exp[-E(T2-T3)/RT3T2] (2)
Выразим из (2) и найдем константу скорости k3 при температуре T3
k3 = k2*exp[-E(T2-T3)/RT3T2]
k3 = 0,343*exp[-189692,8(791-760)/8,314*760*791]
k3=0,148 с-1
Согласно уравнению Аррениуса: k1= Aexp[-E/RT1]
Откуда предэкспоненциальный множитель A:
A= k1/ exp[-E/RT1]=k1*exp[E/RT1]
A=0,035*exp(189692,8/8,314*733)=2,961с-1
Ответ: Энергия активации реакции E=189692,8 Дж/моль, константа скорости при T3: k3=1,49 ч-1, предэкспоненциальный множитель: A=2,961 с
|
|
|
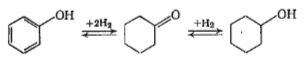
23. При гидрировании фенола (Ф) на палладии образуются циклогексанон (Цн) и циклогексанол (Цл). Найдено, что в диапазоне степени превращения фенола 10-60% селективность по циклогексанону постоянна и равна 90%. Предложите схему превращений реагентов Ф, Цн и Цл.
Решение
1) В зависимости от условий процесса, Цн может быть как продуктом гидририрования Ф, так и продуктом дегидрирования Цл, также образующегося в процессе гидрирования Ф:
2) При повышенных температурах и низких давлениях в смеси все еще присутствует Ф, который способен вступать в реакцию с образующимся Цл с образованием Цн:
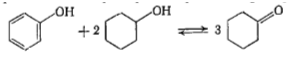
3) Учитывая условия задачи (конверсия Ф = 10-60% и селективность по Цн = 90%), наиболее возможным путем реакции является следующая последовательность:
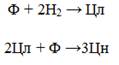
В случае такой схемы реакции, которая будет протекать при повышенных температурах и низких давлениях, возможно объяснить столь малую степень превращения Ф и высокую селективность по Цн.
24. При дегидрировании циклогексана на никеле, кроме бензола, образуется метан, концентрации (С) которых приведены ниже.
Время контакта, с 0,10 0,25 0,40
Сб, % 15 32 55
См,% 2,5 5,6 12,7
Предложите схему превращений реагентов.
|
|
|
Решение


И поскольку это отношение не стремится к 0 в начальный момент времени, это дает основание полагать, что данные реакции протекают параллельно. Предположительная схема:
циклогексан→бензол (дегидрирование)
циклогексан→метан (гидрокрекинг)
25. В кинетической области гетерогенная реакция имеет значения: Е= 64кДж/моль и порядок n= 2. Найти значения Е и n для этой реакции, протекающей во внутридиффузионной области.
Решение
Во внутридифф. области Евнд= ½ * Екин
Евнд = ½ *64 = 32 кДж/моль
Наблюдаемый порядок реакции равен (n-1)/2
nвнд = (2-1)/ 2 =1/2 = 0,5
26. Оцените наблюдаемое значение Енаб и порядок каталитической реакции во внутридиффуз. области, если в кинетической области: Еист = 100 кДж/моль и n = 1,5.
Решение

27. Оцените эффективную глубину проникновения реакции в слой пористого материала при Со= 0,1 М, Dэ = 0,15 см2/с и kэ= 0,52 М-1с-13
Решение
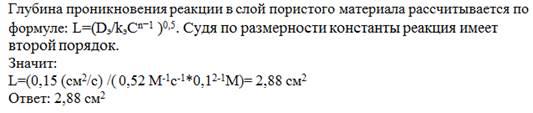
28. Найти критическую температуру воспламенения и адиабатический разогрев для параллельных реакций окисления: 1) С3Н6 + О2 à С3Н6О и 2) С3Н6 + О2 à 3СО2 + 3Н2О, если даны ΔН(1) = 56000 и ΔН(2) = 459000 кал/моль, Е1 = 22 ккал/моль, средн. Ср = 20 кал/(моль*К), Сг/ρ= 0,15, отнош. β/k = 12.
Решение
Критическая температура T*
T* = {0,7ΔHkECг/(k+β)Rcp ρ}0.5
ΔН(1) = 56000кал/моль=234640 Дж/моль
ΔН(2) = 459000 кал/моль=1923210 Дж/моль
Е1 = 22 ккал/моль=92180 Дж/моль
cр =20 кал/(моль*К)=83,8 Дж/моль*К
T*(1)=(0,7*234640*92180*0,15/(1+12)*8,314*83,8)0,5
T*(1)=500,74 К
T*(2)=(0,7*1923210*92180*0,15/(1+12)*8,314*83,8)0,5
T*(2)=1433,6 К
Самопроизвольный разогрев в реакционной зоне можно рассчитать в адиабатическом приближении, считая, что все тепло реакции идет на нагрев реакционной смеси. Тогда
ΔTад= ΔHRCо/cp ρ
ΔTад (1)=234640*0,15/83,8=420 К
ΔTад (2)=1923210*0,15/83,8=3442,5 К
Ответ и вывод: величины T*(1) и ΔTад(1) для реакции окисления пропилена в пропиленоксид составит 500,74 К и 420 К соответственно. Однако на самом деле самопроизвольный разогрев в реакционной зоне намного выше, поскольку при переходе в диффузионную область изменяется механизм реакции, и вместо селективного процесса идет полное сгорание до диоксида углерода и воды. В этом случае T*(2)=1433,6 К и ΔTад (2)=3442,5 К, т.е тепловой взрыв.
29. Cкорость окисления Н2S воздухом на MgCrOx катализаторе описывается уравнением r= k(PO2PH2S)0,5, k0=2.5 102 моль/(м2.атм.с) и Е= 35 кДж/моль. Найти скорость окисления при 500К, РH2S= 0.25 атм и Рвозд = 10 атм.
Решение

r= 2.5 102 моль/(м2.атм.с)*ехр(-35000/(500*8,314))* (0,21*10*0,25) атм= 5,5.10-2* 0,724 =0,0398 моль/(м2.с).
30. Cкорость восстановления NO водородом на CuCrOx катализаторе описывается уравнением r= 4k/[3+(bNOPNO)0,5/(bH2РH2)]. Найти скорость восстановления при 600К, если k= 3.4.10-6 моль/(м2.с); PNO = 0.5 атм и РH2 = 5 атм, и bNO0,5/bH2 = 2.5 атм0,5.
Решение
Известны значения всех переменных, входящих в уравнение скорости реакции. Для нахождения этой скорости в уравнение подставляем данные значения.

Ответ: скорость восстановления NO водородом на CuCrOx катализаторе равна 4,0554·10-6 м2/c
31. Окисление меди воздухом описывается уравнением (∆m)2 = k.t.S2. Насколько увеличится масса медной пластины S= 5 см2 за 1 час нагревания при 600 К, если k= 1.6.10-5 г2/(см4.с).
Решение
Т.к не указаны Т константы скорости начальной, то будем использовать из исходных данных
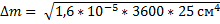 = 1,2 г
= 1,2 г
Ответ: 1,2 г
32. Окисление никеля воздухом описывается уравнением (∆m)2 = k*t*S2. Найти среднюю толщину оксидной пленки на медной пластине S= 10 см2 за 1 час нагревания при 720 К, если k= 8.10-4 г2/(см4.с).
Дано :
(∆m)2 = k*t*S2
S = 10 см2
t = 1 час
T=720К
k=8*10-4 г2/(cм4*с)
________________
дельта L - ?
Решение:
дельта m =  = 16,97 г
= 16,97 г
дельта m=ρ*V; V=m/ρ
V=S*L; L=V/ρ ; L= m/(ρ*S)
Пусть в результате окисления образовался α – NiO, ρ= 6,67 г/см3
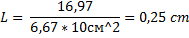
Ответ: 0,25 см
33. Предельная адсорбция азота на поверхности силикагеля равна 133 мл/г. Площадка адсорбированного азота равна 16 А2. Найти удельную поверхность силикагеля.
Решение
1 вариант
Удельная поверхность катализатора – отношение площади поверхности к массе катализатора:
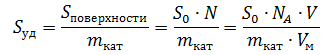
Предельная адсорбция – количество вещества (адсорбата), образующего монослой на 1 г катализатора, при полном заполнении его активной поверхности:

Следовательно, с учетом этого получаем формулу для расчета удельной поверхности катализатора:

Ответ: удельная поверхность силикагеля равна 571,9 м2/г
2 вариант

34. С ростом давления аргона его адсорбция (а) на активном угле увеличивается следующим образом:
Р, кПа 3,2 13,0 29,0
а, мг/г 5 15,4 24
Используя уравнение Лангмюра, найти долю поверхности угля, занятую аргоном, при давлении 10,0 кПа.
Решение.
Строим зависимость Р/а от Р, котангенс угла прямой = а∞, отр. на оси орд. = (а∞.b)-1= 5.7
Таким образом, находим а∞= 4.58 мг/г и b= 3.83.10-2 кПа-1
а(10 кПа)/а∞= bР/(1+bР). Доля поверхности (при 10 кПа)= 0,383/1,383 = 0,277.
35. Под действием излучения с длиной волны 230 нм разлагается 1 моль уксусной кислоты на метан и диоксид углерода. Квантовый выход реакции 0,5. Найти энергию, поглощенную реакционной смесью.
Решение
Энергия одного кванта с длиной волны 230 нм составляет:
E0=hc/λ=6,63*10-34*3*108/(230*10-9)=8,65*10-19Дж
Если принять, что одна молекула поглощает один квант излучения, тогда энергия излучения, поглощенная 1 моль вещества, составит
E=Na*E0=6,02*1023*8,62*10-19=518924 Дж/моль=518,925 кДж/моль
С учетом квантового выхода (то есть доли квантов, ведущих реакцию):
Eγ=γE=0,5*518,925=259,462 кДж/моль.
Ответ: Энергия, поглощенная реакционной смесь, составляет 259,462 кДж/моль.
36. При УФ-облучении (длина волны 207 нм) йодистого метила поглощается 5,8 кДж (5800 Дж) и разлагается 15,6 мг МеI. Найти квантовый выход реакции.
Решение
E0= (h*с)/Л(лямбда) = (6,63* 10-34*3*108)/207 *10-9 = 9,609*10-19Дж
Nпогл= E/ E0 = 5800/(9,609 * 10-19) = 6,036 * 1021
Nпрореаг= (Na* m(MeI))/M(MeI) = (6,02*1023*(15,6/1000)) / 142 = 6,614 * 1019
y(гамма) = Nпрореаг/Nпогл= (6,614 * 1019)/(6,036*1021)= 0,01096
Ответ: 0,01096
37. При горении угля в области температур 600-1000оС найдены значения начальной скорости реакции:
Т, оС 600 700 800 900 1000
r0, от.ед. 0,45 2,15 6,80 13,7 19,5.
Кинетическое уравнение имеет вид: r0 = k.PO2. Найти энергию активации (Еа) в кинетической области и температуру, при которой реакция из этой области переходит во внешнедиффузионную. Можно ли считать Еа истинной энергией активации?
Решение
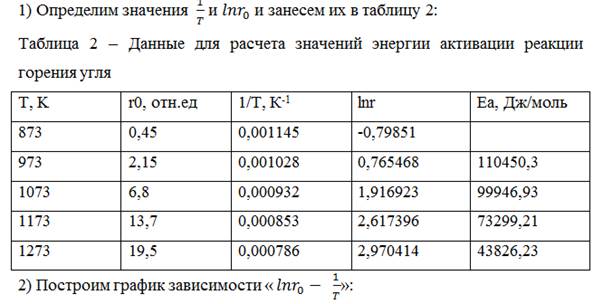
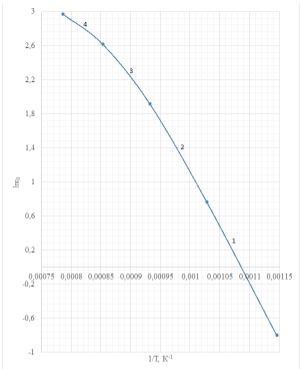
3) По рисунку видно, что отрезки 1 и 2 имеют примерно одинаковый угол наклона, угол наклона отрезков 3 и 4 значительно меньше. Можно предположить, что отрезки 1 и 2 относятся к кинетической области процесса, а 3 и 4 – к диффузионной. Проверим это, рассчитав для каждого отрезка энергию активации по формуле:
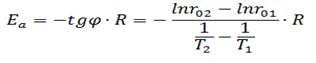
Занесем полученные значения в таблицу 1.
4) По полученным энергиям активации (табл.2) видно, что для отрезков 1 и 2 значения энергии активации почти не отличаются по сравнению со значениями для отрезков 3 и 4.
5) Таким образом, для кинетической области энергия активация:
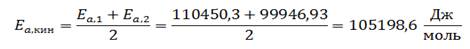
Данное значение энергии активации не является истинным, поскольку оно было определено графическим методом и не учитывает значение теплоты адсорбции веществ 𝑄𝐴.
Истинное значение энергии активации: 𝐸𝑎,кин+𝑄𝐴
6) Температура перехода из кинетической области в диффузионную – температура пересечения отрезков 2 и 3
Отрезки 2 и 3 пересекаются при 1Т=0,000932 1К →Т=1073 К или 800°С
Ответ: 𝐸𝑎,кин=105198,6 Джмоль – наблюдаемая энергия активации, Тперехода= 800°С
38. Пластину цинка (S= 10 cм2), подвешенную на весах, окисляют кислородом и регистрируют прирост массы (∆m/S).
t, ч 1 2 3 4
∆m/S, г/cм2 1,11 1,33 1,57 1,79
Проверить, описывается ли кинетика окисления параболическим законом и оценить начальную толщину сплошного слоя ZnO (плотность 5,61 г/см³).
Решение
В координатах «(∆m/S)2 – t» точки укладыв. на прямую, откуда находим
(∆m0/S)2 = 0,5 или ∆m0/S = 0,707 г/cм2. Поделив эту величину на плотность оксида цинка
0,707 г/cм2 / 5,61 г/см³ = 0,126 см найдем начальную толщину сплошного слоя ZnO.
39. Синтез дифениламина (ДФА) из фенола и анилина (1/3) на NiSnMg катализаторе описывается уравнением: a – ln(1-Y)= kн/F, где Y – выход ДФА и F – скорость подачи реакционной смеси в моль/(л(катализатора).ч). При 300оС a= 0,46 и kн = 114 моль/(л.ч). Найти выход ДФА для F= 50 моль/(л.ч) и производительность по ДФА (в расчете на фенол) для загрузки катализатора 1 м3.
Решение
Подставляем заданные величины в кинетическое уравнение: – ln(1-Y) + 0,46 = 114/50, из которого находим Y= 0,84.
При расчете производительности учтем, что количество фенола составляет ¼ от подачи, которую выражаем в (кг/ м3.ч) поэтому: П= 0,25*169 кг/ч* 50* 0,84 = 1774 кг/ч
40. Дегидратация этанола на оксиде алюминия описывается уравнением: Y – ln(1-Y)= kн/F, где Y – выход этилена и F – скорость подачи спирта в моль/[л(катализатора).мин]. При 380оС kн= 0,244 моль/(л.мин). Найти скорость подачи спирта, при которой достигается выход этилена 80%.
Решение
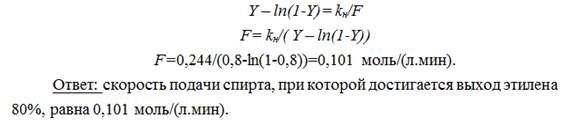
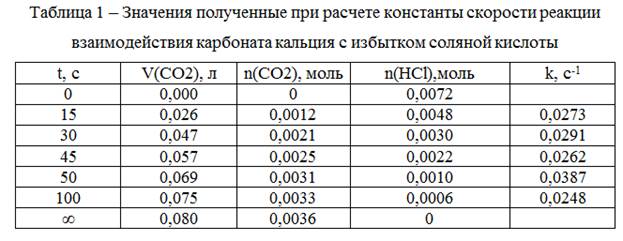
41. Кинетику взаимодействия CaCO3 (тв.) с избытком HCl
CaCO3 + 2 HCl(aq) → CaCl2 + CO2 + вода
исследуют по изменению объема выделенного газа:
t, с 0 15 30 45 50 100 ∞
V(CO2) , мл 0 26 47 57 69 75 80
Найти константу скорости реакции первого порядка по HCl.
Решение
1) Для каждого объёма выделившегося диоксида углерода определим количество вещества диоксида углерода по формуле:
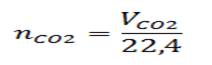
При конечном объёме:

Все рассчитанные значения занесем в таблицу 1.
2) С учетом конечного количества вещества диоксида углерода и стехиометрии реакции определим начальное количество вещества соляной кислоты:
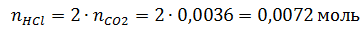
3) Определим для каждого момента времени реакции оставшееся количество вещества соляной кислоты:
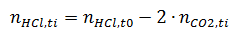
Для t=15 c:
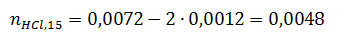

Задачи и вопросы по курсу «Кинетика и катализ»
42. Определить конверсию сырья (х) и селективность по олефинам при пиролизе парафинов С2-С4, если реакционная смесь на выходе из реактора имеет состав, об.%: 12% СН4; 19% парафины С2-С4, 52% олефины С2-С4; 16% углеводороды С5+; 5% смолы.
ОТВЕТ :а) х = 100% - 19% = 81%; б) sолф= 0,52/0,81 = 0,64
43. При гидролизе мыла в избытке воды постоянное значение рН (равновесие) достигается при конверсии мыла 75%. Время полупревращения мыла равно 30 мин. Найти константы скорости гидролиза k1 и омыления k2.
Вода (изб.) + RCOONa ↔ RCOOH + NaOH
.1 Эту бимол. реакцию можно описать уравнением 1-го порядка (почему?) yt / y ∞ = 1- exp (- k 1+2 t )
или 0,5/0,75= 1 - exp(-30k1+2); откуда найдем k1 + k2= 4.10-2 мин-1
.2 В состоянии равновесия;
K = y ∞ / (1- y ∞ ), откуда найдем К = 0,75/0,25 = 3, т.е. k1 / k2= 3.
Таким образом, k1 = 3.10-2 мин-1. k2=1.10-2 мин-1
44. Дана константа пиролиза этана k=2.108.exp(-200000/RT), c-1. Найти температуру, обеспечивающую конверсию х=80% (a = 0,2) в реакторе V= 6 куб.м при подаче сырья Q = 240 куб.м/ч.
1 Найдем время контакта t = V / Q = 0,025 ч или 90 с
2 Найдем необходимое значение k скорости
k Т = - ln (1-х) / t = 1,609/90 c= 1,8.10-2 c-1
3 Найдем значение температуры, при которой kТ = 1,8.10-2 c-1
1,8.10-2 = 2.108exp(-200000/RT)
exp(200000/RT) = 1,111.1010; взяв десятичный логарифм получим:
0,4343.200000/(8,314.Т)= 10,0458 откуда найдем:
T= 0,4343.200000/(8,314.10,0458) = 1039,8K или 766,5оС.
45.Дана константа скорости (0,6 с-1 ) дегидрования пропана С3Н8 = С3Н6 + Н2. Найти время контакта и количество катализатора для обеспечения производительности по С3Н6 Q=300 м3/мин при степени превращения х= 45%.
1 t к = -ln(1-x)/k = -ln0,55/0,6 c= 0,996 c.
С другой стороны, tк = VКт /Q, откуда найдем:
VКт= tк Q = 0,996 c . 300 м3/мин =4,98 м3
46. Даны константы скорости крекинга углеводорода при температурах Т1 и Т2. Найти энергию активации реакции и константу скорости при Т3: k1 = 0,25 и
k2 = 0,8 (1/ч). Т1 = 723К; Т2 = 753К; Т3 = 800К
РЕШЕНИЕ
k1 /k2 = exp[-E(T2-T1)/RT1T2]; откуда E = RT 1 T 2 * Δlnk / ΔT
ln0,8-ln0,25= 1,163 и E=8,314.723.753.1,163/30 = 175492 Дж/моль
k3= k2*exp[-E(T2-T3)/RT3T2]; или k3= 0,8*exp[175492*47/(8,314.800.753)]
k3= 0,8*exp(1,6469)= 4,153 ч-1.
47. Энергия активации гидрирования ацетилена равна 40 кДж/моль. Кинетическое уравнение имеет вид: r= k (PС2Н2)0,5 (PН2 )1,5; скорость реакции при 300 К и
Рв= Рац = 0,5 атм равна 1 моль/(л.с). Найти r при: Т = 350К Рац = 1и РН2= 2 атм
r2 /r1 = F(T) * f(Pi); r2= 1 моль/(л.с)*9,885*11,314= 111,8 моль/(л.с)
F(T) = exp[E(T2-T1)/RT1T2]= exp[40000.50/(8,314.300.350)]= exp(2,291)=9,885
f(Pi)= (P2ац/Р1ац)0,5 (Pв2/Рв1)1,5= 20,5*41,5= 1,414.8= 11,314
48. Константа скорости реакции Н2 + Cl2 = 2НСl: k= 0,2 л/(моль.мин). Найти время, обеспечивающее степень превращения хлора (х= 80%), и количество катализатора, дающего производительность по НСl (Q= 1,1 куб. м/мин); молярное соотношение реагентов μ =Н2 /Cl2 = 3. Для хлора C(0)= 0,12 М
Для р-ции 2го порядка: 1-х = (1+ μkC (0) t )-1 или:
0,2(1+ 3.0,2М-1мин-1*0,12 М*t)=1, откуда t=1/0,2144 = 4,66 мин
VКт= tк Q = 4,66 мин*1,1 куб. м/мин = 5,13 куб. м
49. При исследовании реакции гидрирования карбида железа в автоклаве
Fe2C + 2H2 à CH4
получены следующие данные:
| Время, мин | CН2, ус.ед. | ln(С/Сo) | 100/С | 10/С0,5 |
| 0 | 25 | 0 | 4 | 2 |
| 5 | 16 | 0,446 | 6,25 | 2,5 |
| 10 | 11 | 0,821 | 9,09 | 3 |
| 15 | 8 | 1,139 | 12,5 | 3,5 |
| 20 | 6,2 | 1,394 | 16 | 4 |
| 30 | 4 | 1,83 | 25 | 5 |
В координатах уравнения 1го и 2го порядка (колонки 3 и 4) экспериментальные данные не линеаризуются. Предположим, что порядок реакции по водороду = 1,5. Тогда в уравнении
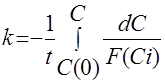
подставим F(Ci) = C1,5. После интегрирования получим:
kt = 1/  - 1/
- 1/ 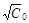 или 1/
или 1/  = 1/
= 1/ 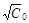 + kt,
+ kt,
то есть, в случае порядка реакции по водороду 1,5, экспериментальные данные будут линеаризоваться в координатах “1/  ~ t”, что и наблюдается.
~ t”, что и наблюдается.
Следовательно, в этой реакции порядок по Н2 действительно равен 1,5.
50. Для реакцииN2O + Н2 à N2+ Н2Oпри 673К получены результаты:
Начальная Начальная скорость 103·k, (л0,5. моль-0,5. с-1) концентрация, ммоль/л мкмоль/(л∙с)
№оп. N2O Н2
1 5 12 2,40 2,829
2 5 6 1,23 2,899
3 20 12 4,77 2,811
Найти порядок по каждому реагенту и константу скорости реакции.
1 Из оп. 1-2: при пост. С N2O с увеличением СН в 2 раза скорость реакции возрастает почти в 2 раза. Из отношения скоростей r1/r2 = (СН,1/ СН,2)n следует, что порядок реакции по водороду nH=1
2. Из оп. 1-3: при пост. СН с увеличением С N2O в 4 раза скорость реакции возрастает почти в 2 раза. Из отношения скоростей r3/r1 = (С N2O,1/ С N2O, 2)m
2 = 4m следует, что порядок реакции по N2O равен 0,5. Следовательно,
mN2O=0,5; nH= 1.
3 Константу скорости выразим из кинетического уравнения:
k, (л0,5. моль-0,5. с-1) = r0/(CH*[N2O]0,5). Из расчетавидно,что константа скорости во всех трех опытах практически постоянна
ср. k673 = 2,846·10-3 л0,5. моль-0,5. с-1.
Следовательно, кинетическое уравнение:
r0= 2,846·10-3 (л0,5.моль-0,5.с-1)*[H2]*[N2O]0,5 описывает эксперимент при 673К.
51. Энергия активации распада оксида этилена равна 120 кДж/моль; время полураспада оксида: t ½ = 150 мин при 650К. Найти константу скорости реакции (1й порядок) при температуре 750К
t ½ = ln 2/ k ; откуда k= 0,693/150 мин= 0,0046 мин-1
52. При дегидрировании бутен (Со=3,0 ммоль/л) последовательно превращается в бутадиен (Д) и в кокс. Для схемы Бà Дà К константы скорости Бà Д (0,6 с-1) и Дà К (0,3 с-1). Найти максимальную концентрацию Д (ммоль/л ) и время максимума.
Y Дм = z 1/(1- z ) ; k 1 / k 2 = z ; t м = lnz •( k 1 - k 2 )-1
z= 2; Y Дм= 0,5; [Д]м= 1,5 ммоль/л
tм = ln2(0,3)-1= 0,693/0,3= 2,31 c
53. Найти граничную температуру для двух реакций первого порядка с константами скорости: вар. 1) k1= 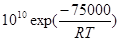 ; k2 =
; k2 = 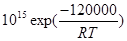 .
.
На рис. 1 показана температурная зависимость скорости двух реакций с существенно различной энергией активации, причем E2 > E1 .
 (ln r0) (ln r0)
 
 r 1
r 1
 r 2
Тгр 1/ T r 2
Тгр 1/ T
| Рисунок 1 - Температурная зависимость скорости реакций 1 и 2, где E2 > E1 |
Как видно из рисунка, при низких температурах (правее Тгр) r1 >r2, а при высоких температурах, наоборот r1< r2, причем граничное значение температуры зависит от разности значений энергии активации и предэкспоненциального множителя:
Тгр = ΔЕ /[Rln(k01/k02)]
Например, для скоростей двух реакций первого порядка 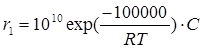 и
и 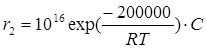 значение Тгр~871K.
значение Тгр~871K.
54. Найти концентрацию, ограничивающую области протекания двух параллельных реакций: k1= 1,25 (М.с)-1 2й порядок и k2 = 0,5 с-1(1й порядок).
При низких концентрациях преимущественно реализуются процессы с малым значением порядка реакции, а при больших концентрациях преобладают процессы с высоким порядком реакции. Например, отношение скоростей реакций второго и первого порядка r 1 = k 1 . C 2 А и r 2 = k 2 . C А , будет увеличиваться пропорционально концентрации C А .

Рисунок 2 - Зависимость скорости реакций 1 и 2 от концентрации, n2 > n1
Граничное значение концентрации зависит от разности значений порядка реакции (Δn) и констант скорости:
Сгр= ( k 1 / k 2 )-Δ n
Дата добавления: 2022-12-03; просмотров: 377; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
