Физический смысл процесса кипения, зависимости температуры кипения от внешнего давления.
Конспект занятия .
План.
1. Парообразование: испарение, сублимация и кипение. Конденсация.
2. Насыщенный и ненасыщенный пар.
3. Физический смысл процесса кипения, зависимости температуры кипения от внешнего давления.
4. Влажность воздуха и зависимостью ее от температуры и парциального давления. 5. Физический смысл точки росы.
Парообразование: испарение, сублимация и кипение. Конденсация
В природе, технике и в быту можно часто наблюдать превращение жидких и твердых тел в газообразное состояние. В ясный летний день очень быстро высыхают лужи, образовавшиеся после дождя и мокрое белье. Со временем исчезают кусочки сухого льда, уменьшаются кусочки нафталина. У всех этих случаях наблюдается процесс превращения вещества в газообразное состояние - в пар.
Парообразование осуществляется тремя способами - испарение, сублимация и кипение. Испарение – это парообразование, происходящее при любой температуре со свободной поверхности жидкости.
Этот процесс происходит при любой температуре, что легко подтверждается молекулярно - кинетической теорией. Молекулы жидкости и газа имеют разные скорости. Молекулы с большими скоростями имеют достаточный запас кинетической энергии, чтобы оторваться от поверхности и выйти за поле действия молекулярных сил. Поэтому над жидкостями всегда есть свободные молекулы, которые образуют пар.
При испарении вылетают молекулы с наибольшей кинетической энергией, поэтому внутренняя энергия жидкости уменьшается и жидкость охлаждается.
|
|
|
Скорость испарения зависит от: 1) рода вещества; 2) площади свободной поверхности; 3) температуры жидкости; 4) давления на жидкость; 5) плотности пара над жидкостью.
Так как, вылетают молекулы с наибольшей кинетической энергией, то средняя кинетическая энергия молекул, остающихся в жидкости, уменьшается. При этом хаотически двигающиеся над поверхности жидкости молекулы пара могут вернутся назад в жидкость. Этот процесс называют конденсациею пара. При сближении с поверхностью жидкости силы притяжения ускоряют движение молекул, сообщая ей дополнительную кинетическую энергию, равную энергии, затраченной на преодоление этих сил, а при возвращении назад молекулы будут иметь такую же энергию, что и до испарения.
При конденсации пара выделяется столько же энергии, сколько было затрачено при испарении.
Конденсация – переход вещества вследствие его охлаждения или сжатия из газообразного состояния в конденсированное(жидкое или твердое).
Переход вещества из твердого состояния в газообразное, минуя жидкое, называется сублимацией .
Насыщенный и ненасыщенный пар.
|
|
|
Эти противоположные процессы - испарение и конденсация – происходят непрерывно. Если жидкость находится в открытом сосуде, то испарение будет идти до тех. пор, пока вся жидкость не превратится в газ. Иначе происходит, когда жидкость находится в закрытом сосуде и занимает только часть ее объема. В начале количество молекул, вылетающий из жидкости, значительно больше количества молекул, возвращающихся назад в жидкость, и концентрация молекул газа возрастает. Но чем больше молекул вылетает с жидкости, тем больше их возвращается назад в жидкость. Наступает такой момент, когда количество молекул, вылетающих, равно количеству молекул, возвращающихся назад за тоже время. Начиная с этого момента, концентрация молекул газа остается постоянной. Такое состояние называютдинамическим равновесием газа и жидкости.Газ, находящийся в динамическом равновесии со своей жидкостью, называетсянасыщенным.
Плотность газа над жидкостью и давление, на стенки сосуда, при динамическом равновесии не изменяются и имеют для данной жидкости при данной температуре максимальное значение. Газ, давление и плотность которого имеет наибольшее значение при данной температуре, называется насыщенным.
|
|
|
В разных жидкостях динамическое равновесие с газом наступает при разной плотности газа. Причиною этого неодинаковые силы молекулярного взаимодействия.
Газ, не находящийся в состоянии динамического равновесия со своей жидкостью, называется ненасыщенным.
Физический смысл процесса кипения, зависимости температуры кипения от внешнего давления.
Кипение – процесс внутреннего парообразования, происходящего во всем объеме жидкости при температуре кипения, корда давление насыщенного пара в пузырьках равно давлению в жидкости.
Условия кипения: жидкость кипит, когда давление насыщенного пара равно внешнему давлению на жидкость. Температура кипения воды равна 100 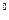 С при нормальном атмосферном давлении.
С при нормальном атмосферном давлении.
Пузырьки, образующиеся при кипении жидкости, всегда есть в жидкости. Это— центры кипения. Они часто прилипают к стенкам сосуда, поэтому кипение раньше починается возле стенок. Если в жидкости нет газов, то образование в ней пузырьков газа затруднено. Такую жидкость можно перегреть, то есть нагреть выше за температуру кипения, чтобы она закипела. Если в такую перегретую жидкость ввести малое количество твердых частиц к поверхности, которых прилип воздух, то она мгновенно и очень бурно закипает. Температура жидкости при этом падает до температуры кипения. Подобные явления могут служить причиной взрывов паровых котлов.
|
|
|
Температура кипенияжидкости зависит от вида жидкости, наличие примеси, внешнего давления. При уменьшении внешнего давления, температура кипения снижается, и наоборот. Если с жидкости удалить растворенные газы (многократным кипячением) и возможные центры парообразования (пылинки, ионы), то можно поднять температуру жидкости выше от температуры кипения. Такое состояние называют перегретой жидкостью. Ее можно получить, если внешнее давление станет меньше чем давление насыщенного пара при данной температуре.
Дата добавления: 2022-11-11; просмотров: 73; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
