Оценка выполненной работы: 3 балла
Практическая работа № 3
Тема: Решение задач по уравнению Ван –дер- Ваальса.
Цель: Систематизировать знания по данной теме.
Теоретические основы
Газовые законы, рассмотренные в предыдущих разделах, точно выполняются только для идеальных газов, которые не конденсируются при охлаждении их вплоть до абсолютного нуля температуры.
Свойства большинства газов близки к свойствам идеального газа, когда они находятся при температурах, достаточно далеких от точки конденсации, т. е. когда между молекулами отсутствует взаимодействие и когда собственный объем молекул газа мал по сравнению с объемом газа.
Вблизи точки конденсации (при высоком давлении и низкой температуре) свойство газов значительно отличается от свойств идеального газа. В этих случаях говорят о реальных газах.
Уравнение состояния для 1-го моля идеального газа 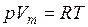
(Vm– молярный объем) видоизменяется в случае реальных газов.
Для реальных газов необходим учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, аVm – b, b – объем, занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул.
Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
|
|
|
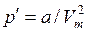 ,
,
где a – постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения.
Вводя поправки в уравнение 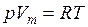 для идеального газа, получим уравнение Ван-дер-Ваальса для 1-го моля газа
для идеального газа, получим уравнение Ван-дер-Ваальса для 1-го моля газа
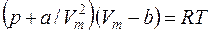 . (9.45)
. (9.45)
Учитывая, что 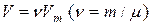 , получим уравнение для произвольного количества вещества:
, получим уравнение для произвольного количества вещества:
 (9.46)
(9.46)
Поправки Ван-дер-Ваальса (a и b) являются постоянными для каждого газа величинами. Для их определения записывают уравнения для двух известных из опыта состояний газа и решаются относительно a и b.
Уравнение (9.45) можно записать в виде
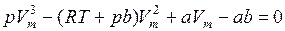 .
.
При заданных p и T – это уравнение третьей степени относительно Vm, следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни.
Изотермами Ван-дер-Ваальса называются кривые зависимости p от Vm при заданных T, определяемые уравнением Ван-дер-Ваальса для моля газа.
При некоторой температуре Tk – критической температуре – на изотерме (рис. 9.11) только одна точка перегиба (в этой точке касательная к ней параллельна оси абсцисс). Точка K – критическая точка, соответствующие этой точке объем Vk и давление pk называются также критическими. Изотерма при Tk называется критической изотермой.
|
|
|
Пример.
В сосуде вместимостью  V = 0,3 л находится углекислый газ, содержащий количества вещества ν = 1 моль при температуре Т = 300 К. Определить давление газа если: 1) газ реальный; 2) газ идеальный.
V = 0,3 л находится углекислый газ, содержащий количества вещества ν = 1 моль при температуре Т = 300 К. Определить давление газа если: 1) газ реальный; 2) газ идеальный.
Дано: Т = 300 К.,
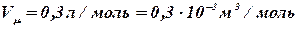
Определить:  .
.
Решение
1) Газ реальный. Уравнение состояния реального газа уравнение Ван-дер-Ваальса для одного моля газа уравнение имеет вид:
 . (1)
. (1)
Здесь R = 8,31Дж/моль К ; а и b – поправки Ван-дер-Ваальса. Их значение определяется из справочных таблиц: а = 0,361 Н·м4 / моль2; b = 4,28·10-5 м3 / моль.
Из формулы (1) получим:
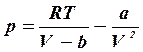
Выполним расчет:
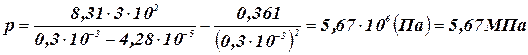 ;
;
2). Газ идеальный. Применим уравнение Клаперона-Менделеева для одного моля газа: 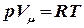 , откуда
, откуда 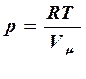 .
.
Выполним расчеты:
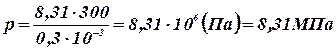
Выполнение работы
Решите следующие задачи
1. Рассчитайте молярную массу газа, если 3,5 г его при 00С и давлении 25310 па занимает объем 11,2 л.
2. В сосуде вместимостью V = 0,4 л находится углекислый газ, содержащий количества вещества ν = 2 моль при температуре Т = 200 К. Определить давление газа если: 1) газ реальный; 2) газ идеальный.
|
|
|
Контрольные вопросы:
1. Сформулируйте уравнение Ван-дер-Ваальса
2. Дайте определение изотермы Ван-дер-Ваальса
Сформулируйте вывод по работе
Оценка выполненной работы: 3 балла
| Критерий оценки | Балл |
| Работа не выполнена или не правильно выполнены задания | 0 |
| Работа выполнена не в полном объеме или допущены существенные ошибки в заданиях | 1 |
| Работа выполнена в полном объеме. Материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя. | 2 |
| Работа выполнена в полном объеме, без ошибок Ответ полный и правильный на основании изученных теорий | 3 |
Дата добавления: 2022-11-11; просмотров: 11; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
