Фотоколориметрический и спектрофотометрический метод анализа
Фотометрический анализ (молекулярная абсорционная спектроскопия) основан на способности вещества поглощать электромагнитные излучения оптического диапазона. В основе фотометрического анализа лежит избирательное поглощение света частицами (молекулами и ионами) вещества в растворе. При некоторых длинах волн свет поглощается интенсивно, а при некоторых – не поглощается совсем.
Методы фотометрического анализа
 |  |
| Фотоколориметрия | Спектрофотометрия |
| анализ на основе измерения | анализ на основе измерения |
| поглощения излучения | поглощения излучения |
| видимой области спектра | видимой области спектра, УФ, ИК |
| Прибор: | областей спектра |
| Фотоэлектроколориметр (ФЭК) | Прибор: Спектрофотометр |
Фотоколориметрические методы широко распространены в работе клинических лабораторий для количественного определения йода, азота, мочевой кислоты в моче, билирубина и холестерина в крови и желчи, гемоглобина в крови и т.д. В санитарно-гигиеническом анализе колориметрия применяется для определения аммиака, фтора, нитратов и нитритов, солей железа, витаминов и других веществ.
Фотоколориметрический метод анализа основан на сравнении интенсивности окраски исследуемого раствора с окраской раствора, концентрация которого неизвестна. Раствор с известной концентрацией называется стандартным или образцовым раствором.
|
|
|
Этим методом можно анализировать лишь окрашенные растворы. Если раствор бесцветный, то в него добавляют реагент, образующий окрашенное соединение с исследуемым веществом (фотометрическая реакция).
исслед. в-во + реагент ↔ окраш. соед.
Cu2+ + 4NH3 ↔ [Cu(NH3)4]2+
Fe3+ +6CN- ↔ [ Fe(CN)6]3-
В основе фотоколориметрического анализа лежит закон светопоглощения Бугера-Ламберта-Бера: при прохождении светового потока через поглощающий раствор интенсивность прошедшего светового потока (I) отличается от интенсивности падающего светового потока (Io) на поглощение света раствором.
  
 I I
| ||||||||||||||||||||||||||||||||
I 0 I
 |
b (толщина кюветы)
Рис. 2. Прохождение светового потока через поглощающую среду
Отношение I/Io называется пропусканием раствора и обозначается Т.
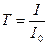 (5)
(5)
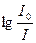 – важная характеристика раствора, называется оптической плотностью D:
– важная характеристика раствора, называется оптической плотностью D:
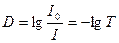 (6)
(6)
Обычно Т выражают в %:
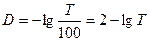 (7)
(7)
|
|
|
Уменьшение интенсивности света при прохождении через поглощающий раствор подчиняется закону Бугера-Ламберта-Бера:
I = I0 · 10‾cb или D = ε bc, (8)
где ε – молярный коэффициент поглощения, являющийся основной характеристикой поглощения света системой при данной длине волны.
Причины отклонения от закона:
1) изменение степени диссоциации при разбавлении;
2) изменение степени гидратации ионов;
3) присутствие посторонних электролитов
Важным дополнением к закону Б-Л-Б является закон аддитивности светопоглощения. Если в растворе присутствует несколько поглощающих веществ, то оптическая плотность раствора равна сумме вкладов каждого из компонентов:
Д=Д1+Д2+Д3
Важным этапом фотометрического анализа раствора является выявление длины волны светового потока, соответствующей максимальному светопоглощению. Для этого измеряют Д раствора при разных λ и строят график Д=Д(λ). Работа в области максимума поглощения обеспечит наибольшую чувствительность и точность определения.
Чтобы обеспечить максимальное поглощение в ФЭКе есть набор светофильтров. Светофильтры – это специальные стёкла, поглощающие излучение определённых длин волн.
|
|
|
Задача 1
Навеску массой 0,0162 г n-нитроанилина NH2C6H4NO2 растворили в мерной колбе вместимостью 50,00 см3. Полученный раствор разбавили в 100 раз. Оптическая плотность разбавленного раствора D = 0,40 (λ =368 нм, b = 10 мм). Вычислите молярный коэффициент светопоглощения n-нитроанилина.
Решение:
Молярный коэффициент светопоглощения (ε) вычисляют по основному закону светопоглощения:
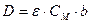
где СМ – молярная концентрация поглощающего вещества, моль/дм3
b – толщина светопоглощающего слоя, см
Откуда 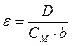
Находят молярную концентрацию n-нитроанилина в исходном растворе:
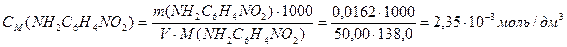
После разбавления раствора концентрация n-нитроанилина уменьшится в 100 раз (2,35∙10‾5 моль/дм3):
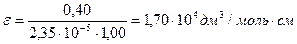
Ответ: ε = 1,70∙104 дм3/моль∙см
Задача 2
В 6 мерных колб вместимостью 100,0 см3 поместили 1,00; 2,00; 3,00; 4,00; 5,00 и 6,00 см3 стандартного раствора Fe3+ с концентрацией 10,0 мг/см3. После проведения реакции с сульфосалициловой кислотой оптические плотности растворов соответственно равны: 0,12; 0,25; 0,37; 0,50; 0,62 и 0,75. Оптические плотности анализируемых растворов 0,30 и 0,50. Вычислить концентрацию Fe3+ в этих растворах.
Решение:
Рассчитывают концентрации (мг/см3) Fe3+ в стандартных растворах:
|
|
|
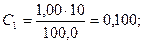
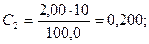
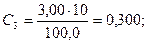
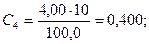
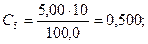
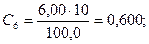
Градуировочный график линеен, выходит из начала координат:
D
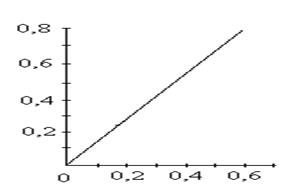 См(Fe3+), мг/см3
См(Fe3+), мг/см3
Для расчета концентрации Fe3+ в анализируемых растворах применяют соотношение:
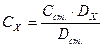
где СХ и Сст. – концентрации определяемого вещества в анализируемом и стандартном растворах;
DХ и Dст. – оптические плотности растворов.
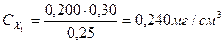
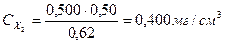
Ответ: 0,240 мг/см3
0,400 мг/см3
Существуют различные методы фотоколориметрического определения вещества в растворе:
 1. Метод калибровочного (градуировочного) графика. Готовят серию из 5-8 стандартных растворов разных концентраций, измеряют их оптическую плотность, строят график в координатах Д–С. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию (см. рис. 4).
1. Метод калибровочного (градуировочного) графика. Готовят серию из 5-8 стандартных растворов разных концентраций, измеряют их оптическую плотность, строят график в координатах Д–С. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию (см. рис. 4).
D
 0,6
0,6
,3
 0,2
0,2
 0,1
0,1

10 20 30 40 50 С (Fe3+), мкг/мл
Рис. 4 График зависимости оптического поглощения от концентрации
2. Метод добавок. К анализируемому раствору добавляют точную навеску вещества. Измерив оптическую плотность раствора с добавкой (D) и без добавки (D0), рассчитывают концентрацию анализируемого раствора (С0):
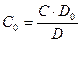 (9)
(9)
3. Метод стандартных растворов. Оптическую плотность исследуемого раствора (DX) сравнивают с оптической плотность стандартного раствора (Dст.) этого же вещества. Неизвестную концентрацию исследуемого раствора (СХ) рассчитывают по формуле:
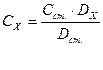 (10)
(10)
где Сст. – концентрация стандартного раствора, моль/л.
АППАРАТУРА ,
ИСПОЛЬЗУЕМАЯ В ФОТОМЕТРИИ
Дата добавления: 2022-11-11; просмотров: 372; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


