Первый закон термодинамики для изопроцессов
Изотермический процесс: Q=A′(T=const,ΔU=0)
Физический смысл: все переданное газу тепло идет на совершение работы.
Изобарный процесс: Q=ΔU+A′
Физический смысл: подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Изохорный процесс: Q=ΔU(V=const,A′=0)
Физический смысл: внутренняя энергия газа увеличивается за счет подводимого тепла.
Адиабатный процесс: ΔU=−A′ или A=ΔU(Q=0)
Физический смысл: внутренняя энергия газа уменьшается за счет совершения газом работы. Температура газа при этом понижается.
Задачи об изменении внутренней энергии тел
Такие задачи можно разделить на группы:
· При взаимодействии тел изменяется их внутренняя энергия без совершения работы над внешней средой.
· Рассматриваются явления, связанные с превращением одного вида энергии в другой при взаимодействии двух тел. В результате происходит изменение внутренней энергии одного тела вследствие совершенной им или над ним работы.
При решении задач первой группы:
· установить, у каких тел внутренняя энергия уменьшается, а у каких – возрастает;
· составить уравнение теплового баланса (ΔU=0), при записи которого в выражении Q=cm(t2–t1) для изменения внутренней энергии нужно вычитать из конечной температуры тела начальную и суммировать члены с учетом получающегося знака;
· решить полученное уравнение относительно искомой величины;
|
|
|
· проверить решение.
При решении задач второй группы:
· убедиться, что в процессе взаимодействия тел теплота извне к ним не подводится, т.е. действительно ли Q=0;
· установить, у какого из двух взаимодействующих тел изменяется внутренняя энергия и что является причиной этого изменения – работа, совершенная самим телом, или работа, совершенная над телом;
· записать уравнение Q=ΔU+A для тела, у которого изменяется внутренняя энергия, учитывая знак перед работой и КПД рассматриваемого процесса;
· если работа совершается за счет уменьшения внутренней энергии одного из тел, то А=−ΔU, а если внутренняя энергия тела увеличивается за счет работы, совершенной над телом, то A=ΔU;
· найти выражения для ΔU и A;
· подставить в исходное уравнение вместо ΔU и A выражения для них, получить окончательное соотношение для определения искомой величины;
· решить полученное уравнение относительно искомой величины;
· проверить решение.
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
|
|
|
Примеры необратимых процессов:
· переход тепла от более нагретого тела к менее нагретому телу;
· переход механической энергии во внутреннюю энергию.
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются. Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
|
|
|
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
КПД тепловой машины
Коэффициентом полезного действия (КПД) тепловой машины (двигателя) называется отношение работы A, совершаемой двигателем за цикл, к количеству теплоты Q1, полученному за цикл от нагревателя:

Тепловая машина с максимальным КПД была создана Карно. В машине осуществляется круговой процесс (цикл Карно), при котором после ряда преобразований система возвращается в начальное состояние.

Цикл Карно состоит из четырех стадий:
1. Изотермическое расширение (на рисунке — процесс 1–2). В начале процесса рабочее тело имеет температуру T1, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передает ему количество теплоты Q1. При этом объем рабочего тела увеличивается.
|
|
|
2. Адиабатное расширение (на рисунке — процесс 2–3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника T2.
3. Изотермическое сжатие (на рисунке — процесс 3–4). Рабочее тело, имеющее к тому времени температуру T2, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q2.
4. Адиабатное сжатие (на рисунке — процесс 4–1). Рабочее тело отсоединяется от холодильника. При этом его температура увеличивается до температуры нагревателя T1.
КПД цикла Карно:
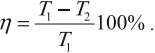
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры нагревателя (T1) и холодильника (T2).
Из уравнения следуют выводы:
· для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника;
· КПД тепловой машины всегда меньше 1.
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
КПД тепловых двигателей: двигатель внутреннего сгорания — 30%, дизельный двигатель — 40%, паровая турбина — 40%, газовая турбина — 25–30%.
Дата добавления: 2022-07-02; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
