Азотсодержащие органические соединения.
Раздел 3. Химия.
Тема 3.3. Органическая химия.
Введение.
Углеводороды.
Кислородосодержащие органические вещества.
Азотосодержащие органические вещества.
Биологические полимеры.
Синтетические и искусственные полимеры.
Введение.
Органическая химия изучает свойства и реакции органических соединений - веществ, построенных на основе "углеродного скелета". Наибольшее количество соединений углерод образует с так элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений.
Название «органические соединения» связано со словом «организм»: из этих соединений в основном состоят все живые организмы. Бурное развитие органической химии началось после создания выдающимся русским химиком А.М. Бутлеровым ее теоретической основы – структурной теории, основная идея которой в том, что свойства органических соединений зависят не только от их состава, но и от структуры, т.е. последовательности связи атомов в молекуле. А.М. Бутлеров ввел понятие изомеров. Изомеры - это варианты веществ с одинаковым молекулярным составом и массой, но с разной структурой и потому с разными свойствами.
Именно возможность построения из одних и тех же немногих элементов большого числа изомерных структур объясняет существование огромного количества органических соединений (их более пяти миллионов, тогда как неорганических – около пятисот тысяч). Конец ХIХ века был периодом триумфального шествия органического синтеза; в эти годы были впервые получены анилиновые красители, взрывчатые органические вещества, многие лекарства.
|
|
|
Углеводороды.
Углеводороды – это соединения углерода с водородом. Составляют основу органических соединений. По количеству и характеру химических связей между атомами углерода они делятся на предельные и непредельные, алициклические и ароматические.
Углеводороды
| Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены | |
| Общая формула | CnH2n+2 (n≥1) | CnH2n (n≥2) | CnH2n-2 (n≥2) | CnH2n-2 (n≥3) | CnH2n (n≥3) | CnH2n-6 (n≥6) |
| Особен-ности строения | Все связи одинарные С-С | Есть двойная связь С=С | Есть тройная связь С≡С | Есть две двойных связи между атомами углерода | Есть цикл | /бензольное кольцо/ |
| Суффикс в названии | -ан | -ен (-илен) | -ин | -диен | Цикло-…..ан | Тривиальные названия ……бензол или фенил- |
| Пример | C3H8 CH3-CH2-CH3 пропан | C3H6 CH2=CH-CH3 пропен (пропилен) | C3H4 CH≡C-CH3 пропин | C3H4 CH2=C=CH2 пропадиен | С6Н12 - циклогексан | С6Н6 - бензол С6Н5 СН3 - толуол /метилбензол/ |
| Физичес-кие свойства | С1-С4-газы, С5-С15 –жидкости с запахом, с С16 –твёрдые вещества. | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | Бутадиен -1,3 – газ Изопрен – легкокипящая жидкость | С3-С4-газы, С5-С13 –жидкости, с С14 –твёрдые вещества. | Первые члены ряда - бесцветные легкокипящие жидкости |
| Отноше-ние к раствору KMnO4 | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Не реагируют | Окисление заместителей в цикле (бензол не реагирует) |
| Отноше-ние к бромной воде | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Не реагируют | Не реагируют |
| Взаимодействие с галогенами | Радикальное замещение | Присоединение | Присоединение | Присоединение | У малых – присоединение, у больших – замещение. | Электрофильное (по кольцу) или радикальное (по боковой цепи) замещение |
| Каталити-ческое присоеди-нение водорода | Нет | Да | Да | Да | Да, для малых циклов | Да |
| Возможность получения полимеров | Нет | Да | Да | Да | Нет | Нет |
|
|
|
Кислородосодержащие органические вещества.
|
|
|
Кислородсодержащие органические соединения – соединения, содержащие помимо углерода и водорода, еще один элемент – кислород.
К кислородосодержащим органических соединениям относится большой класс органических соединений: спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, и т.д.
Свойства кислородсодержащих органических веществ очень разнообразны, и они определяются тем, в состав какой группы атомов входит атом кислорода. Эта группа называется функциональной.
Группу атомов, которая существенным образом определяет свойства органического вещества, называют функциональной группой.
Существует несколько различных кислородсодержащих групп.
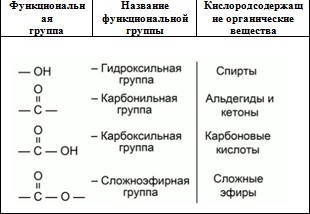
Спирты.
Одноатомные предельные спирты.
Рассмотрим отдельных представителей и общие свойства спиртов.
Простейший представитель этого класса органических веществ – метанол, или метиловый спирт. Его формула – СН3ОН. Это бесцветная жидкость с характерным спиртовым запахом, хорошо растворимая в воде. Метанол – это очень ядовитое вещество. Несколько капель, принятых внутрь, приводят к слепоте человека, а немного большее его количество – к смерти! Раньше метанол выделяли из продуктов пиролиза древесины, поэтому сохранилось его старое название – древесный спирт. Метиловый спирт широко применяется в промышленности. Из него изготавливают лекарственные препараты, уксусную кислоту, формальдегид. Его применяют также в качестве растворителя лаков и красок.
|
|
|
Не менее распространенным является и второй представитель класса спиртов – этиловый спирт, или этанол. Его формула – С2Н5ОН. По своим физическим свойствам этанол практически ничем не отличается от метанола. Этиловый спирт широко применяют в медицине, также он входит в состав спиртных напитков. Из этанола получают в органическом синтезе достаточное большое количество органических соединений.
Получение этанола. Основным способом получения этанола является гидратация этилена. Реакция происходит при высокой температуре и давлении, в присутствии катализатора.
СН2=СН2 + Н2О → С2Н5ОН
Реакция взаимодействия веществ с водой называется гидратацией.
Многоатомные спирты
К многоатомным спиртам относятся органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
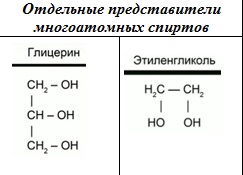
Одним из представителей многоатомных спиртов является глицерин (1,2,3-пропантриол). В состав молекулы глицерина входят три гидроксильных группы, каждая из которых находится у своего атома углерода. Глицерин – это очень гигроскопичное вещество. Он способен поглощать влагу из воздуха. Благодаря такому свойству, глицерин широко используется в косметологии и медицине. Глицерин обладает всеми свойствами спиртов.
Представителем двух атомных спиртов является этиленгликоль. Его формулу можно рассматривать, как формулу этана, в которой атомы водорода у каждого атома замещены на гидроксильные группы. Этиленгликоль – это сиропообразная жидкость, сладковатая на вкус. Но она очень ядовита, и ни в коем случае ее нельзя пробовать на вкус! Этиленгликоль используется в качестве антифриза. Одним из общих свойств спиртов является их взаимодействие с активными металлами. В составе гидроксильной группы атом водорода способен замещаться на атом активного металла.
2С2Н5ОН + 2Na→ 2С2Н5ОNa+ H2↑
Получается этилат натрия, и выделяется водород. Этилат натрия – солеподобное соединение, которое относится к классу алкоголятов. В силу своих слабых кислотных свойств спирты не взаимодействуют с растворами щелочей.
Карбонильные соединения
К карбонильным соединениям относятся альдегиды и кетоны. В составе карбонильных соединений находится карбонильная группа. Простейшим альдегидомявляется формальдегид. Формальдегид – это газ с резким запахом, чрезвычайно ядовитое вещество! Раствор формальдегида в воде называется формалином и применяется для сохранения биологических препаратов.
Формальдегид широко используют в промышленности для изготовления пластмасс, которые не размягчаются при нагревании.
Простейшим представителем кетонов является ацетон. Это жидкость, которая хорошо растворяется в воде, и в основном его применяют в качестве растворителя. Ацетон обладает очень резким запахом.
Карбоновые кислоты
В составе карбоновых кислот находится карбоксильная группа Простейшим представителем этого класса является метановая, или муравьиная кислота. Муравьиная кислота содержится в муравьях, в крапиве и хвое ели. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
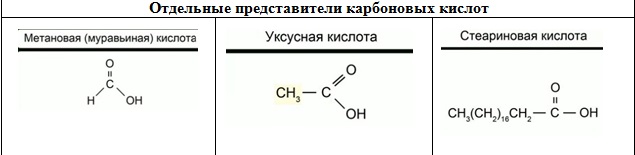
Наибольшее значение имеет уксусная кислота. Она необходима для синтеза красителей, медикаментов (например, аспирина), сложных эфиров, ацетатного волокна. 3-9%-ный водный раствор уксусной кислоты – уксус, вкусовое и консервирующее средство.
Кроме муравьиной и уксусной карбоновых кислот, существует целый ряд природных карбоновых кислот. К ним относятся лимонная и молочная, щавелевая кислоты. Лимонная кислота содержится в соке лимона, малины, крыжовника, в ягодах рябины и т.д. Широко применяется в пищевой промышленности и медицины. Лимонную и молочную кислоты используют в качестве консервантов. Молочную кислоту получают путем брожения глюкозы. Щавелевая кислота используется для удаления ржавчины и в качестве красителя. В высших жирных карбоновых кислотах содержится, как правило, 15 и более атомов углерода. Например, стеариновая кислота содержит 18 атомов углерода. Соли высших карбонов кислот натрия и калия называются мылами. Стеарат натрия С17Н35СООNa входит в состав твердого мыла.
Соединения каждого класса образуют различные производные. Например, к производным спиртов относятся простые эфиры ROR', к производным карбоновых кислот – сложные эфиры RCOOR', амиды RCONH2, ангидриды(RCO)2O, хлорангидриды RCOCl и т.д.
Азотсодержащие органические соединения.
Очень важны в народном хозяйстве азотсодержащие органические вещества. Азот может входить в органические соединения в виде нитрогруппы NO2, аминогруппы NH2 и амидогруппы (пептидной группы) – C(O)NH, причем всегда атом азота будет непосредственно связан с атомом углерода.
Нитросоединения.
Низшие нитроалканы (бесцветные жидкости) используются как растворители пластмасс, целлюлозного волокна, многих лаков, низшие нитроарены (желтые жидкости) – как полупродукты для синтеза аминосоединений.
Амины.
Амины (или аминосоединения) можно рассматривать как органические производные аммиака. Амины могут быть первичными R – NH2, вторичными RR'NH и третичными RR'R" N, в зависимости от числа атомов водорода, которые замещены на радикалы R, R', R". Например, первичный амин — этиламин C2H5NH2, вторичный амин — дижетиламин (CH3)2NH, третичный амин – триэтиламин (C2H5)3N.
Амины используются в производстве растворителей для полимеров, лекарственных препаратов, кормовых добавок, удобрений, красителей. Очень ядовиты, особенно анилин (желто-коричневая жидкость, всасывается в организм даже через кожу).
Аминокислоты. Белки.
Аминокислоты – органические соединения, содержащие в своем составе две функциональные группы – кислотную СООН и аминную NH2; являются основой белковых веществ.
Примеры:

Аминокислоты проявляют свойства и кислот, и аминов. Так, они образуют соли (за счет кислотных свойств карбоксильной группы):
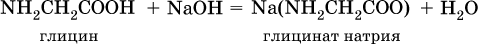
и сложные эфиры (подобно другим органическим кислотам):
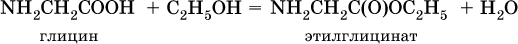
С более сильными (неорганическими) кислотами они проявляют свойства оснований и образуют соли за счет основных свойств аминогруппы:
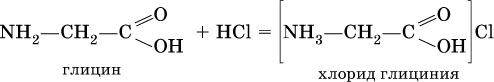
Биологические полимеры.
Все органические вещества могут быть разделены на две группы: низкомолекулярные вещества и полимеры. Размеры низкомолекулярных веществ обычно составляют десятки и сотни атомных единиц массы, а.е.м., тогда как полимеры достигают массы в миллионы и даже миллиарды а.е.м.. Однако такие вещества построены из небольшого количества многократно повторяющихся единиц — мономеров, что значительно упрощает их образование в клетке.
Количество мономеров в молекуле полимера может варьировать от нескольких штук до десятков миллионов. Например, глутатион, пептид, играющий важную роль в окислительно-восстановительных процессах, состоит всего из трех аминокислот, а молекула ДНК, образующая единственную хромосому бактерий, построена более чем из 3 млн. нуклеотидов.
Гомо- и гетерополимеры
Полимер может состоять из одинаковых мономеров. Такие полимеры называют гомополимерами. К ним относятся, например, крахмал и целлюлоза.
Однако большая часть биологических полимеров построена из нескольких типов мономеров. Они носят название гетерополимеров. Мономеры, входящие в состав гетерополимеров, относятся, как правило, к одному классу веществ и соединяются одинаковыми связями. Примером гетерополимеров могут служить гиалуроновая кислота, состоящая их двух мономеров, и белки, построенные более чем из 20 различных мономеров.
Дата добавления: 2022-07-02; просмотров: 61; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
