СОДЕРЖАНИЕ КУРСА КОЛЛОИДНОЙ ХИМИИ
Лекция 1
Предмет коллоидной химии
Уже в начале 19 века ученые обратили внимание на аномальные свойства коллоидных систем и коллоидных растворов в частности. Эти растворы, в отличие от истинных растворов, сильно рассеивают свет, переход вещества в такой раствор и осаждение из него не сопровождается изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ, и др.
Название происходит от греческого «колла», что означает клей.
Особенности коллоидных растворов:
1. Все коллоидные растворы способны рассеивать свет.
2. Коллоидные растворы содержат относительно крупные частицы растворенного вещества.
3. Коллоидные растворы способны к диализу, т. е. с помощью полупроницаемой перегородки (мембраны) могут быть отделены от растворенных в них примесей низкомолекулярных веществ. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а коллоидные частицы, неспособные проникать через полупроницаемую перегородку (диализировать), остаются за ней в виде очищенного коллоидного раствора. Способность к диализу также указывает на то, что размер содержащихся в коллоидных растворах частиц значительно больше размера молекул, до которых раздроблено вещество в истинных растворах.
4. В отличие от истинных растворов, являющихся вполне устойчивыми (стабильными) системами, коллоидные растворы агрегативно неустойчивы (лабильны), т. е. коллоидно растворенное вещество способно сравнительно легко выделяться из раствора (коагулировать) под влиянием незначительных внешних воздействий. В результате в коллоидном растворе образуется осадок (коагулят), представляющий собой агрегаты из слипшихся первичных частиц.
|
|
|
К воздействиям, обусловливающим коагуляцию, относятся нагревание, замораживание, интенсивное перемешивание и прежде всего введение в раствор очень небольших количеств коагуляторов. При этом коагуляция под влиянием коагуляторов происходит и тогда, когда коагуляторы химически не взаимодействуют с коллоидно растворенным веществом. Таким образом, коагуляция является не химическим, а физическим процессом.
5. Коллоидные растворы обычно (но не всегда) обнаруживают явление электрофореза. Это явление заключается в переносе коллоидных частиц в электрическом поле к тому или иному электроду. Следовательно, частицы коллоидно растворенного вещества, как и ионы, могут обладать электрическим зарядом. Явление электрофореза отличается от электролиза тем, что в последнем случае продукты электролиза выделяются на электродах в эквивалентных количествах; при электрофорезе же происходитзаметный перенос вещества только в каком-нибудь одном направлении. Несоблюдение при электрофорезе законов Фарадея, количественно характеризующих электролиз, долгое время заставляло предполагать, что между обоими явлениями нет прямой связи.
|
|
|
Коллоидные системы могут быть жидкими и твердыми.
Коллоидные свойства могут проявлять системы, состоящие не только из неорганических, но и из органических веществ.
Одни и те же системы могут в одних условиях обладать свойствами истинного раствора, а в других условиях давать коллоидные растворы. Так, канифоль при растворении в спирте образует истинный раствор, а в воде - коллоидный раствор. Наоборот, хлорид натрия в воде дает истинный раствор, а в бензоле - коллоидный. Таким образом, правильнее говорить не о коллоидном веществе, а о коллоидном состоянии вещества.
Коллоидное состояние вещества - это высокодисперсное (сильно раздробленное) состояние, в котором отдельные частицы являются не молекулами, а агрегатами, состоящими из множества молекул.
Поскольку коллоидные частицы состоят из множества молекул, то, очевидно, им могут быть приписаны все свойства фазы. Равным образом молекулы среды, в которой диспергированы коллоидные частицы, образуют другую фазу. Т.е., всякий коллоидный раствор является гетерогенной, многофазной (в простейшем случае двухфазной) системой в отличие от истинных растворов, которые являются гомогенными системами. Отсюда же следует вывод, что поскольку всякий коллоидный раствор представляет гетерогенную систему, условием ее образования является нерастворимость (или очень малая растворимость) вещества одной фазы в веществе другой фазы, ибо только между такими веществами могут существовать физические поверхности раздела.
|
|
|
Принятое определение коллоидных систем подтверждается рассмотренными выше характерными свойствами коллоидных растворов. Именно такие гетерогенные системы должны сильно рассеивать свет, обладать малой диффузионной способностью, проявлять способность к диализу и быть агрегативно неустойчивыми.
Следует, однако, отметить, что твердые коллоидные системы не обладают всеми перечисленными выше типичными коллоидными свойствами. Так, все твердые коллоидные системы в обычных условиях агрегативно устойчивы. Это объясняется только огромной вязкостью этих систем, не позволяющей передвигаться частицам растворенного вещества и образовывать более крупные агрегаты в результате слипания. При плавлении же этих систем может проявляться их агрегативная неустойчивость.
|
|
|
Всякая коллоидная система представляет собою дисперсию одного тела (дисперсная фаза) в другом (дисперсионная среда).
Таким образом, после всего изложенного можно дать определение коллоидной химии как науки. Коллоидная химия — это наука о свойствах гетерогенных высокодисперсных систем и о протекающих в них процессах.
КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК
В истории развития коллоидной химии можно выделить три периода.
Первый период. Зарождение коллоидной химии (с древнейших времен до середины XIX в.).
Многие коллоидные системы были известны в глубокой древности — в Египте, Греции и Риме. У Аристотеля имеются указания на явления свертывания молока и крови, дубления кож и крашения тканей. Алхимикам (II-IV вв.) были известны коллоидные растворы золота и серебра. В древнерусской рецептурной литературе встречаются многочисленные указания на применение коллоидов — белков, желчи, различных клеев и красок. Самые первые ремесла имели прямое отношение к объектам коллоидной химии: получение керамики, глазури, выделывание кож.
В XVI-XVII вв. коллоидные растворы применялись как лечебные препараты.
М. В. Ломоносов широко использовал для окрашивания стекол коллоидные пигменты и основал новую отрасль русской промышленности — производство цветных стекол для мозаики.
К середине XIX в. был накоплен экспериментальный материал, послуживший основой для возникновения коллоидной химии как самостоятельной науки.
Второй период. Становление коллоидной химии как самостоятельной науки (1860-е гт. — конец XIX в.).
Основоположником коллоидной химии считают шотландского химика Т. Грэма. Он впервые (1861) ввел термины «коллоид», «золь», «гель», получил коллоидные растворы сульфида мышьяка, кремневой и вольфрамовой кислот, гидроксидов алюминия, железа, хрома. Обнаружив неспособность частиц коллоидных растворов, в отличие от обычных молекулярных растворов, проникать через пористые мембраны, он пришел к выводу о том, что все вещества делятся на коллоиды (не проходят через мембрану) и кристаллоиды.
Современник Грэма профессор Киевского университета И. Г. Борщов (1868), исследуя скорость диффузии в коллоидных растворах, установил ее зависимость от размеров коллоидных частиц и независимость от химической природы растворенного вещества. В отличие от представлений Грэма о коллоидах как об особом классе химических веществ, он пришел к выводу о микрокристаллическом состоянии коллоидных частиц.
Д. И. Менделеев много внимания уделял коллоидным растворам и в «Основах химии» подробно описал свойства некоторых из них. Еще в 90-х г. прошлого столетия он показал, что все тела в природе могут находиться в коллоидном состоянии. Д. И. Менделееву мы обязаны современным представлениям об универсальности коллоидного состояния вещества.
Впоследствии профессор Санкт-Петербургского горного института П. Веймарн (1904) показал, что одно и то же вещество может в одних условиях обладать свойствами кристаллоида, а в других — образовывать коллоидныйраствор. Так, например, водный раствор поваренной соли является истинным раствором (NaCl — кристаллоид), а раствор NaCl в бензоле — коллоидный.
Немецкий ученый Вильгельм Фридрих Освальд высоко оценил труды Петра Петровича Веймарна и использовал его идеи в своих работах.
На основе фундаментальных исследований, выполненных в конце XIX в., было установлено, что в коллоидных растворах частицы находятся в высокой степени раздробления. Появились понятия «дисперсная фаза», «дисперсионная среда», «степень дисперсности». Веймарн, Оствальд и другие ученые высказывали мысль, что свойства дисперсных систем определяются степенью дисперсности частиц.
Третий период. Развитие современной коллоидной химии (XX в.).
Начало XX в. ознаменовалось развитием теоретических исследований объектов коллоидной химии.
М. С. Цвет (1903) в Варшаве и Тарту открыл хроматографический метод анализа, основанный на адсорбционном разделении веществ в пористых адсорбентах. В дальнейшем учение об адсорбции развивалось в работах таких ученых, как Б. А. Шишковский (1903), И. Ленгмюр (1917), Г. Фрейндлих (1926), Н. А. Шилов (1915-1930). Н. Д. Зелинский во время Первой мировой войны создал угольный противогаз.
Работы П. А, Ребиндера (с 1923 г.) были посвящены проблемам влияния адсорбционных слоев на свойства коллоидных и грубодисперсных систем.
Теория двойного электрического слоя возникла благодаря работам Г. Гун, Д. Чепмена, О. Штерна (1910-1924). Н. П. Песков положил начало учению о лиофильности и лиофобности золей и выяснил значение этих свойств в проблеме устойчивости. Н. П. Пескову принадлежит заслуга в формировании представлений о коллоидной химии как науке о поверхностных явлениях и дисперсных системах (1932).
А. Эйнштейн (1908) и М. Смолуховский (1906) разработали теорию броуновского движения и диффузии в коллоидных системах. Ж. Перрен (1909) и Т. Сведберг (1907) экспериментально подтвердили правильность этой теории, которая имела существенное значение для развития молекулярно-кинетических представлений.
Перечисленные теоретические вопросы будут нами рассмотрены при изложении различных разделов курса.
ЗНАЧЕНИЕ КОЛЛОИДНОЙ ХИМИИ
Коллоидная химия является научной основой многочисленных технологических процессов, включающих использование или образование дисперсных систем. Назовем некоторые из них.
• Технологии производства современных композиционных и строительных материалов, силикатов (керамики, стекол и т. д.)
· Получение дисперсных, пористых структур — катализаторов и сорбентов.
· Производство пластмасс, резины, природных и синтетических волокон, клеев, лакокрасочных материалов.
· Технологии производства продуктов питания.
· Извлечение нефти из пласта с последующим деэмульгированием.
· Технологии флотации руд.
· Мембранные процессы разделения и водоподготовки.
· Разработка и применение поверхностно-активных веществ: флотореагентов, смачивателей, стабилизаторов пен и эмульсий, пеногасителей и деэмульгаторов, компонентов смазок и охлаждающих жидкостей, моющих средств.
Можно сказать, что коллоидная химия — химия реальных тел. Примерами материи в коллоидном состоянии являются типографская краска и бумага, большая часть одежды и обуви, продукты питания, почва, атмосфера Земли, строительные материалы и т. д. Более того, наше тело — пример материи в коллоидном состоянии. Человек — это ходячий коллоид.
Вследствие большого разнообразия объектов, изучаемых коллоидной химией и решаемых ею задач, происходит обособление некоторых разделов в самостоятельные научные дисциплины, а также использование ее методов в смежных областях науки. Так из коллоидной химии выделилась физическая химия растворов полимеров, в значительной степени самостоятельно развиваются наука об аэрозолях, химия поверхности. С коллоидно-химическими проблемами связаны изучение биологических мембран, биохимия, биофизика и т. д.
СОДЕРЖАНИЕ КУРСА КОЛЛОИДНОЙ ХИМИИ
Коллоидная химия - это наука о поверхностных явлениях и дисперсных системах, их физических, химических, механических свойствах (рис. 1.1).
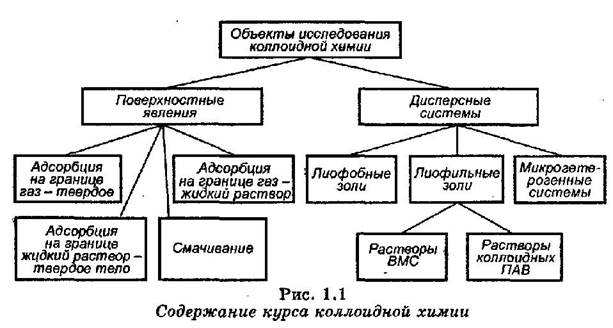
ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсная система (ДС) — это система, в которой хотя бы одно вещество находится в раздробленном состоянии.
ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз.
Одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой раздроблена дисперсная фаза, называется дисперсионной средой.
Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Если вещество раздроблено только по высоте, образуются пленки (ткани, пластины и т. д.). Если вещество раздроблено и по высоте и по ширине, образуются волокна, нити, капилляры. Наконец, если вещество раздроблено по всем трем направлениям, дисперсная фаза состоит из дискретных частиц.
Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, протекающие на поверхности, а не внутри фазы.
Таким образом:
В отличие от гомогенных истинных растворов, в которых растворенные вещества находятся в виде молекул или ионов, дисперсные системы являются гетерогенными. Одна из фаз этих систем находится в сильно измельченном (дисперсном) состоянии в виде твердых частичек, капель жидкости или пузырьков газа с размером, превышающим 10-7 см, и называется дисперсной фазой. Вторая фаза дисперсной системы, в которой распределены частицы дисперсной фазы, называется дисперсионной средой. Агрегатное состояние каждой из этих фаз может быть любым: твердым (Т), жидким (Ж), или газообразным (Г).
Дата добавления: 2022-07-01; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
