Потенциальная (техническая) работа
Основные понятия и определения
Термодинамическая система
Объектом изучения термодинамики является термодинамическая система. Под понятием системы подразумевается тело или совокупность тел. Система называется закрытой, если она сохраняет постоянное количество вещества при всех происходящих в ней изменениях; если нет, то систему принято называть открытой.
Если между системой и окружающей ее средой нет каких-либо энергетических взаимодействий, то такую систему принято называть изолированной системой.
Система, состоящая из одной фазы вещества или веществ, называется гомогенной. Гомогенная система, неподверженная действию гравитационных, электромагнитных и других сил и имеющая во всех своих частях одинаковые свойства, называется однородной.
Система, состоящая из нескольких гомогенных частей (фаз), отделенных поверхностью раздела, называется гетерогенной.
Термодинамической системой принято называть закрытую систему, внутреннее состояние которой определяется N = n +1 независимыми переменными (n-деформационные координаты и T – абсолютная температура), связь между параметрами называется уравнением состояния, в случае простого тела (реальный газ) состояние системы характеризуется двумя попарно независимыми параметрами в этом случае уравнение состояния в неявном виде имеет следующий вид F(р, v , T) = 0. Состояние идеальной системы (идеальный газ) вполне определяется одним параметром-абсолютной температурой.
|
|
|
Если состояние термодинамической системы и ее параметры не изменяются во времени, то говорят, что система находится в равновесном состоянии.
Равновесным состоянием системы называется такое состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Параметры состояния
Параметры состояния - физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные. Интенсивные свойства не зависят от массы системы, а экстенсивные - пропорциональны массе.
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы.
К простейшим термодинамическим параметрам состояния относятся: удельный объем ( 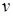 ), давление (
), давление ( 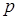 ) и температура (
) и температура ( 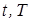 ).
).
Удельный объем ( 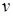 ) - это объем единицы массы вещества, а величина, обратная удельному объему, называется плотностью вещества (
) - это объем единицы массы вещества, а величина, обратная удельному объему, называется плотностью вещества ( 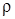 )
)
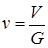 ; r
; r 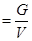 ;
; 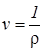 , (1.1)
, (1.1)
где V – объем, м3; G – масса вещества, кг; 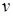 – удельный объем,
– удельный объем, 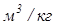 ;
;
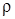 – плотность,
– плотность, 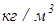 .
.
|
|
|
Отношение массы вещества (G) к его молярной массе ( 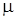 ) определяет число киломолей (кмоль) вещества
) определяет число киломолей (кмоль) вещества
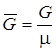 . (1.2)
. (1.2)
Объем киломоля вещества или молярный объем 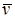 связан с удельным объемом следующим соотношением:
связан с удельным объемом следующим соотношением:
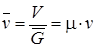 . (1.3)
. (1.3)
Абсолютное давление ( 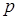 ) есть предел отношения нормальной составляющей силы к площади, на которую действует эта сила
) есть предел отношения нормальной составляющей силы к площади, на которую действует эта сила
В расчетные соотношения термодинамики входит лишь абсолютное давление , определяемое как сумма манометрического (избыточного) давления (p ман.) и давления окружающей среды (p 0 ).
В термодинамике для измерения температур используется международная стоградусная температурная шкала Цельсия (t, °С), а в качестве параметра состояния используется абсолютная температура (T , K ).
Абсолютная температура (Т) измеряется по термодинамической абсолютной шкале температур, которая аналитически строится на основе дифференциальных соотношений термодинамики. При практическом построении термодинамической шкалы в качестве реперных точек принимаются абсолютный нуль (-273,15 °С) и параметры тройной точка воды. Между температурами по шкале Кельвина и шкале Цельсия существует следующая зависимость: T = t + 273,15, К.
|
|
|
Термодинамические процессы
Изменение состояния системы называется процессом.
Равновесный процесс - это непрерывная последовательность равновесных состояний системы.
Обратимым процессом называется такой равновесный процесс, который в условиях изолированнщй системы допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса. В результате прямого и обратного обратимых процессов в системе не происходит каких либо остаточных конечных изменений.
Термодинамическим процессом принято считать обратимый равновесный процесс.
Любой реальный процесс является в большей или меньшей степени неравновесным. Однако, в принципе, эта неравновесность может быть сделана сколь угодной малой в результате уменьшения скорости осуществления процесса. Таким образом, равновесный процесс является предельным случаем неравновесного процесса при стремлении скорости этого процесса к нулю.
Обратимые процессы простых систем могут быть изображены графически на диаграммах состояния p - v , р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
|
|
|
Термодинамическая работа
Элементарная термодинамическая работа простых тел – работа обратимого изменения объема определяется в зависимости от величины давления и изменения объема (рис. 1.)
δL = pdV (1.5)
Разделив правую и левую часть уравнения (1.5) на массу G получим выражение для определения удельной элементарной термодинамической работы обратимого изменения объема 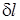 (Дж/кг)
(Дж/кг)
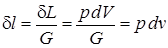 . (1.6)
. (1.6)
Поскольку термодинамическая работа зависит от пути (вида) процесса, для вычисления интегральных значений полной ( 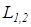 ), или удельной (
), или удельной ( 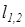 ) работы должны быть заданы уравнения процессов изменения состояния тела в форме,
) работы должны быть заданы уравнения процессов изменения состояния тела в форме, 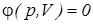 либо его графическое изображение в диаграммах состояния р–V или р–v .
либо его графическое изображение в диаграммах состояния р–V или р–v .
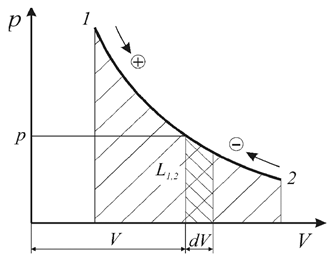
Рис. 1.1 Термодинамическая работа обратимого изменения объема
Как следует из соотношений (1.5) работа определяется площадью под кривой процесса и осью ординат независимо от вида рабочего тела и его свойств (рис. 1). В силу этого координаты р–V и р–v называются универсальными координатами работы.
В частном случае для изобарного процесса (p = idem) интегральные значения полной и удельной термодинамической работы определяются по следующим соотношениям:
L 1,2 = 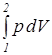 =
= 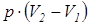 ; (1.7)
; (1.7)
l 1,2 = 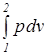 =
= 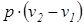 . (1.8)
. (1.8)
Работа расширения считается положительной т.е. работа отводится от системы ( 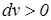 ,
, 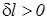 ), а работа сжатия – отрицательной т.е. работа подводится к системе (
), а работа сжатия – отрицательной т.е. работа подводится к системе ( 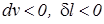 ).
).
Эффективная удельная элементарная работа реального процесса 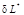 равна разности обратимой работы
равна разности обратимой работы 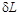 и работы необратимых потерь
и работы необратимых потерь 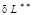 (
( 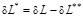 ). Необратимые потери термодинамической работы (
). Необратимые потери термодинамической работы ( 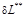 ) превращается в теплоту внутреннего теплообмена (
) превращается в теплоту внутреннего теплообмена ( 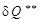 ).
).
Потенциальная (техническая) работа
Потенциальной (технической) работой называется работа по перемещению сплошных масс (газа, пара или жидкости) из области одного давления (p1) в область другого давления (p2), т.е. потенциальная работа - это работа обратимого изменения давления.
Элементарная потенциальная работа простого тела определяется из соотношения
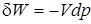 . (1.9)
. (1.9)
Удельная потенциальная работа в элементарном процессе 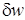 определяется по формуле
определяется по формуле
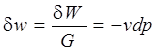 . (1.10)
. (1.10)
Для определения интегральных значений полной ( 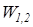 ) или удельной (
) или удельной ( 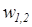 ) потенциальной работы должны быть заданы уравнения процесса изменения состояния рабочего тела
) потенциальной работы должны быть заданы уравнения процесса изменения состояния рабочего тела 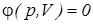 или его графическое изображение в диаграммах состояния р–V или р–v .
или его графическое изображение в диаграммах состояния р–V или р–v .
Как следует из соотношений (1.9), (1.10), работа определяется в координатах р–V площадью между кривой процесса и осью абсцисс независимо от вида рабочего тела и его свойств (рис. 1.2).
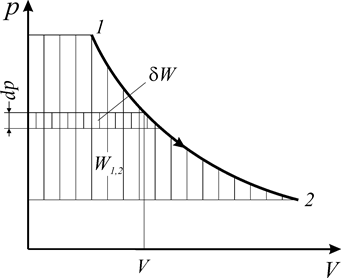
Рис. 1.2. Потенциальная работа обратимого изменения давления
В частном случае для изохорного процесса (v = idem) интегральные значения полной и удельной потенциальной работы определяются по следующим соотношениям:
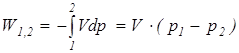 ;
; 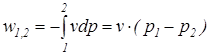 . (1.11)
. (1.11)
Потенциальная работа считается положительной при снижении давления ( 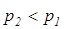 ) т.е.тработа отводится от системы и отрицательной – при повышении давления (
) т.е.тработа отводится от системы и отрицательной – при повышении давления ( 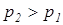 ) т.е. работа подводится к системе.
) т.е. работа подводится к системе.
Эффективная элементарная работа реального процесса 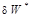 равна разности обратимой работы
равна разности обратимой работы 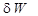 и работы необратимых потерь
и работы необратимых потерь 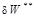 (
( 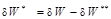 ). Необратимые потери термодинамической работы (
). Необратимые потери термодинамической работы ( 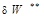 ) превращается в теплоту внутреннего теплообмена (
) превращается в теплоту внутреннего теплообмена ( 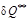 ).
).
Термодинамическая работа ( 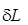 ) простого тела в замкнутом пространстве и потенциальная работа (
) простого тела в замкнутом пространстве и потенциальная работа ( 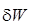 ) потока непосредственно передаются внешней системе (
) потока непосредственно передаются внешней системе ( 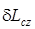 или
или 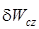 ) и используются для изменения энергии внешнего положения тела (dEcz)
) и используются для изменения энергии внешнего положения тела (dEcz)
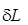 =
= 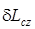 + dEcz;
+ dEcz; 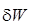 =
= 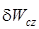 + dEcz . (1.12)
+ dEcz . (1.12)
В условиях механических процессов (dEcz=G × c Е × dc Е + G × g × dz) уравнение распределения термодинамической и потенциальной работ формулируется следующим образом:
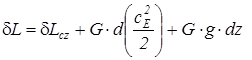 ; (1.13)
; (1.13)
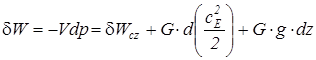 , (1.14)
, (1.14)
где cE – скорость движения тела, dz – изменение высоты центра тяжести тела в поле тяготения.
В реальных процессах уравнение распределения термодинамической и потенциальной работ формулируется следующим образом:
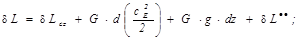 (1.14а)
(1.14а)
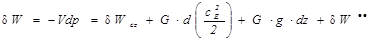 (1.14б)
(1.14б)
Внутренняя энергия тела
Внутренняя энергия U представляет собой полный запас энергии термодинамической системы и является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (d U).
Внутренняя энергия измеряется в Джоулях (Дж), а удельная внутренняя энергия (u) - в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р, T; р, v или T , v).
Теплота
Теплота - количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты 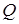 ,получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом (
,получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом ( 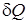 ).
).
Количество теплоты 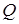 измеряется в Джоулях (Дж), а удельное количество теплоты
измеряется в Джоулях (Дж), а удельное количество теплоты 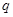 =
= 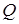 /
/ 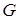 в Дж/кг.
в Дж/кг.
Теплоемкость
Истиной теплоемкостью называется количество теплоты, которое надо сообщить единице количества вещества в термодинамическом процессе (z = idem.), чтобы его температура повысилась на 1 градус.
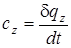 . (1.15)
. (1.15)
Различают массовую теплоемкость с, измеряемую в Дж/(кг × К), молярную 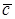 – Дж/(кмоль × К) и объемную с' – Дж/(м3 × К).
– Дж/(кмоль × К) и объемную с' – Дж/(м3 × К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
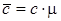 ;
; 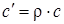 . (1.16)
. (1.16)
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме z = v = idem. (изохорная теплоемкость cv ) и постоянном давлении z = p = idem. (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t 1 до t 2, значение которой принимается неизменной для всего рассматриваемого интервала температур (с zm).
Из уравнения (1.16) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1 –2 (изобарном или изохорном), определяется соотношением
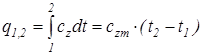 . (1.17)
. (1.17)
Отсюда следует выражение средней теплоемкости газа
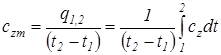 . (1.18)
. (1.18)
Для большинства газов значения средней теплоемкости в интервале температур от t 1 до t 2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур изменение истинной теплоемкости подчиняется линейному закону
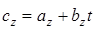 . (1.19)
. (1.19)
Подставив это выражение (1.20) в уравнение (1.19), получим
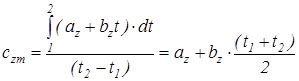 , (1.20)
, (1.20)
где с zm - первая средняя теплоемкость. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
Дата добавления: 2022-07-01; просмотров: 34; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
