Примеры использования флуоресценции
Сверхвысокая чувствительность
По своей чувствительности флуоресценция является абсолютным рекордсменом, превосходя методы детекции, базирующиеся на поглощении света или использовании радиоактивного распада[1]. Современные инструменты могут идентифицировать отдельные флуоресцентные молекулы. Это способствовало развитию отдельного направления — одномолекулярной флуоресцентной спектроскопии (ОФС. Одномолекулярная флуоресцентная спектроскопия открыла новые возможности для изучения биологических систем на молекулярном уровне. Например, классические методы исследования биомолекул, такие как спектроскопия ядерного магнитного резонанса, имеют дело с большими образцами, содержащими большое количество молекул, поэтому всё время приходится иметь дело с усреднённым сигналом. Другие методы, такие как электронная микроскопия, позволяют физически наблюдать за отдельными молекулами; однако такие методы не дают возможность изучать их в биологически-релевантных условиях. Одномолекулярная флуоресцентная спектроскопия стала важным методом исследования, сочетающим возможность наблюдать за отдельными молекулами с возможностью исследовать их в динамике и при биологически-релевантных условиях. 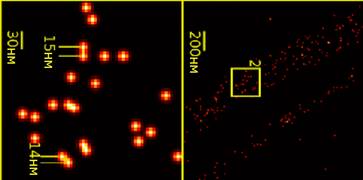
Мультиплексность детекции ( много цветов)
Существует большое количество флюорофоров, каждый из которых характеризуется определённым максимумом эмиссии (цветом флуоресценции). Это открывает возможность для мультиплексной детекции, то есть для наблюдения за несколькими объектами одновременно, если они закодированы флюорофорами с разными цветами эмиссии. Спектры эмиссии флюорофоров должны при этом не перекрываться. Если использовать флюорофоры с узкими спектрами, такие как квантовые точки, возможно наблюдать даже за пятью внутриклеточными целями одновременно
|
|
|
Совместимость с живыми организмами 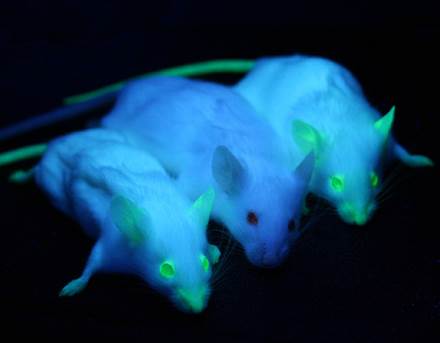
Существует возможность проводить исследования с использованием флуоресценции на живых клетках и даже целых организмах[10]. Видимый флуоресцентный свет не поглощается биологическими макромолекулами, водой и другими компонентами живых клеток и не влияет на процессы, происходящие в клетке.
За последние годы были разработаны многочисленные биосовместимые флюорофоры и флуоресцентные зонды. Среди них особенно выделяются флуоресцентные белки. Благодаря генной инженерии флуоресцентные белковые маркеры разных цветов могут быть присоединены к протеинам у различных лабораторных организмов
Высокая скорость ответа
Флуоресценция является очень быстрым процессом, который происходит в наносекундной шкале времени (в случае отдельных комплексов металлов — в микросекундной). За секунду одна молекула флюорофора может излучить миллионы фотонов, каждый из которых содержит информацию об окружении, в котором находилась молекула непосредственно перед эмиссией[11]. Благодаря этому флуоресценцию удобно использовать для исследования быстрых процессов, таких как сворачивание и динамика отдельных белковых молекул
|
|
|
Высокое пространственное разрешение
Пространственное разрешение метода указывает, на каком минимальном расстоянии должны находиться объекты для того, чтобы их можно было однозначно различить. Пространственное разрешение очень важно в исследованиях живых систем на микроскопическом уровне.
Флуоресцентные вещества, применяемые в биологии, можно условно разделить на две большие группы: флуоресцентные зонды и флуоресцентные метки[11][68]:
· Флуоресцентные метки служат для того, чтобы идентифицировать наличие или пространственное положение исследуемой молекулы. Флуоресцентная метка должна быть химически стабильной и демонстрировать стабильную флуоресценцию, которая не зависит от внешних факторов и минимально меняется во времени. Таким образом, она действует как пассивный «маяк», который сигнализирует о месте нахождения молекулы, к которой привязана.
|
|
|
· Флуоресцентный зонд является более сложным по своим функциям. Это молекулярная конструкция, которая может существовать в двух состояниях: «выключенном» и «включённом». Эти состояния различаются между собой определёнными параметрами флуоресцентной эмиссии (чаще всего квантовым выходом флуоресценции, позицией максимума в спектре эмиссии или временем жизни возбуждённого состояния). Переход между «включён» и «выключен» состояниями зависит от наличия в среде зонда тех молекул, которые он должен распознавать.
Примеры использования флуоресценции
Секвенирование ДНК
Секвенированием называют определение последовательности нуклеотидов в цепи нуклеиновой кислоты
Гибридизация ДНК
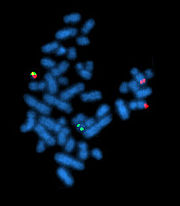
флуоресцентная гибридизация in situ между метафазными хромосомами и двумя ДНК-зондами, мечеными красным и зелёным цветами. Колокализация целевых фрагментов наблюдается в местах, которые флуоресцируют жёлтым
Молекулы ДНК состоят из двух цепей полинуклеотидов, которые комплементарны друг другу. Азотистые основания двух цепей образуют пары, которые стабилизированы водородными связями. Характерной чертой нуклеиновых кислот является способность к молекулярному узнаванию, благодаря которой одноцепные фрагменты ДНК имеют сродство с комплементарными фрагментами.
|
|
|
На основе явления гибридизации были созданы методы анализа последовательностей нуклеиновых кислот с использованием синтетических флуоресцентно-меченых олигонуклеотидов.
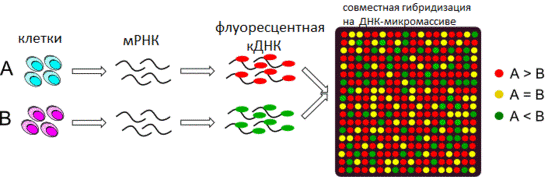
В организмах высших эукариот содержатся тысячи генов, совокупная работа которых определяет фенотип организма. Для быстрого одновременного исследования большого количества генов была разработана технология микромассивов ДНК[96].
Микромассивы ДНК
Микромассив ДНК представляет собой твёрдую поверхность, на которую нанесено большое количество индивидуальных олигонуклеотидов. Каждый элемент массива на поверхности содержит ДНК одного определённого строения, которое программируется при создании массива. Одним из методов создания ДНК-микромассивов является химический твердофазный синтез ДНК с использованием фотоактивных защитных групп[97].
Флуоресцентная микроскопия

Слева направо: 1) двумерная проекция возбуждающего лазерного импульса; 2) двумерная проекция STED импульса; 3) Зона возбуждения после наложения STED и возбуждающего импульсов
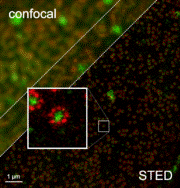
Сравнение разрешающей способности обычной конфокальной (левый верхний угол) и STED-микроскопии (правый нижний угол)
В растровом флуоресцентном конфокальном микроскопе изображение создаётся последовательным перемещением луча лазера от точки к точке кадра, регистрацией флуоресценции и последующей реконструкцией изображения на компьютере. Как оказалось, этот метод имеет некоторые недостатки. Явление дифракции накладывает определённые физические ограничения на минимальный размер сфокусированного лазерного луча, а следовательно, и на максимальное пространственное разрешение метода.
Дата добавления: 2022-07-01; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
