Лекция 11. Строения газообразных, жидких и твердых тел.
Контрольная работа № 3
«Законы сохранения в механике»


Лекция 10
Основные положения молекулярно-кинетической теории (МКТ). Размеры и масса молекул. Броуновское движение.
Существенный вклад в развитие молекулярно-кинетической теории сделал в середине 18в великий русский ученый М. В. Ломоносов.
Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частицах химического вещества.
3 основных положения МКТ:
Любое вещество состоит из мельчайших частиц-молекул
Молекулы находятся в непрерывном движении
Молекулы способны взаимодействовать между собой - притягиваться и отталкиваться.
Молекула-это мельчайшая частица данного вещества, сохраняющая все его химические свойства и способная к самостоятельному существованию.
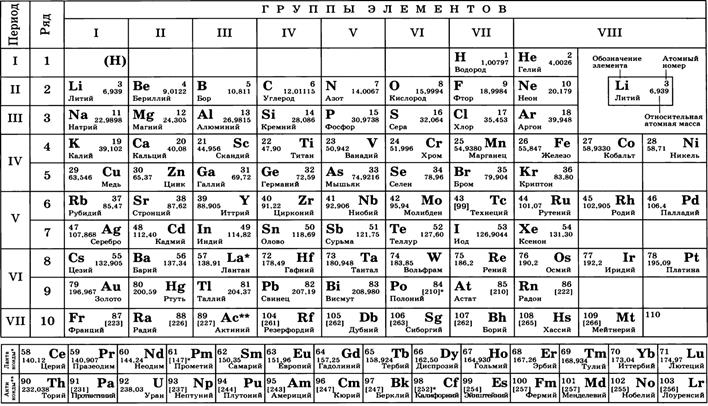
Так как известно, что молекулы состоят из атомов, то массу молекул удобно выражать в относительных атомных единицах массы (а. е. м.). Масса атома углерода равна 12 а.е.м. Атомные массы других атомов указаны в таблице Менделеева (см. после лекции 10 - приложение 1)
Например, масса атома водорода 1 а.е.м., атома азота-14 а.е.м., атома кислорода-16 а.е.м.
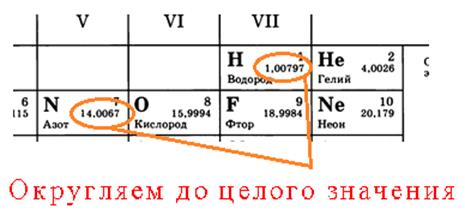
Относительную молекулярную массу вещества принято обозначать Mr. Например, относительная молекулярная масса воды Mr(H2O)= 1 а.е.м.·2 +16 а.е.м.=18 а.е.м.
|
|
|
Относительная молекулярная масса серной кислоты

Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц. Обозначается («нью»), единица измерения моль. Количество вещества можно найти с помощью формул:

Число молекул, содержащихся в одном моле любого вещества, есть величина постоянная и составляет 6·1023 моль-1. Это значение было найдено в 1811г итальянским физиком А. Авагадро и названа ПОСТОЯННАЯ АВАГАДРО.
Под молярной массой понимают массу вещества, взятого в количестве 1 моль. Молярная масса обозначается М, единицы измерения кг/моль.
Молярной массой М называется величина, равная отношению массы вещества m к количеству вещества : М =
Молярную массу М можно вычислить, пользуясь таблицей Менделеева
М= Mr·10-3 кг/моль.
Например, молярная масса SO4
М(SO4)= 32+16·2 =64 г/моль=64 ·10-3 кг/моль=0,064 кг/моль
Задание 1. Ответить на вопросы
• Написать определение понятия «броуновское движение» и не менее трех примеров.
• Написать определение понятия «диффузия» и не менее трех примеров.
Приложение 1
Практическая работа № 17 «Масса и количество вещества»
Цель: ознакомиться со способами расчета массы и количества вещества. Развить практические умения при решении задач.
|
|
|
| Оценка | Критерии |
| 3 | №1 №2 №3 (таблицы) |
| 4 | №4 №5 №6 №7 |
| 5 | №8 |




Лекция 11. Строения газообразных, жидких и твердых тел.







Задание 1. Ответить письменно на вопросы, используя текст лекции 11.
• Газы. Характеристика. Основные свойства.
• Жидкости. Характеристика. Основные свойства.
• Твердые тела. Характеристика. Основные свойства. Определение кристаллической решетки. Пример кристаллической решетки поваренной соли (рис. 135)
Лекция 12
Дата добавления: 2022-06-11; просмотров: 37; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
