Основные положения Теории электролитической диссоциации
ЗАДАНИЕ К УРОКУ №2
Дата15.01.2021 Группа п-202
Дисциплина: Химия
Раздел Электролитическая диссоциация
Тема уроков:
Теория электролитической диссоциации
Классификация и свойства растворов электролитов
Реакции ионного обмена в растворах
Электролитическую диссоциацию изучаем 3 урока по 45 минут
Задание почитать, посмотреть, написать на ваш взгяд важное. Тема будет на экзамене. Поэтому хорошо, что бы была в тетради. Можно сделать компьютерный вариант и вклеить в тетрадь. Определения необходимые отмечу желтым.
Срок сдачи завтра до 17.00
План занятия:
1. Вспомните, что проходили по теме в школе с помощью сайта РЭШ
https://resh.edu.ru/subject/lesson/1518/main/ класс 9 урок 5. Сущность процесса электролитической диссоциации.Диссоциация кислот, оснований и солей.Слабые и сильные электролиты. Степень диссоциации ДО урока 9 https://resh.edu.ru/subject/lesson/2101/start/ Урок 9. Обобщение по темам «Классификация химических реакций» и «Электролитическая диссоциация».
2. Прочитайте тему в учебнике Габриелян, Лысова 11 класс параграф 15 стр 148 Электролитическая диссоциация.
3. В тетради напишите определения.
4. Фото прошу выслать в вк.
5. Срок сдачи сегодня до 17.00
Желаю плодотворной работы!
Конспект
Теория электролитической диссоциации (ТЭД)
Электролитическая диссоциация
Понятие электролитов впервые ввел М. Фарадей в первой половине XIX века. Согласно его определению:
|
|
|
Определение
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Опустим в стакан с водой графитовые стержни, присоединенные к источнику тока и связанные цепью с электрической лампой. При включении рубильника никаких видимых изменений не происходит. Это означает, что вода не проводит электрический ток, то есть не является электролитом. Внесем в стакан с водой поваренную соль – хлорид натрия, NaCl. Лампа ярко вспыхивает.Наличие проводимости свидетельствует о появлении в растворе заряженных частиц. Направленное движение частиц наблюдается также в расплавах солей (например, электролиз расплава хлорида натрия позволяет получать металлический натрий, выделяющийся на катоде и газообразный хлор на аноде).
Определение
Атомы и группы атомов, несущие электрический заряд, называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные ионы - анионами.
Проведя дополнительный опыт, можно убедиться, что сухая поваренная соль не проводит электрический ток. Таким образом, можно сделать вывод, что свободные ионы появляются в расплаве и при растворении соли в воде.
|
|
|
Рассмотрим на атомарном уровне, что происходит с кристаллом поваренной соли при попадании его в воду. Соль – вещество с ионной кристаллической решеткой, в узлах которой расположены катионы натрия и анионы хлора. Они удерживаются друг около друга благодаря силам электростатического притяжения.
Молекула воды представляет собой диполь, так как на атомах водорода локализованы частичные положительные заряды, на на атоме кислорода – отрицательный.
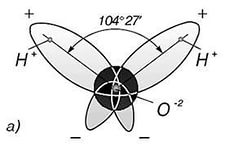
В молекуле воды атомные орбитали кислорода находятся в sp3-гибридизации (то есть имеет форму тетраэдра), причем две недостающие орбитали из четырех образованы двумя парами электронов (электронная конфигурация внешнего уровня кислорода 2s22p4). Поэтому между связями в молекуле воды угол составляет примерно 104 градуса, то есть молекула имеет не линейную, а угловую форму. Благодаря этому молекула воды является диполем, и ее дипольный момент не равен нулю.
Для объяснения свойств водных растворов электролитов С. Аррениус в 1887 году предложил теорию электролитической диссоциации. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие - нет. Более подробно особенности поведения веществ в растворах описал Д.И. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя. Сущность процесса электролитической диссоциации было объяснено на основании природы химической ионной связи.
|
|
|
Согласно теории Д.И. Менделеева, электролитическая диссоциация молекул электролитов протекает в три стадии. Рассмотрим эти стадии на примере поваренной соли NaCl.
1. При попадании в воду, молекулы воды окружают кристаллы поваренной соли, притягиваясь к катионам натрия своими отрицательно заряженными концами, а к анионам хлора - положительно заряженными. Эта стадия называется ассоциация.
2. За счет электростатического взаимодействия, молекулы воды "растаскивают" молекулу электролита, связь между ионами в кристалле ослабевает и разрывается, то есть происходит непосредственно диссоциация (распад) молекул.
3. Диполи воды полностью окружают образовавшиеся при распаде ионы, катионы и анионы, образуя гидратную оболочку. Гидратированные ионы переходят в раствор.
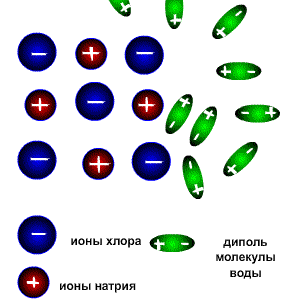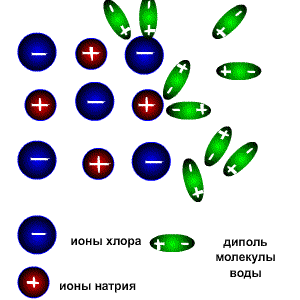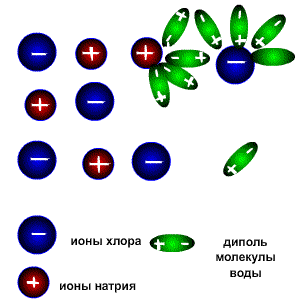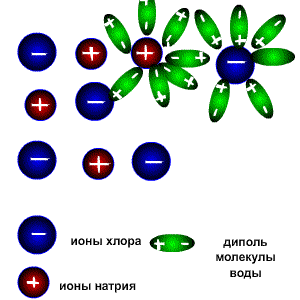
В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например, этанол. В таком случае ионы окружены молекулами растворителя (образуют сольватную оболочку) и называются сольватированными.
|
|
|
Определение
Ионы в водном растворе окружены молекулами воды, то есть имеют гидратную оболочку, и называются гидратированными.
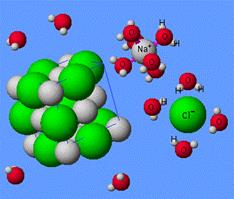
Таким образом, описанный выше процесс можно описать уравнением:
NaCl(aq)→Na(aq)++Cl(aq)−
где Na(aq)+,Cl(aq)− - гидратированные ионы,т.е. ионы, окруженные молекулами воды.
В большинстве случаев этот процесс записывают упрощенно, не указывая гидратированное состояние ионов:
NaCl(aq)→Na++Cl−
Определение
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов). Поэтому в уравнении электролитической диссоциации всегда ставят знак ↔.
В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли:
HCl↔H++Cl–
NaOH↔Na++OH−
Al2(SO4)3↔2Al3++3SO42–
При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов.
Особенно сильно гидратирован ион водорода H+. Он находится в водных растворах в виде иона гидроксония H3O+ или более сложных ионов.
Основные положения Теории электролитической диссоциации
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Определение
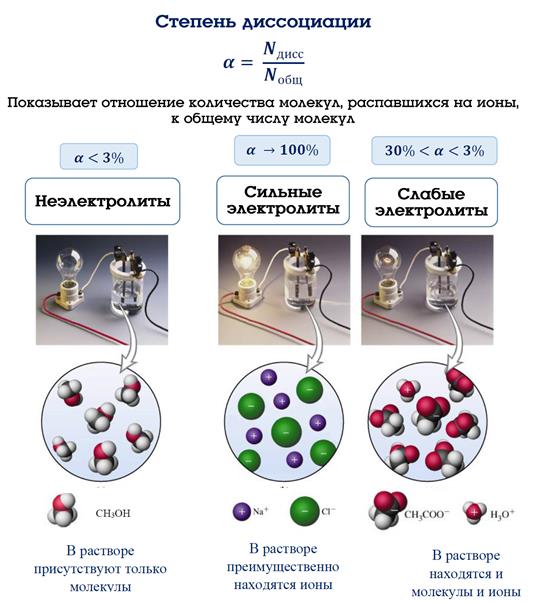
Степень электролитической диссоциации α показывает отношение числа молекул, распавшихся на ионы общ(Nобщ) к общему числу молекул, введенных в раствордисс.(Nдисс.) и зависит от природы электролита и растворителя, температуры и концентрации:
дисс.общα=Nдисс.Nобщ
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
| Название | Определение | Уравнение диссоциации |
| Оксиды | Неэлектролиты, состоят из атомов элемента и кислорода | Не диссоциируют в водных растворах |
| Кислоты | Электролиты, при диссоциации образуют катионы водорода | H2SO4→2H++SO42− HNO3→H++NO3− HCl→H++Cl− H2CO3⇌2H++CO32− H3PO4⇌3H++PO43− CH3COOH⇌CH3COO−+H+ H2C2O4⇌2H++C2O42− |
| Основания | Электролиты, при диссоциации образуют гидроксид-анионы.Растворимые в воде основания называют щелочами | NaOH→Na++OH− KOH→K++OH− Ca(OH)2→Ca2++2OH− Ba(OH)2→Ba2++2OH− NH3⋅OH⇌NH4++OH− |
| Соли | Электролиты, при диссоциации образуют катионы металла и анионы кислотного остатка | Na2SO4→2Na++SO42− KNO3→K++NO3− CaCl2→Ca2++Cl− Na2CO3→2Na++CO32− Mg3(PO4)2→3Mg2++2PO43− (CH3COO)2Zn→2CH3COO−+Zn2+ BaC2O4→Ba2++C2O42− |
Классификация и свойства растворов электролитов о зарегистрироваться
Определение
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
К электролитам относят большинство неорганических соединений и растворимые соли органических кислот. Большинство органических соединений не проводят электрический ток и относятся к неэлектролитам.
Согласно теории электролитической диссоциации, предложенной С. Аррениусом, для количественной оценки диссоциации используют количественный показатель - степень диссоциации.
Определение
Степень диссоциации (α) – это отношение числа частиц, распавшихся на ионы общ(Nобщ) к общему числу частиц, введенных в раствордисс.(Nдисс.):
дисс.общα=Nдисс.Nобщ
Степень диссоциации зависит от следующих факторов:
- от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
- от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
По степени диссоциации электролиты делятся на сильные (α>30%) и слабые (α<30%).
Все растворимые соли ( в том числе соли органических кислот) являются сильными электролитам. Кроме того, электролитами являются растворы кислот и щелочей (растворимых оснований), при этом сила кислот и оснований зависит от степени диссоциации:
| Электролиты | ||
| Сильные α >30% | Слабые α < 30% | |
| кислоты |
|
|
| основания |
|
|
Определение
Сильные электролиты - это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. Степень диссоциации .стремится к единице (100%)
Сильные электролиты диссоциируют практически необратимо, поэтому в их водных растворах не содержится исходных молекул или негидратированных ионов, в уравнении диссоциации используют символ "→"
Определение
Слабые электролиты - не полностью диссоциируют на ионы в водных растворах. Их степень диссоциации значительно меньше единицы, а в большинстве случаев стремится к нулю
Диссоциация слабых электролитов обратима, то есть одновременно с ней протекает и противоположный процесс – ассоциация, в уравнении используют символ "⇔"
В растворах слабых электролитов преобладают не ионы, а недиссоциированные молекулы. Именно этим, например, объясняется, что растворы уксусной кислоты сохраняют запах даже при сильном разбавлении водой (обонятельные рецепторы реагируют на молекулы веществ, а не на ионы).
С точки зрения теории электролитической диссоциации можно рассматривать строение и свойства кислот, оснований и солей.
Определение
Кислоты - это электролиты, которые в растворе диссоциируют с образованием катионов только одного типа - гидратированных ионов водорода.
Диссоциация сильных кислот протекает в одну стадию, то есть одноступенчато, с одновременным отщеплением всех катионов водорода:
H2SO4→2H++SO42−
HNO3→H++NO3−
Слабые кислоты диссоциируют многоступенчато (число ступеней диссоциации = числу атомов Н в кислоте):
I) H2CO3⇔H++HCO3− гидрокарбонат-ион
II) HCO3−⇔H++CO32− карбонат-ион
Определение
Основания - это электролиты, которые в растворе диссоциируют с образованием в качестве отрицательных ионов только гидроксид-анионов.
Диссоциация сильных оснований протекает в одну стадию, то есть одноступенчато при этом происходит отщепление сразу всех гидроксо-групп:
NaOH→Na++OH−
Ca(OH)2→Ca2++2OH−
Слабые основания диссоциируют многоступенчато (число ступеней = числу гидроксильных групп):
I) Cr(OH)3⇔OH−+Cr(OH)2+ катион дигидроксохрома (III)
II) Cr(OH)2+⇔OH−+Cr(OH)2+ катион гидроксохрома (III)
III) Cr(OH)2+⇔OH−+Cr3+ катион хрома (III)
Определение
Соли - это электролиты, которые диссоциируют в растворе с образованием катиона металла и аниона кислотного остатка:
NaOH→Na++OH–
K2SO4→2K++SO42–.
Кислые соли диссоциируют с образованием катиона металла и сложного аниона, состоящего из водорода и кислотного остатка. Сложный анион затем диссоциирует на катион водорода и анион кислотного остатка:
I) KH2PO4⇔K++H2PO4−+ дигидрофосфат-ион
II) H2PO4−⇔H++HPO42− гидрофосфат-ион
III) HPO42−⇔H++PO43− фосфат-ион
Основные соли диссоциируют с образованием аниона кислотного остатка и сложного катиона, состоящего из гидроксогруппы и металла. Сложный катион затем диссоциирует на гидроксид-ион и катион металла:
I) (Fe(OH)2)2SO4⇔SO42−+2Fe(OH)2+ катион дигидроксожелеза (III)
II) Fe(OH)2+⇔OH−+Fe(OH)2+ катион гидроксожелеза (III)
III) Fe(OH)2+⇔OH−+Fe3+ катион железа (III)
Дата добавления: 2022-06-11; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
