Процесс диссоциации – обратимый процесс для слабых электролитов.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
1) Cu(OH)2 ⇆ CuOH+ + OH-
2) CuOH+ ⇆ Cu2+ + OH-
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
NaCl = Na+ + Cl-
NH4NO3 = NH4+ + NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4+), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
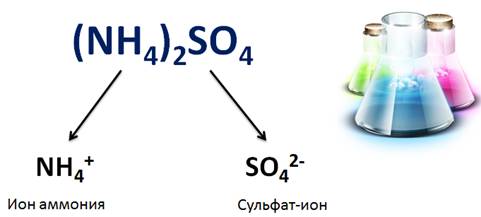
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
|
|
|
NaHCO3 = Na+ + HCO3-
HCO3- ⇆ H+ + CO32-
«Основные положения ТЭД»
1. При растворении в воде или расплавлении электролиты диссоциируют на ионы: положительные и отрицательные. Ионы – это положительно и отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
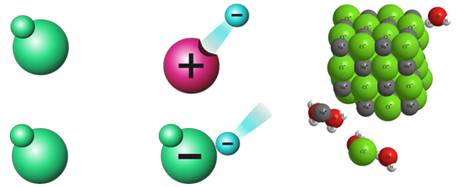
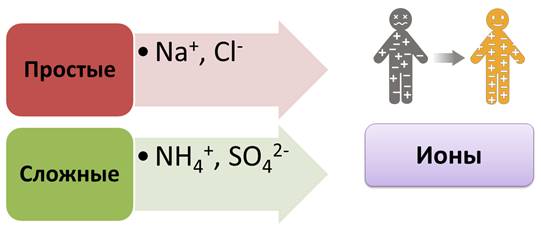
В растворах ионы беспорядочно передвигаются. В переводе с греческого «ион» означает «странствующий». По составу ионы делятся на простые: Na+, Cl-, и сложные: NH4+, SO42-.
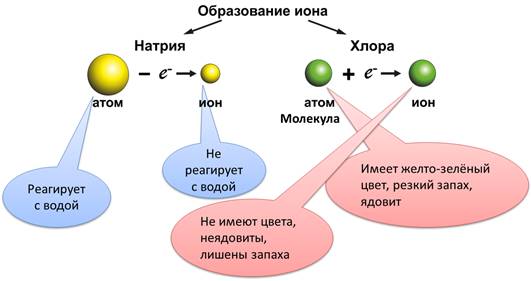
Ионы заметно отличаются от атомов этого же элемента. Так атомы натрия (Na0) энергично реагируют с водой с образованием щёлочи и водорода, а ион натрия (Na+) таких продуктов не образует. Хлор (Cl2) имеет желто-зелёный цвет, резкий запах, ядовит, а ионы хлора (Cl-) не имеют цвета, неядовиты, лишены запаха.
Причиной диссоциации электролита является его гидратация с молекулами воды и разрыв химической связи в нём.
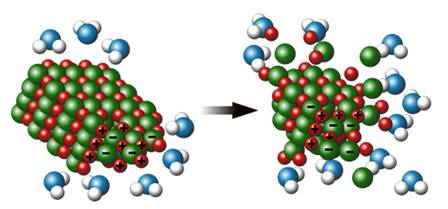
В результате взаимодействия воды с молекулами воды образуются гидратированные ионы. Поэтому, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока – к катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительно заряженному полюсу источника тока – аноду, поэтому их называют анионами.
|
|
|
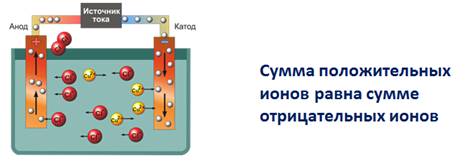
В растворах электролитов сумма положительных ионов (катионов) равна сумме отрицательно заряженных ионов (анионов), потому эти растворы электронейтральны.
Процесс диссоциации – обратимый процесс для слабых электролитов.
Наряду с процессом диссоциации, т.е. распадом электролита на ионы, в растворах слабых электролитов протекает обратный процесс – ассоциация, т.е. соединение ионов. Поэтому при диссоциации слабых электролитов в уравнении ставят не знак равенства, а знак обратимости.
HNO2 ⇆ H+ + NO2-
Дата добавления: 2022-06-11; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
