Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
СТРОЕНИЕ АТОМА
Состояние электрона в атоме описывается четырьмя квантовыми числа- ми: главным − n, орбитальным − l, магнитным − ml и спиновым − ms.
Главное квантовое число (n) − определяет общую энергию электрона на данной орбитали и его удаленность от ядра. Оно может принимать 24 любые целые значения, начиная с единицы (n = 1, 2, 3, ...). Энергетический минимум − у электронов первого уровня. Они наиболее прочно связаны с ядром. Число за- полняемых электронами энергетических уровней в атоме численно равно номе- ру периода, в котором находится атом данного элемента. Элементы первого пе- риода имеют один энергетический уровень, второго − два энергетических уров- ня и т.д.
Максимальное число электронов на энергетическом уровне равно N= 2n2, где N − число электронов; n − главное квантовое число (номер) уровня.
Изменение главного квантового числа соответствует скачкообразному изменению размера электронного облака: увеличение значения числа n соот- ветствует увеличению электронного облака и уменьшению энергии связи элек- трона с ядром и наоборот.
В пределах одного энергетического уровня электроны отличаются своими энергетическими подуровнями. Существование различий в энергетическом со- стоянии электронов, принадлежащих к различным подуровням данного энерге- тического уровня, описывается орбитальным (побочным) квантовым числом (l). Это число принимает значения от 0 до (n−1). Обычно численные значения при- нято обозначать следующими буквенными символами:
|
|
|
значения l 0 1 2 3
буквенные обозначения s p d f
В этом случае говорят о s- , p-, d-, f-орбиталях. При n=1 возможна только одна форма орбитали, при n=2 − две формы орбитали и т.д. Согласно квантово- механическим представлениям s орбиталь имеет форму шара, p − форму ганте- ли. Формы облаков d и f намного сложнее.
Электроны, вращающиеся на различных орбиталях, обладают различным запасом энергии. Чем сложнее движение, тем больше запас энергии. Es < Ep < Ed
< Ef. Для характеристики пространственного расположения орбиталей приме- няется магнитное квантовое число - ml.
ml = 0; ±1; ±2; ... ±l
Число значений магнитного квантового числа зависит от орбитального квантового числа и равно (2l + 1).
Таким образом s-состоянию отвечает одна орбиталь; p − 3 и т.д.
На основании спектроскопических данных было показано, что кроме раз- личия размеров облаков, их формы и характера расположения относительно друг друга, электроны различаются спином. Для характеристики спина служит спиновое квантовое число - ms, которое характеризует вращение электрона во- круг своей оси и принимает значение ±1/2. Следовательно, электрон в атоме ха- рактеризуется четырьмя квантовыми числами.
|
|
|
При переходе электрона из одного квантового состояния в другое меня- ются значения квантовых чисел. Это означает перестройку электронного обла- ка, поглощение или испускание атомом соответствующего кванта энергии. При химических реакциях ядра реагирующих атомов остаются без изменения, таким образом, химические и физические свойства атомов зависят от строения элек- тронных оболочек атомов.
Для объяснения строения электронных оболочек атома служат три основ- ных правила:
1. Принцип Паули;
2. Принцип наименьшей энергии;
3. Правило Гунда.
В 1925 году Паули сформулировал принцип (или запрет) Паули: в атоме не может быть двух и более электронов, обладающих одинаковыми свойствами, т .е. не может быть двух и более электронов, обладающих одинаковым значени-
ем всех четырех квантовых чисел. Правило Гунда: при данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Т.е., если в трех р-ячейках атома азота надо расположить три электрона, то они будут располагаться каждый в отдельной ячейке.
Принцип наименьшей энергии в атоме: каждый электрон располагается так, чтобы его энергия была минимальна (что отвечает его наибольшей связи с ядром). Т.е., электрон в основном состоянии занимает уровень не с минималь- ным значением n, а с наименьшим значением суммы (n + l). В этом случае, ко- гда для двух подуровней суммы значений (n + l) равны, сначала идет заполне- ние подуровня с меньшим значением n. Например, на подуровнях 3d; 4p; 5s сумма значений n и l равна пяти. В этом случае происходит заполнение под- уровней с меньшими значениями n, то есть 3d → 4p → 5s.
|
|
|
Согласно принципу наименьшей энергии орбитали можно расположить в ряд 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d и т.д. Распределение электро- нов в атоме по энергетическим уровням и подуровням изображают в виде элек- тронных формул.
Структуру электронных оболочек изображают с помощью энергетиче- ских или квантовых ячеек − графические электронные формулы. Основное со- стояние атома − это когда электроны в атоме заполняют орбитали в соответ- ствии с законом минимальной энергии. Если атому сообщается извне дополни- тельная энергия, то происходит переход электронов на свободные орбитали. Такое состояние атом называется возбужденным. В зависимости от электрон- ной структуры различают несколько семейств элементов: если последним за- полняется s-подуровень любого уровня, то эти элементы относятся к s- семейству; если р – то к р-семейству и так далее.
|
|
|
мать?
Пример 1. Что такое квантовые числа? Какие значения они могут прини-
Решение. Движение электрона в атоме носит вероятностный характер.
Околоядерное пространство, в котором с наибольшей вероятностью (0,9–0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная ор- биталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значе- ния. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует элек- тронное облако, которое у электронов одного и того же атома может иметь раз- личную форму (рис. 1). Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако ха- рактеризуется четырьмя квантовыми числами (n, l, ml и ms). Эти квантовые чис- ла связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число ml (магнитное) - магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отли-
чаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (ms =
±1/2).
В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энерге- тическом уровне в подуровне.
Таблица 1.
Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
| Квантовый |
Магнитное квантовое число m l | Число квантовых состо- яний (орбиталей) | Максимальное число электронов | |||||
| уровень | подуровень | |||||||
| обозна- чение | главное квантовое число n | обозна- чение | орбитальное квантовое число l | в подуровне (2/+1) | в уровне n 2 | в под- уровне (2/+1) | в уровне 2n 2 | |
| K | 1 | s | 0 | 0 | 1 | 1 | 2 | 2 |
| L | 2 | s p | 0 1 | 0 -1; 0; +1 | 1 3 | 4 | 2 6 | 8 |
| M | 3 | s p d | 0 1 2 | 0 -1; 0;+1; -2;-1; 0;+1; +2 | 1 3 5 | 9 | 2 6 10 | 18 |
| N | 4 | s p d f | 0 1 2 3 | 0 -1; 0;+1 -2;-1; 0;+1;+2 -3;-2;-1; 0;+1; +2;+3; | 1 3 5 7 | 16 | 2 6 10 14 | 32 |
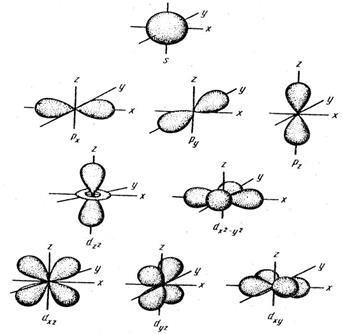
Рис. 1. Формы s-, p- и d- электронных облаков (орбиталей)
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в ато- ме по энергетическим уровням, подуровням (атомным орбиталям). Электронная кон- фигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечков- ского). Последовательность заполнения энергетических уровней и подуровней сле- дующая:
1s ® 2s ® 2 p ® 3s ® 3p ® 4s ® 3d ® 4 p ® 5s ® 4d ® 5 p ® 6s ® (5d1) ® 4 f ®
® 5d ® 6 p ® 7s ® (6d1-2) ® 5 f ® 6d ® 7 p
Так как число электронов в атоме того или иного элемента равно его порядко- вому номеру в таблице Д.И. Менделеева, то для элементов №16 (сера) и №22 (титан) электронные формулы имеют вид:
16S
22Ti
1s2 2s2 2 p6 3s2 3 p4
1s2 2s2 2 p6 3s2 3 p6 3d 2 4s2
Электронная структура атома может быть изображена также в виде схем разме-

 щения электронов в квантовых (энергетических) ячейках, которые являются схемати- ческим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде
щения электронов в квантовых (энергетических) ячейках, которые являются схемати- ческим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде

 прямоугольника , кружка или линейки , а электроны в этих ячейках обо- значают стрелками. В каждой квантовой ячейке может быть не более двух электронов с
прямоугольника , кружка или линейки , а электроны в этих ячейках обо- значают стрелками. В каждой квантовой ячейке может быть не более двух электронов с
 противоположными спинами , или . В данном пособии применяют пря- моугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
противоположными спинами , или . В данном пособии применяют пря- моугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
16S
22Ti
s
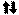
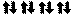
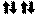
| ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 n=1 p
n=1 p
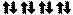
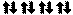
 n=2 n=3 n=4
n=2 n=3 n=4
Пример 3. Изотоп 101-го элемента – менделевия (256) был получен бомбарди- ровкой a-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядер- ной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменени- ем состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращения атомных ядер как при естественной, так и при искусственной ра- диоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядер- ную реакцию выражают уравнением:
253Es +4 He =256 Md +1 n
99 2 101 0
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид: 253Es(a, n)256Md. В скобках на первом месте пишут бомбардирующую ча- стицу, а на втором, через запятую, - частицу, образующуюся при данном процессе. В
4 He; 1H; 2D; 1 n
сокращенных уравнениях частицы 2
p, d, n.
1 1 0
обозначают соответственно a,
Пример 4. Исходя из сокращенных уравнений ядерных реакций (табл. 2), напишите их полные уравнения.
Решение. Ответ на вопрос отражен в табл. 2.
Таблица 2
Дата добавления: 2022-06-11; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
