Важнейшие представители и их применение
СПИРТЫ И ФЕНОЛЫ
Спирты – это производные углеводородов, содержащие гидроксильную группу –ОН.
Классификация спиртов
1. По типу углеводородного радикала R, связанного с гидроксильной группой, различают: предельные, непредельные и ароматические спирты.
2. По атомности, т.е. по числу гидроксильных групп, спирты делятся на одноатомные, двухатомные (гликоли), трехатомные (глицерины) и многоатомные.
3. 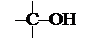 По расположению гидроксильной группы в углеродной цепи спирты принято делить на первичные (–СН2–ОН), вторичные (>СН–ОН) и третичные ( ).
По расположению гидроксильной группы в углеродной цепи спирты принято делить на первичные (–СН2–ОН), вторичные (>СН–ОН) и третичные ( ).
Одноатомные спирты
Одноатомные спирты содержат одну гидроксильную (или окси-) группу и могут быть предельными, непредельными и ароматическими.
Строение, изомерия, номенклатура
Предельные спирты. Общая формула CnH2n+1OH.
Важнейшие представители одноатомных спиртов:
СН3ОН – метиловый спирт (метанол)
СН3–СН2ОН – этиловый спирт (этанол)
СН3–СН2–СН2ОН – н-пропиловый спирт (пропанол-1) (первичный)
СН3–СН(ОН)–СН3 – изопропиловый спирт (пропанол-2) (вторичный)
Непредельные спирты:
СН2=СНОН – виниловый спирт (этенол)
СН2=СН–СН2ОН – аллиловый спирт (пропенол)
Ароматические спирты:
 |
В соответствии с правилами номенклатуры ИЮПАК названия спиртов складываются из названия соответствующего углеводорода, к которому прибавляется окончание «-ол».
Предельные спирты
|
|
|
Нахождение в природе. Одноатомные спирты в природе в свободном состоянии встречаются в небольших количествах. Они входят в состав душистых веществ, эфирных масел. Широко распространены производные спиртов в виде простых и сложных эфиров.
Способы получения
1. Брожение сахаристых веществ растительного сырья (картофель, рис, хлебные злаки) используется для получения этилового спирта.
Брожение - бескислородный распад органических веществ, происходящий под действием биологических катализаторов (ферментов), вырабатываемых микроорганизмами:
С6Н12О6 → 2С2Н5ОН + 2СО2 + 105 кДж.
глюкоза этиловый
спирт
2. Присоединение воды к алкенам (реакция гидратации) происходит при температуре 300оС:
Н2С=СН2 + Н2О ® СН3–СН2ОН
этилен этиловый спирт
1. Щелочной гидролиз галогенопроизводных алканов – общий способ введения гидроксильной группы в органическую молекулу:
СН3–СН2CI + NаОН ® СН3–СН2ОН + NaCI
хлористый (вод. р-р) этанол
этил
4. Восстановление альдегидов и кетонов. При этом из альдегидов образуются первичные спирты, из кетонов – вторичные:
|
|
|
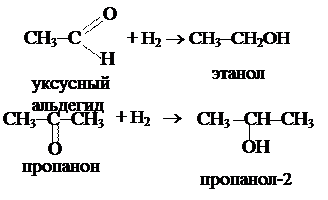 |
Физические свойства
Низшие гомологи спиртов - бесцветные жидкости с характерным запахом, растворимые в воде, средние (до С11) – жидкости, высшие спирты – твердые вещества, не растворимые в воде.
Температура кипения спиртов выше, чем у соответствующих углеводородов. Так, метан – газ, кипит при Ткип=162оС, метиловый спирт – жидкость, Ткип=64,7оС. Это объясняется тем, что молекулы спиртов, так же как молекулы воды, ассоциированы между собой за счет водородных связей.

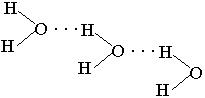
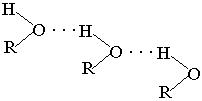
Водородная связь – это вид связи, которая образуется в результате донорно-акцепторного взаимодействия подвижного атома водорода (акцептора) с неподеленной парой электронов атома кислорода (донора).
Химические свойства
Одноатомные спирты по своему характеру соединения нейтральные, их растворы не проводят электрический ток. Но атом водорода в гидроксильной группе обладает определенной подвижностью и способен к замещению.
1. Образование алкоголятов (замещение атома водорода на щелочной металл):
2 СН3–СН2ОН + 2 Nа ® 2 СН3–СН2ОNа + Н2↑
этиловый этилат натрия
|
|
|
спирт
2. Образование эфиров:
а) образование простых эфиров (межмолекулярная дегидра-тация):
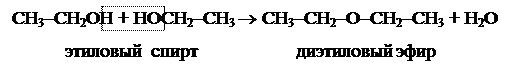
б) образование сложных эфиров (реакция этерификации):
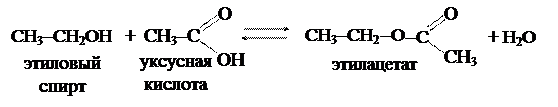 |
Обратная реакция называется реакцией омыления.
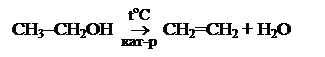 3. Дегидратация спиртов (внутримолекулярная дегидратация):
3. Дегидратация спиртов (внутримолекулярная дегидратация):
4. Реакция замещения ОН-группы:
СН3–СН2ОН + НBr ® СН3–СН2Вr + Н2О
этанол бромэтан
5. Реакция окисления:
Первичные спирты окисляются с образованием альдегидов, вторичные – с образованием кетонов. Третичные спирты окисляются в более жестких условиях с разрывом углеродной цепи.

Важнейшие представители и их применение
Метиловый спирт (метанол) – бесцветная жидкость со спиртовым запахом, растворимая в воде, ядовита (80 мл метанола – смертельная доза). Метиловый спирт применяется в качестве растворителя, как горючее, для получения формальдегида, пластмасс, лекарственных препаратов.
Этиловый спирт (этанол, винный спирт) – жидкость с характерным запахом, жгучая на вкус. Спиртректификат содержит 4% воды, т.е. 96%. Промышленное значение этанола очень велико. Он применяется в медицине, пищевой промышленности, парфюмерии, как растворитель, для получения синтетического каучука, лаков, красок и т.д.
|
|
|
Пропиловые и бутиловые спирты входят в состав «сивушных масел», применяются в качестве растворителей и в органическом синтезе.
Непредельные спирты
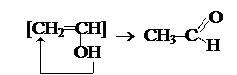 Виниловый спирт – неустойчив, т.к. содержит –ОН группу при двойной связи (правило Эльтекова), легко изомеризуется в уксусный альдегид:
Виниловый спирт – неустойчив, т.к. содержит –ОН группу при двойной связи (правило Эльтекова), легко изомеризуется в уксусный альдегид:
Простые и сложные эфиры винилового спирта применяются в производстве пластмасс.
Аллиловый спирт – устойчив, применяется в производстве глицерина, пластмасс, душистых веществ, проявляет свойства, характерные для спиртов и двойной связи. Например:
СН2=СН–СН2ОН + Вr2 ® СН2Br–СНBr–СН2ОН
аллиловый спирт 2,3-дибромпропанол-1
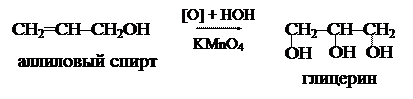 |
Высшие спирты входят в состав эфирных масел: гераниол выделяют из герани, фарнезол – из липы, цитронеллол – из розового масла.
Ароматические спирты
Наиболее важным из ароматических спиртов является бензиловый спирт (С6Н5–СН2–ОН). Он применяется в парфюмерии.
Многоатомные спирты
Двухатомные спирты (гликоли, диолы) содержат две гидроксильные группы. Наиболее часто встречаются и применяются 1,2-диолы.
 |
Получают гликоли окислением алкенов по Вагнеру. Двухатомные спирты проявляют свойства одноатомных. С участием одной гидроксильной группы образуются неполные производные, с участием двух – полные:
2НО–СН2–СН2–ОН + 2Nа ® 2НО–СН2–СН2–ОNа + Н2↑
неполный алкоголят
НО–СН2–СН2–ОН + 2Nа ® NаО–СН2–СН2–ОNа + Н2↑
полный алкоголят
Важным продуктом химической промышленности является циклический эфир этиленгликоля – диоксан.
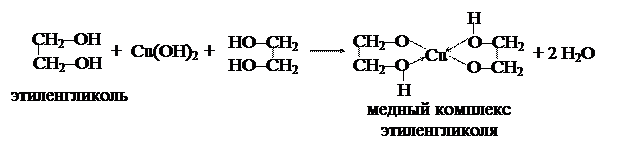 В молекулах двухатомных спиртов атомы водорода более подвижны, чем у одноатомных, поэтому гликоли обладают кислотными свойствами и образуют комплексные соединения с гидроксидами тяжелых металлов:
В молекулах двухатомных спиртов атомы водорода более подвижны, чем у одноатомных, поэтому гликоли обладают кислотными свойствами и образуют комплексные соединения с гидроксидами тяжелых металлов:
Этиленгликоль – вязкая, сладкая на вкус, ядовитая жидкость. Он применяется в технике для приготовления антифризов, используемых для охлаждения автомобильных и авиационных двигателей, а также для получения синтетического волокна «лавсана».
Трехатомные спирты (триолы, глицерины).Важнейшим представителем трехатомных спиртов является глицерин (пропантриол-1, 2, 3):
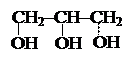 |
Это сиропообразная, сладкая на вкус, не ядовитая жидкость, растворимая в воде. Пары его ядовиты. Глицерин имеет важное биологическое значение, т.к. входит в состав липидов. Применяется в пищевой промышленности для приготовления ликеров и безалкогольных напитков, в бумажной и кожевенной промышленности для предохранения материалов от высыхания, а также в медицине, косметологии и в производстве взрывчатых веществ.
 |
Динамит – инфузорная земля (или асбест), пропитанная тринитроглицерином. Открытие взрывчатых свойств динамитов принадлежит А. Нобелю.
|
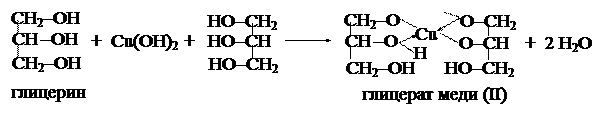 |
Пятиатомный спирт ксилит НОСН2–(СНОН)3–СН2ОН и шестиатомный спирт сорбит НОСН2–(СНОН)4–СН2ОН распространены в природе и применяются в медицине и пищевой промышленности в качестве заменителей сахара.
Фенолы
Фенолы (оксибензолы) – производные ароматических углеводородов, в молекулах которых атомы водорода при углероде ароматического кольца замещены на гидроксильную группу. Различают одноатомные, двухатомные и трехатомные фенолы.
Одноатомные фенолы
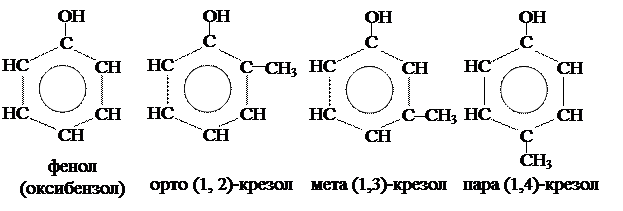 |
Способы получения
1. Фракционирование каменноугольной смолы.
2. Сплавление солей сульфокислот со щелочами:
С6Н5SO3Na + NaOH ® C6H5OH + Na2SO3
натриевая соль фенол
бензолсульфокислоты
3. 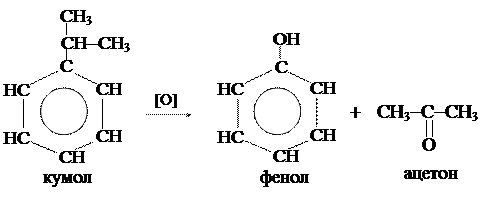 Окисление кумола (изопропилбензола):
Окисление кумола (изопропилбензола):
Физические свойства
Фенолы – кристаллические вещества с характерным резким запахом, низшие гомологи растворимы в воде, ядовиты, обладают антисептическим действием.
Химические свойства
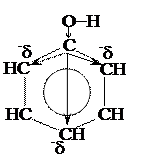 В молекуле фенола наблюдается взаимное влияние гидроксильной группы и ароматического кольца друг на друга. Под влиянием бензольного кольца увеличивается подвижность атома водорода в гидроксильной группе, т.е. усиливаются кислотные свойства. Под влиянием гидроксильной группы за счет оттягивания электронной пары атома кислорода к бензольному кольцу (положительный мезомерный эффект) происходит увеличениие электронной плотности ароматического кольца в орто- и пара-положениях и повышается его реакционная способность в реакциях замещения.
В молекуле фенола наблюдается взаимное влияние гидроксильной группы и ароматического кольца друг на друга. Под влиянием бензольного кольца увеличивается подвижность атома водорода в гидроксильной группе, т.е. усиливаются кислотные свойства. Под влиянием гидроксильной группы за счет оттягивания электронной пары атома кислорода к бензольному кольцу (положительный мезомерный эффект) происходит увеличениие электронной плотности ароматического кольца в орто- и пара-положениях и повышается его реакционная способность в реакциях замещения.
1. Взаимодействие со щелочами (в отличие от спиртов) с образованием фенолятов:
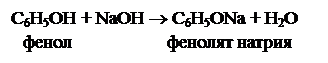
2. Реакции замещения (происходят в орто- и пара-положение).
 а) бромирование:
а) бромирование:
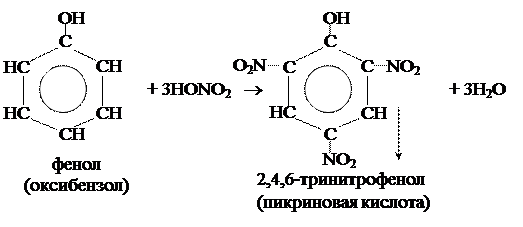 б) нитрование:
б) нитрование:
4. Реакция этерификации:
С6Н5ОН + СН3СООН ® С6Н5ОСОСН3 + Н2О
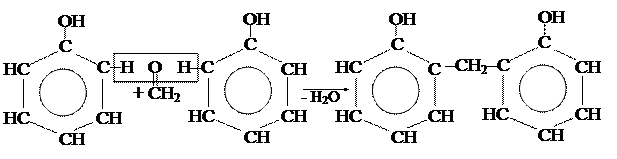 4. Конденсация с формальдегидом с образованием фенолформальдегидных смол:
4. Конденсация с формальдегидом с образованием фенолформальдегидных смол:
Дата добавления: 2022-06-11; просмотров: 98; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
