Результаты титрования (и исходные данные)
Зачетная лабораторная работа по дисциплине
«Аналитическая химия»
«Установление точной концентрации ≈4 М раствора тиосульфата натрия»
Выполнила: Студентка группы 0482 Юдакова А.С.
Проверила: к.х.н., доцент ОХИ ИШПР Воронова О.А.
Цель работы: Установить точную концентрацию раствора тиосульфата натрия по стандартному раствору 0,05 н K2Cr2O7.
Теоретическая часть:
Обоснование метода
· Метод по типу химической реакции – окислительно-восстановительное титрование;
· Прием титрования – заместительное титрование;
· Титрант – 0,05 н раствор K2Cr2O7;
· Уравнения реакций:
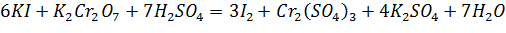 ;
;
 .
.
· Условия проведения – 1) В бюретку заливается определяемый раствор тиосульфата, т.к. используется метод заместительного титрования, и в ходе реакции в колбе образуется йод, для титрования которого (и более точного фиксирования конечной точки титрования) используется р-р тиосульфата, а в колбу по мере протекания процесса титрования добавляют индикатор; 2) После приготовления раствора в мерной колбе, его убирают в темный шкаф на 3-5 минут для завершения реакции, накрыв колбу часовым стеклом во избежание потерь от улетучивания йода.
Обоснование выбора индикатора
· Способ фиксирования к.т.т: а) без индикатора – окраска титруемого раствора из темно-бурой становится светло-желтой; б) с индикатором – добавляется крахмал, в присутствии которого синий раствор изменяет окраску на бледно-зеленую, что свидетельствует о присутствии ионов Cr3+.
|
|
|
· Индикатор – крахмал. Добавляется после изменения цвета раствора с темно-бурого на светло-желтый (для более точного фиксирования к.т.т.).
Пробоподготовка
· Обоснование необходимости разбавления – определяемый раствор тиосульфата необходимо разбавить до концентрации, примерно равной концентрации титранта, т.к. если тиосульфат не разбавлять, при титровании будет уходить небольшое его количество, что вызывает трудности в фиксировании к.т.т.
· Расчет для разбавления ведется по формуле:

Объем колбы принимаем равным 100 мл, тогда:
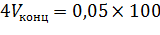
Откуда 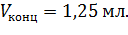
· Описание разбавления: рассчитанный объем концентрированного раствора тиосульфата необходимо отмерить пипеткой и смешать с небольшим количеством дистиллированной воды в мерной колбе объемом 100 мл. Затем раствор тщательно перемешать и довести объем раствора в колбе до метки дистиллированной водой.
Экспериментальная часть
Методика титрования
В коническую колбу для титрования (предварительно промытую дистиллированной водой) налить пипеткой (предварительно промытой дистиллированной водой) 10 мл 10%-ного раствора йодида калия и мерным цилиндром 20 мл 2 н раствора серной кислоты. К полученной смеси пипеткой прибавить 10 мл 0,05 н раствора дихромата калия и убрать колбу в темный шкаф, накрыв часовым стеклом (пояснение в п.1 «Условия проведения»);
|
|
|
Бюретку дважды промыть дистиллированной водой и один раз – рабочим раствором тиосульфата, наполнить разбавленным раствором тиосульфата натрия и установить уровень жидкости на нуле по нижнему мениску.
Приливать р-р тиосульфата по каплям до изменения окраски раствора в колбе с темно-бурой на светло-желтую, затем добавить в колбу 20 капель раствора крахмала (раствор окрашивается в синий цвет) и продолжить титровать до появления устойчивой светло-зеленой окраски раствора при добавлении одной капли тиосульфата;
Титрование проводить до получения трех воспроизводимых результатов, каждый раз промывая колбу для титрования дистиллированной водой для удаления остатков раствора.
Результаты титрования (и исходные данные)
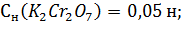

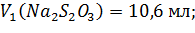
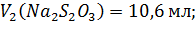

Расчеты
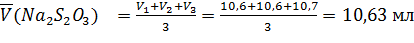 ;
;
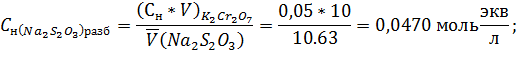
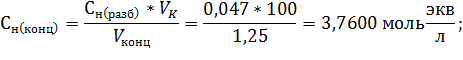

Вывод: в ходе проделанной работы методом заместительного титрования был стандартизирован раствор тиосульфата натрия, концентрация которого составила 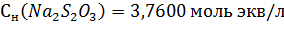 , или же
, или же 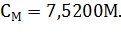
Дата добавления: 2022-06-11; просмотров: 21; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
