Балла (без уравнивания – 1 балл, схема без участия азотной кислоты – 0 баллов).
Задача №9-1
1. Исходя из описания физических и химических свойств простых веществ, несложно догадаться, что речь идет о неметаллах третьего периода ПСХЭ:
Х = S (сера), Y = Cl (хлор), Z = Р (фосфор).
В периоде ПСХЭ радиусы атомов увеличиваются справа налево, т.е. в ряду
Cl ® S ® P.
2. Сера и фосфор имеют несколько аллотропных модификаций, хлор же способен существовать лишь в виде молекулы Cl 2, представляющей желто-зеленый газ В. Тогда можно рассчитать молярные массы простых веществ серы и фосфора.
М(А) = 71´3.6056 = 256 г/моль, что соответствует ромбической сере S 8 - порошку лимонно-желтого цвета.
М(С) = 71´1.7465 = 124 г/моль, что соответствует белому фосфору Р4 - воскообразному веществу белого цвета с желтоватым отливом.
Таким образом, А - S 8 В - Cl 2 С - P 4
(на данном этапе задачи указание индексов для молекул всех простых веществ является обязательным)
Реакция 1: 3S8 + 48KOH = 16K2S + 8K2SO3 + 24H2O
или 3S + 6KOH = 2K2S + K2SO3 + 3H2O
Реакция 2: 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (при нагревании)
Реакция 3: P4 + 3KOH + 3H2O = PH3↑ + 3KH2PO2
Бесцветный ядовитый газ, выделяющийся в последней реакции - фосфин РН3.
3. В реакции 3 образуется соль фосфорноватистой кислоты Н3РО2 (кислота D).
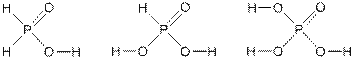
При взаимодействии фосфора с хлором могут образоваться хлориды фосфора (III) и (V), которые при обработке щелочью гидролизуются с образованием солей фосфористой (Н3РО3, кислота Е) и фосфорной (Н3РО4, кислота F) кислот.
|
|
|
Реакция 4: P4 + 6Cl2 = 4PCl3 (или 2P + 3Cl2 = 2PCl3)
Реакция 5: P4 + 10Cl2 = 4PCl5 (или 2P + 5Cl2 = 2PCl5)
Реакция 6: PCl3 + 5KOH = K2HPO3 + 3KCl + 2H2O
Реакция 7: PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
Структурные формулы кислот:
4. При взаимодействии серы с фосфором могут образоваться различные сульфиды фосфора. Определим брутто-формулу соединения G состава PxSy, воспользовавшись данными о массовой доле серы (более тяжелого элемента в сравнении с фосфором).
x : y = 56.36/31 : 43.64/32 = 1.818 : 1.364 = 1.333 : 1 = 4 : 3
Таким образом, соединение G - P 4 S 3
Продуктом реакции 2, используемым в производстве спичек, является бертолетова соль (хлорат калия) KClO3. При поджигании спички протекает реакция:
3P4S3 + 16KClO3 = 6P2O5 + 9SO2 + 16KCl
Разбалловка
| № | Элемент ответа | Баллы |
| 1. | Символы элементов X , Y , Z Правильный порядок увеличения радиусов | 3×0.5 = 1.5 б 1 б |
| 2 | Формулы веществ А, В, С Уравнения реакций 1-3 | 3×0.5 = 1.5 б 3×0.5 = 1.5 б |
| 3. | Структурные формулы кислот D - F Уравнения реакций 4-7 | 3×0.5 = 1.5 б 4×0.5 = 2 б |
| 4. | Формула вещества G Уравнение реакции | 0.5 б 0.5 б |
| Итого | 10 баллов |
Задача №9-2
Под описание простого вещества подходит сера:
| A – | сера, S | |||
| Б – | диоксид серы, SO2
| |||
| S + O2 = SO2 | (реакция 1) | |||
При пропускании избытка сернистого ангидрида через раствор щелочи должна получаться кислая соль NaHSO3 (В), что подтверждается расчетами:
ω (Na) = 22,11% => M(соли) = 104·x, где x – количество катионов Na+.
Для x=1 масса остатка 81 г/моль соответствует аниону HSO3-)
| SO2 + NaOH = NaHSO3 | (реакция 2) |
При взаимодействии кислой соли с гидроксидом натрия образуется средняя соль Г (сульфит натрия – Na2SO3).
| NaHSO3 + NaOH = Na2SO3 | (реакция 3) |
Можно предположить, что при взаимодействии сульфита натрия с серой в анион вводятся атомы серы.
ω (Na) = 29,11% => M(соли) = 79·x, где x – количество катионов Na+.
Поскольку ранее кислая соль была нейтрализована гидроксидом, то в её сотаве должно быть два катиона натрия, а масса должна составить 158 г/моль, где 112 г/моль приходится на кислотный остаток. Остаток, соответствующий сульфит аниону (80 г/моль) остался в составе, значит на неизвестную часть приходится ещё 32 г/моль, что соответствует введению одного атома серы в состав аниона:
Следовательно, вещество Д – тиосульфат натрия Na2S2O3.
| Na2SO3 + S = Na2S2O3 | (реакция 4) |
Фиксирование фотопленок основано на реакции:
| 2 Na2S2O3 + AgBr = Na3[Ag(S2O3)2] | (реакция 5) |
А количественное определение йода – на процессе:
|
|
|
| 2 Na2S2O3 + I2 = Na2S4O6 + 2NaI | (реакция 6) |
Разбалловка
| Написание формул веществ A–Д | 5х0,8 б. = 4 б. |
| Написание уравнений реакций 1–4, 6 | 5х0,8 б. = 4 б. |
| Написание уравнений реакции 5 | 2 б. |
| ИТОГО | 10 б. |
Задача №9-3
1) Из описания можно сделать вывод, что А – медный купорос CuSO 4 ·5 H 2 O, он имеет голубой цвет, при умеренном нагревании отщепляет 5 молекул воды (36% массы), при более сильном нагревании образует черный оксид CuO
Соль Б – нитрат магния Mg ( NO 3 )2. Магний входит в состав хлорофилла, при разложении образуется бурый оксид NO2, который диспропорционирует в воде.
2) Уравнения реакций:
[1 и 2]: CuSO4·5H2O = CuO + SO2 + 0.5O2 + 5H2O
2Mg(NO3)2 = 2MgO + 4NO2 + O2
[3 и 4]: SO2 + 2KOH = K2SO3 + H2O
4NO2 + O2 + 4KOH = 4KNO3 + 2H2O
[5]: K2SO3 + Sr(NO3)2 = SrSO3↓ + 2KNO3
3) n(CuSO4·5H2O) = n(SO2) = n(K2SO3) = n(SrSO3) = 12.6/168 = 0.075 моль
m(CuSO4·5H2O) = n×M = 0.075×250 = 18.75 г
n(CuO) = n(CuSO4·5H2O) = 0.075 моль
m(CuO) = n×M = 0.075×80 = 6 г
m(MgO) = 8 – 6 = 2 г
n(Mg(NO3)2) = n(MgO) = m/М = 2/40 = 0.05 моль
m(Mg(NO3)2) = n×M = 0.05×148 = 7.4 г
m(смеси солей) = 18.75 + 7.4 = 26.15 г
ω(CuSO4·5H2O) = 18.75 / 26.15 = 71.7%
ω(Mg(NO3)2) = 28.3%
Разбалловка
| 1 | Формулы солей А и Б | 1+1 = 2 б |
| 2 | Уравнения реакций 1−5 | 1×5 = 5 б |
| 3 | Массы солей А и Б Массовые доли солей А и Б | 1+1 = 2 б 0.5+0.5 = 1 б |
| Итого: | 10 б |
|
|
|
Задача №9-4
1) Поскольку кислород содержится в составе сульфат-иона и воды, то можно составить следующее уравнение для нахождения количества кислорода, который входит в состав воды:


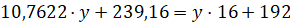
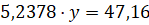
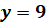
Таким образом необходимый кристаллогидрат имеет формулу Fe 2 ( SO 4 )3·9 H 2 O и называется нонагидрат сульфата железа (III).
2) Железо окисляется до степени окисления +3, связываясь в сульфат избытком серной кислоты. Азотная же кислота, судя по описанию, восстанавливается до оксида азота (IV). Окисление протекает согласно уравнению реакции:
| [1] 2FeSO4 + H2SO4 + 2HNO3 = Fe2(SO4)3 + 2NO2 + 2H2O |
3) Раствор кипятят для испарения и разложения избытка азотной кислоты. Разложение протекает по реакции:
| [2] 4HNO3 = 4NO2 + O2 + 2H2O |

4) В реакционную систему было введено:
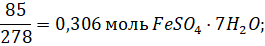
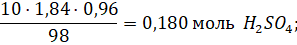
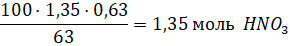
Из стехиометрии видно, что лимитирующим реагентом является сульфат железа (II), поэтому при расчете выхода следует ориентироваться на него, и в теории можно было получить 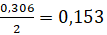 моль нонагидрата сульфата железа (III). Реально образовалось
моль нонагидрата сульфата железа (III). Реально образовалось 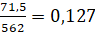 моль целевого продукта. Следовательно, практический выход процесса равен
моль целевого продукта. Следовательно, практический выход процесса равен 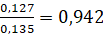 или 94.2%.
или 94.2%.
5) В ходе анализа протекают следующие реакции:
[3] Fe2(SO4)3 + 6NaI = 2FeI2 + I2 + 3Na2SO4 (допустимо написание в продуктах FeSO4)
[4] I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
По условию, на титрование ушло тиосульфата:
n(Na2S2O3) = C×V = 0.5×0.012 = 0.006 моль
Поскольку n(Na2S2O3) = 2n(I2), а n(I2) = 0.5n(Fe3+), то n(Na2S2O3) = n(Fe3+).
Тогда, С(Fe3+) = n/V = 0.006/0.01 = 0.6 моль/л
Разбалловка
| 1 | Расчет количества воды в кристаллогидрате, полное название кристаллогидрата | 2×1 б = 2 б |
| 2 | Написание уравнения [1] | 1 б |
| 3 | Написание уравнения [2], краткое пояснение необходимости кипячения | 2×1 б = 2 б |
| 4 | Расчет практического выхода соли | 2 б |
| 5 | Уравнения реакций [3] и [4] Расчет концентрации Fe3+ | 2×1 б = 2 б 1 б |
| ИТОГО | 10 б |
Задача №9-5
1. 2,0 л идеального газа при нормальных условиях содержат 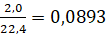 моль молекул. Значит, при сгорании 1 моль метана выделится
моль молекул. Значит, при сгорании 1 моль метана выделится  кДж теплоты, а в случае такого же количества водорода –
кДж теплоты, а в случае такого же количества водорода –  кДж. Термохимические уравнения выглядят следующим образом:
кДж. Термохимические уравнения выглядят следующим образом:
| CH4 + 2 O2 = CO2 + 2 H2O(г) + 802 кДж | (реакция 1) |
| H2 + ½ O2 = H2O(г) + 242 кДж | (реакция 2) |
2. При термолизе метан разлагается на простые вещества:
CH4 = C + 2 H2
Взяли 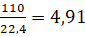 моль метана. Пусть разложилось x моль углеводорода с образованием 2·x водорода, тогда осталось (4,91–x) моль CH4.
моль метана. Пусть разложилось x моль углеводорода с образованием 2·x водорода, тогда осталось (4,91–x) моль CH4.
Углерод в виде сажи осядет на стенках сосуда, а в газовой фазе останутся лишь водород и метан. Поскольку сожгли половину образовавшейся смеси, тепловой баланс запишется в виде:
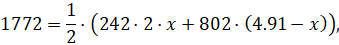
Откуда x = n(CH4)разл = 1,24 моль.
M(H2) = 2 г/моль, M(CH4) = 16 г/моль, тогда
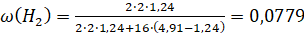 или 7,79%.
или 7,79%.
3. Из уравнения CH4 + 2 O2 = CO2 + 2 H2O(г) + 802 кДж
согласно следствию закона Гесса
Q = 2Qобр(H2O) + Qобр(CO2) ‒ Qобр(CH4)
Из уравнения H2 + ½ O2 = H2O(г) + 242 кДж следует, что
Qобр(H2O) = 242 кДж/моль, поэтому получим уравнение
802 = 2×242 + 393 ‒ Qобр(CH4), откуда
Qобр(CH4) = 75 кДж/моль
4. Уравнение каталитической конверсии метана:
CH4 + H2O(г) = CO + 3H2
Из предыдущих пунктов решения нам известны теплоты образования метана и водяного пара, следовательно, теплота образования угарного газа Qобр(CO) = 110 кДж/моль.
По следствию из закона Гесса тепловой эффект конверсии:
Q = Qобр(CO) ‒ Qобр(H2O(г)) ‒ Qобр(CH4) = 110 ‒ 242 ‒ 75 = ‒207 кДж
Разбалловка
| 1 | Написание термохимических уравнений 1,2 | 2×1 б = 2 б |
| 2 | Количество моль разложившегося метана Массовая доля водорода в газовой смеси | 2 б 1 б |
| 3 | Теплота образования метана | 2 б |
| 4 | Уравнение реакции конверсии метана Тепловой эффект реакции конверсии | 1 б 2 б |
| ИТОГО | 10 б |
Задания 10 класса
Представлен один из возможных вариантов решения заданий
Задача №10-1
1. Исходя из описания физических и химических свойств простых веществ, несложно догадаться, что речь идет о неметаллах третьего периода ПСХЭ:
Х = S (сера), Y = Cl (хлор), Z = Р (фосфор).
В периоде ПСХЭ радиусы атомов увеличиваются справа налево, т.е. в ряду
Cl ® S ® P.
2. Сера и фосфор имеют несколько аллотропных модификаций, хлор же способен существовать лишь в виде молекулы Cl 2, представляющей желто-зеленый газ В. Тогда можно рассчитать молярные массы простых веществ серы и фосфора.
М(А) = 71´3.6056 = 256 г/моль, что соответствует ромбической сере S 8 - порошку лимонно-желтого цвета.
М(С) = 71´1.7465 = 124 г/моль, что соответствует белому фосфору Р4 - воскообразному веществу белого цвета с желтоватым отливом.
Таким образом, А - S 8 В - Cl 2 С - P 4
(на данном этапе задачи указание индексов для молекул всех простых веществ является обязательным)
Реакция 1: 3S8 + 48KOH = 16K2S + 8K2SO3 + 24H2O
или 3S + 6KOH = 2K2S + K2SO3 + 3H2O
Реакция 2: 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (при нагревании)
Реакция 3: P4 + 3KOH + 3H2O = PH3↑ + 3KH2PO2
Бесцветный ядовитый газ, выделяющийся в последней реакции - фосфин РН3.
3. В реакции 3 образуется соль фосфорноватистой кислоты Н3РО2 (кислота D).
При взаимодействии фосфора с хлором могут образоваться хлориды фосфора (III) и (V), которые при обработке щелочью гидролизуются с образованием солей фосфористой (Н3РО3, кислота Е) и фосфорной (Н3РО4, кислота F) кислот.
Реакция 4: P4 + 6Cl2 = 4PCl3 (или 2P + 3Cl2 = 2PCl3)
Реакция 5: P4 + 10Cl2 = 4PCl5 (или 2P + 5Cl2 = 2PCl5)
Реакция 6: PCl3 + 5KOH = K2HPO3 + 3KCl + 2H2O
Реакция 7: PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
Структурные формулы кислот:

4. При взаимодействии серы с фосфором могут образоваться различные сульфиды фосфора. Определим брутто-формулу соединения G состава PxSy, воспользовавшись данными о массовой доле серы (более тяжелого элемента в сравнении с фосфором).
x : y = 56.36/31 : 43.64/32 = 1.818 : 1.364 = 1.333 : 1 = 4 : 3
Таким образом, соединение G - P 4 S 3
Продуктом реакции 2, используемым в производстве спичек, является бертолетова соль (хлорат калия) KClO3. При поджигании спички протекает реакция:
3P4S3 + 16KClO3 = 6P2O5 + 9SO2 + 16KCl
Разбалловка
| № | Элемент ответа | Баллы |
| 1. | Символы элементов X , Y , Z Правильный порядок увеличения радиусов | 3×0.5 = 1.5 б 1 б |
| 2 | Формулы веществ А, В, С Уравнения реакций 1-3 | 3×0.5 = 1.5 б 3×0.5 = 1.5 б |
| 3. | Структурные формулы кислот D - F Уравнения реакций 4-7 | 3×0.5 = 1.5 б 4×0.5 = 2 б |
| 4. | Формула вещества G Уравнение реакции | 0.5 б 0.5 б |
| Итого | 10 баллов |
Задача №10-2
1. Молярная масса газа В составляет 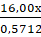 = 28,00·x г/моль, где x – число атомов кислорода в молекуле. Учитывая токсичность вещества и его способность количественно реагировать с I2O5, делаем вывод, что В – CO.
= 28,00·x г/моль, где x – число атомов кислорода в молекуле. Учитывая токсичность вещества и его способность количественно реагировать с I2O5, делаем вывод, что В – CO.
В таком случае, Б – C (углерод), и протекала реакция восстановления кислородсодержащего минерала.
Выделение газа с неприятным запахом указывает на то, что Г – сульфид. Тогда вероятно, что вещество А – сульфат. Если степень окисления металла в процессе оставалась постоянной, то
1,38 = 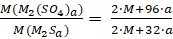 , откуда M(M) = 68·a (г/моль)
, откуда M(M) = 68·a (г/моль)
При а = 2 подходящим элементом является барий.
Минерал А в таком случае является сульфат бария BaSO4.
Таким образом, Х – барий, А – барит (тяжелый шпат) BaSO4
2. Буквами зашифрованы следующие вещества:
Б – углерод С;
В – CO;
Г – BaS;
Д – H2S;
E – Ba(CH3COO)2.
3. Уравнения реакций:
| BaSO4 + 4 C = BaS + 4 CO | (реакция 1) |
| 5 CO + I2O5 = 5 CO2 + I2 | (реакция 2) |
| BaS + 2 CH3COOH = Ba(CH3COO)2 + H2S | (реакция 3) |
4. При прокаливании ацетата бария протекает его разложение с образованием твердого продукта и отгонкой газообразных в условиях опыта веществ.
M (Ba(CH3COO)2) = 255 г/моль
Из уменьшения массы следует, что M(Ж) = 255 · (1–0,2274) · x = 197·x г/моль, где x – число атомов бария в формульной единице.
Массе 197 г/моль подходит карбонат бария, соответственно он является веществом Ж, а побочным продуктом реакции является ацетон.
Итак, Ж – BaCO3
Уравнение реакции:
Ba(CH3COO)2 = BaCO3 + CH3COCH3
Разбалловка
| 1 | Металл X Формула и тривиальное название минерала А | 1 б 1+0.5 б = 1,5 б |
| 2 | Формулы веществ Б–Е, | 5×0,5 б = 2,5 б |
| 3 | Уравнения реакций 1–3 | 3×1 б = 3 б |
| 4 | Формула вещества Ж (без расчетов – 0 б) Уравнение реакции | 1 б 1 б |
| ИТОГО | 10 б |
Задача №10-3
1. Начнем с определения элемента Х. Для получения простого вещества, образованного Х, используется реакция фторида с магнием
ХFn + (n/2)Mg = X + (n/2)MgF2,
где n – валентность элемента Х.
По уравнению реакции
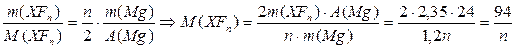
При n = 1, M(ХF) = 94 г/моль, А(Х) = 75, мышьяк
При n = 2, M(ХF2) = 47 г/моль, А(Х) = 9, бериллий
При n = 3, M(ХF3) = 31,3 г/моль, такого фторида не существует.
Таким образом, Х – бериллий, так как соединения AsF не существует.
2. Определим минерал Y. Представим его формулу в виде (BeO)x(Al2O3)y(SiO2)z, тогда:
 .
.
То есть формула минерала (BeO)3(Al2O3)1(SiO2)6 или Be3Al2Si6O18 – это минерал берилл, который используется для промышленного получения бериллия и его солей, а также в ювелирном деле в качестве драгоценных камней (изумруд – берилл с примесями железа, хрома и ванадия; аквамарин – берилл с примесью железа).
3. Формулы веществ:
X1 – BeO, Х 2 – Be3N2, X3 – BeCl2, X4 – Na2[Be(OH)4], X5 – BeF2
3. Уравнения реакций:
[1] 2Be + O2 = 2BeO
[2] 3Be + N2 = Be3N2
[3 или 4] BeO + 2HCl = BeCl2 + H2O
[3 или 4] Be3N2 + 8HCl = 3BeCl2 + 2NH4Cl
[5 или 6] BeO + 2NaOH + H2O = Na2[Be(OH)4]
[5 или 6] Be3N2 + 6NaOH + 6H2O = 3Na2[Be(OH)4] + 2NH3
[7] Be + F2 = BeF2
[8] BeF2 + 2NaF = Na2[BeF4]
[9] BeF2 + Mg = MgF2 + Be
Разбалловка
| 1 | Определение элемента Х с расчетом (без расчета: 0,5 б) | 1,5 б |
| 2 | Формула минерала Y Название минерала Y Применение минерала Y | 0,5 б 0,5 б 0,5 б |
| 3 | Формулы веществ Х1 – Х5 | 5×0,5 б = 2,5 |
| 4 | Уравнения реакций 1−9 | 9×0,5 б = 4,5 |
| ИТОГО | 10 б. |
Задача №10-4
1. Представим жидкий углеводород Г как CxHy, для него ω(Н) = y / (12x + y) = 0.0769, откуда x = y, что соответствует простейшей формуле СН. Учитывая, что Г вступает в реакцию бромирования в присутствии катализатора, можно сделать вывод, что Г - бензол С6Н6.
Если при окислении А образовалась одноосновная кислота, то она будет вступать в реакцию нейтрализации по уравнению:
R-COOH + KOH = R-COOK + H2O
n(KOH) = V(р-ра)´ ω(КОН) / М(КОН) = 11.2´0.05 / 56 = 0.01 моль
Тогда n(R-COOH) = n(KOH) = 0.01 моль
М(R-COOH) = 1.22 / 0.01 = 122 г/моль
М(R) = 122 - M(COOH) = 122 - 45 = 77 г/моль, что соответствует R = C6H5 и подтверждает ранее сделанные выводы о веществе Г.
Таким образом, Б - бензойная кислота С6Н5СООН, а В - бензоат калия С6Н5СООК, при сплавлении которого с твердым КОН происходит декарбоксилирование с образованием бензола.
Бромирование бензола в присутствии катализатора приводит к образованию Д - бромбензола С6Н5 Br, взаимодействие которого с бромэтаном в присутствии натрия дает Е - этилбензол С6Н5 - С2Н5.
Бромирование этилбензола при облучении идет по боковой цепи с образованием вещества Ж - 1-бром-1-фенилэтана С6Н5 - С HBrCH 3, дегидрогалогенирование которого спиртовым раствором щелочи приводит к образованию двойной связи и образованию вещества А - стирола С6Н5 - СН=СН2.
Тогда полимер Х, из которого изготовлены корпуса ручек - полистирол.
Таким образом,
Х - полистирол
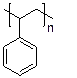
А - стирол С6Н5 - СН=СН2
Б - бензойная кислота С6Н5СООН
В - бензоат калия С6Н5СООК
Г - бензол С6Н6
Д - бромбензол С6Н5 Br
Е - этилбензол С6Н5 - С2Н5
Ж - 1-бром-1-фенилэтан С6Н5 - С HBrCH 3
(названия приводить необязательно)
2. Уравнения реакций:


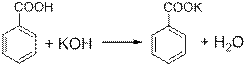
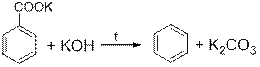
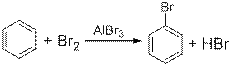

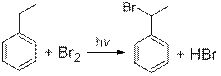
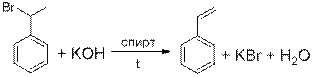
(поскольку в реакциях не затрагивается бензольное кольцо, допускается вместо рисования кольца писать C6H5)
3. По условию требуется получить
n(C6H5COOH) = 61 / 122 = 0.5 моль
Исходя из приведенного выше уравнения реакции,
n(стирола) = n(C6H5COOH) = 0.5 моль
m(стирола) = 0.5´104 = 52 г, следовательно, требуется деполимеризовать такую же массу полистрирола.
Для этого потребуется корпусов ручек
N (ручек) = 52 / 5.2 = 10 штук
Разбалловка
| № | Элемент ответа | Баллы |
| 1. | Структурные формулы веществ Х и А – Ж | 8×0.5 = 4 б |
| 2 | Уравнения реакций 1 - 8 | 8×0.5 = 4 б |
| 3. | Расчет количества ручек | 2 б |
| Итого | 10 баллов |
Задача №10-5
1. Обозначим формулу углеводорода Х как СхНy. Тогда схема сгорания будет иметь вид: СхНy → хCO2 + y/2H2O
При температуре 68.25°С (341.25К) молярный объем газа будет равен
Vm = 22.4×341.25/273 = 28 л/моль
n(CO2) = V / Vm = 8.4 / 28 = 0.3 моль, n(C) = n(CO2) = 0.3 моль
n(H2O) = m / M = 7.2 / 18 = 0.4 моль, n(H) = 2n(H2O) = 0.8 моль
х : y = n(C) : n(H) = 0.3 : 0.8 = 3 : 8
Получаем, что углеводород Х – С3Н8
Тогда, вещество Y - пропен С3Н6
Структурные формулы веществ Х и Y: 
Уравнение реакции дегидрирования:
С3Н8 ↔ С3Н6 + Н2
2. Исходное количество пропана n = 4.4/44 = 0.1 моль
При 200°С (473K): n(С3Н8) = 0.08 моль, n(С3Н6) = n(Н2) = 0.02 моль
р(С3Н8) = nRT/V = 0.08*8.31*473/1 = 314.5 кПа = 3.145 бар
р(С3Н6) = р(Н2) = 0.02*8.31*473 = 78.6 кПа = 0.786 бар
При 300°С (573K): n(С3Н8) = 0.01 моль, n(С3Н6) = n(Н2) = 0.09 моль
р(С3Н8) = nRT/V = 0.01*8.31*573 = 47.62 кПа = 0.476 бар
р(С3Н6) = р(Н2) = 0.09*8.31*573 = 428.55 кПа = 4.286 бар
3. Кр(473) = 0.786*0.786 / 3.145 = 0.196
Кр(573) = 4.286*4.286/ 0.476 = 38.59
4. Изменение энтальпии реакции можно найти по формуле:
ΔН = 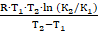
ΔН = 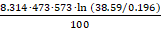 = 119035 Дж/моль = 119.035 кДж/моль
= 119035 Дж/моль = 119.035 кДж/моль
5. Из соотношения ΔrG = ΔrН − TΔrS получим:
ΔrS = (ΔrН − ΔrG) / Т
При Т = 473К ΔrG = −RTlnKp = −8.31*473ln(0.196) = 6405.5 Дж/моль
ΔrS = (119035 – 6405.5) / 473 = 238.1 Дж/(моль·К)
Разбалловка
| № | Элемент ответа | Баллы |
| 1. | Брутто-формула X Структурные формулы веществ Х и Y Уравнение реакции дегидрирования Х | 0.5 б 2×0.5 = 1 б 0.5 б |
| 2 | Состав равновесной смеси (моль) при 200°С Состав равновесной смеси (моль) при 300°С Парциальные давления всех компонентов (бар) при 200°С Парциальные давления всех компонентов (бар) при 300°С | 1 б 1 б 1 б 1 б |
| 3. | Константы равновесия Кр реакции дегидрирования | 2×1 = 2 б |
| 4. | Тепловой эффект реакции дегидрирования (ΔrН) | 1 б |
| 5. | Изменение энтропии реакции дегидрирования | 1 б |
| Итого | 10 баллов |
Задания 11 класса
Представлен один из возможных вариантов решения заданий
Задача №11-1
1. Кратчайшее расстояние соответствует половине телесной диагонали куба, следовательно, объем элементарной ячейки равен (2r/Ö3)3 » 31.18 Å3.
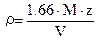 , где r – плотность кристаллического вещества, г/см3; M – молярная масса вещества, г/моль; Z – число формульных единиц, содержащихся в одной элементарной ячейке; V – объем элементарной ячейки, Å3.
, где r – плотность кристаллического вещества, г/см3; M – молярная масса вещества, г/моль; Z – число формульных единиц, содержащихся в одной элементарной ячейке; V – объем элементарной ячейки, Å3.
Для ОЦК Z = 2, следовательно, M » 95.9. M = Mo.
Балла
Описание структуры оксида говорит о том, каждый атом Mo связан с 6 атомами кислорода, причем каждый кислород “принадлежит” атому Mo на 1/2. А = MoO3.
Балл
Присутствие только тетраэдрических ионов в структуре B – указание на то, что B = (NH4)2MoO4.
Балл
Изменение степени окисления Mo в условиях описанной реакции не происходит.
Из рисунка видно, что состав аниона можно выразить формулой [Mo8O24(O2)2(H2O)2]4–.
Балл
Очевидно, что противоионами могут быть только катионы аммония. По данным о структуре можно определит M(C) = 1396 г/моль, что соответствует формуле (NH4)4[Mo8O24(O2)2(H2O)2]∙4H2O
Балла
2. 2Mo + 3O2 = 2MoO3 0.5 балла
MoO3 + 2NH3∙H2O = (NH4)2MoO4 0.5 балла
8(NH4)2MoO4 +2H2O2 + 12HNO3 = (NH4)4[Mo8O24(O2)2(H2O)2]∙4H2O + 12NH4NO3 + 2H2O
балла (без уравнивания – 1 балл, схема без участия азотной кислоты – 0 баллов).
Задача №11-2
1. Начнем с определения элемента Х. Для получения простого вещества, образованного Х, используется реакция фторида с магнием
ХFn + (n/2)Mg = X + (n/2)MgF2,
где n – валентность элемента Х.
По уравнению реакции
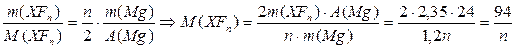
При n = 1, M(ХF) = 94 г/моль, А(Х) = 75, мышьяк
При n = 2, M(ХF2) = 47 г/моль, А(Х) = 9, бериллий
При n = 3, M(ХF3) = 31,3 г/моль, такого фторида не существует.
Таким образом, Х – бериллий, так как соединения AsF не существует.
2. Определим минерал Y. Представим его формулу в виде (BeO)x(Al2O3)y(SiO2)z, тогда:
 .
.
То есть формула минерала (BeO)3(Al2O3)1(SiO2)6 или Be3Al2Si6O18 – это минерал берилл, который используется для промышленного получения бериллия и его солей, а также в ювелирном деле в качестве драгоценных камней (изумруд – берилл с примесями железа, хрома и ванадия; аквамарин – берилл с примесью железа).
3. Формулы веществ:
X1 – BeO, Х 2 – Be3N2, X3 – BeCl2, X4 – Na2[Be(OH)4], X5 – BeF2
3. Уравнения реакций:
[1] 2Be + O2 = 2BeO
[2] 3Be + N2 = Be3N2
[3 или 4] BeO + 2HCl = BeCl2 + H2O
[3 или 4] Be3N2 + 8HCl = 3BeCl2 + 2NH4Cl
[5 или 6] BeO + 2NaOH + H2O = Na2[Be(OH)4]
[5 или 6] Be3N2 + 6NaOH + 6H2O = 3Na2[Be(OH)4] + 2NH3
[7] Be + F2 = BeF2
[8] BeF2 + 2NaF = Na2[BeF4]
[9] BeF2 + Mg = MgF2 + Be
Разбалловка
| 1 | Определение элемента Х с расчетом (без расчета: 0,5 б) | 1,5 б |
| 2 | Формула минерала Y Название минерала Y Применение минерала Y | 0,5 б 0,5 б 0,5 б |
| 3 | Формулы веществ Х1 – Х5 | 5×0,5 б = 2,5 |
| 4 | Уравнения реакций 1−9 | 9×0,5 б = 4,5 |
| ИТОГО | 10 б. |
Задача №11-3
1. Определим вещество А по массовым долям. На углерод приходится 92,26%, оставшимся элементом, вероятно, является водород из-за малой массовой доли.
| Углерод | Водород | |
| Массовая доля, % | 92,26 | 7,74 |
| Мольная доля | 7,68 | 7,74 |
| Соотношение | 1 | 1 |
Поскольку соотношение элементов равно 1:1, то можно подумать на ацетилен или иные ненасыщенные углеводороды. Однако в случае ненасыщенных связей не требуется наличие каких-либо катализаторов, а в условии протекании реакции указано присутствие бромида железа (3). Значит, исходное вещество является ароматическим и это бензол состава C6H6.
В таком случае вещества A – H имеют следующие формулы:
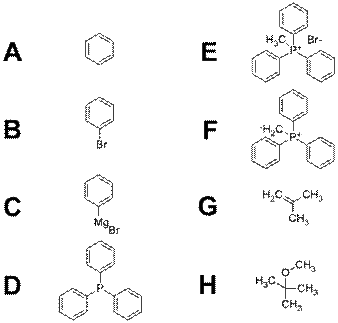
Для структуры C возможно представление в виде катиона и аниона. Для структуры F возможно представление в виде незаряженной частицы с пятивалентным атомом фосфора.
2. Вместо гидрида натрия можно использовать какое-либо иное сильное основание, например, алкиллитиевые производные (RLi), реактивы Гриньяра (RMgX), амиды (R2NNa), алкоголяты (RONa).
3. Уравнение реакции камфоры с реагентом Виттига:

Разбалловка
| 1 | Изображение структур веществ A–H | 8×1 б = 8 б |
| 2 | Два примера оснований для превращения вещества E в F | 2×0,5 б = 1 б |
| 3 | Уравнение реакции превращения камфоры под действием реагента F | 1 б |
| ИТОГО | 10 б |
Задача №11-4
1. 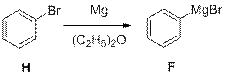 , также стоит зачесть иные галогенбензолы
, также стоит зачесть иные галогенбензолы
2. 
3. 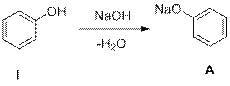
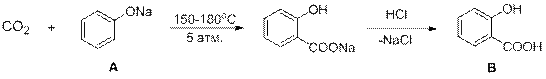
4. 
5. 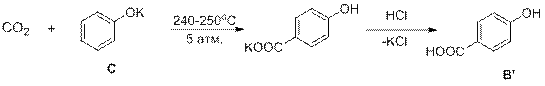
6. 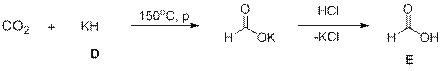
7. 
Разбалловка:
| Реакция 1 | 1б |
| Реакции 2 и 3 | 2·0,5=1б |
Реакции 4-7
(Полный балл ставят и за двухстадийную схему синтеза с указанием побочных соединений, например:

| 4·2=8б |
Задача №11-5
1) Х – СОСl2 – фосген или хлорокись углерода
Y – Fe(CO)5 – пентакарбонил железа
Фосген ранее (в Первую мировую войну) применялся как боевое отравляющее вещество.
2) 5СО + Fe = Fe(CO)5
CO + Cl2 = COCl2
3)
V= ∆c/∆t => ∆c= V⋅∆t= 2.5⋅10-3⋅5= 12.5⋅10-3 моль/л= 12.5 моль/м3
Изначально [COCl2]=0 => ∆c=[COCl2] после 5 мин
По уравнению Менделеева-Клайперона pV=nRT => p= RTn/V
p(COCl2)= ∆cRT= 12.5⋅8.314⋅403= 4.2⋅104 Па
Пусть po – исходное давление, то p(Cl2)= 0.5po
| CO | + | Cl2 | = | COCl2 | |
| ½ po | ½ po | 0 | было | ||
| ½ po - p(COCl2) | ½ po - p(COCl2) | p(COCl2) | стало |
Общее давление в сосуде после реакции
2pатм = po - p(COCl2)
2⋅105 = po – 4.2⋅104 => po = 2.4⋅105 Па
p(Cl2) = 1/2 po = 1.2 ⋅ 105 Па
С(Cl2) = р/RT = 0.0358 моль/л
4) COCl2 + H2O = CO2 + 2HCl
COCl2 + 4NaOH = Na2CO3 + 2NaCl + 2H2O
COCl2 + 4NH3 + 2Н2О = 2NH4Cl + (NH4)2CO3
Разбалловка
Дата добавления: 2022-06-11; просмотров: 13; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
