Распространенность нуклидов в природе
Лекция 3
Изотопы в природе
В 1911–1914 гг. Э. Резерфорд разработал ядерно-электронную модель атома. Н. Бор предсказал, а А. Ван Ден Брук и Г. Мозли доказали, что порядковый номер химического элемента ХЭ в периодической системе численно равен заряду ядра его атома. В результате стало очевидным: ряд химических элементов, выстроенных в порядке возрастания их атомных весов, почти идеально (за исключением «аномалий») совпал с последовательностью элементов, отвечающей монотонному увеличению Z. Оказалось, что ядро атома можно представить как сумму дискретных единиц: протонов и нейтронов А=p+n. Протон имеет положительный заряд, нейтрон не имеет его. Следовательно порядковый номер атома в периодической системе ХЭ равен количеству протонов. Масса протонов и нейтронов одинакова, поэтому А назвали массовым числом ядра атома.
Основная заслуга в открытии стабильных изотопов принадлежит английскому физику Ф. Астону. В 1919 г. он установил, что инертный газ неон (атомный вес – 20,2) является смесью двух изотопов с атомными весами 20 и 22. Это значит, что при одинаковом числе протонов, число нейтронов на оболочках ядра атома может изменятся. Ученый проводил исследования на протяжении полутора десятилетий и обнаружил 210 стабильных изотопов большинства элементов.
В последующем, ядра атомов химических элементов разного заряда и количества нейтронов стали называть нуклидами (Т. Коман 1947 г.), и термин «нуклид» получил широкое распространение.
|
|
|
Установлено, что изменение числа нейтронов на оболочке атома количественно ограничено. Известно, что если разделить массовые числа А нуклидов на 4, то получается 4 типа атомов: а) тип 4q (массовое число делится без остатка), б) тип 4q+1, в) тип 4q+2, г) тип 4q+3 [Сауков]. Исходя из того, что на оболочках ядра могут находиться 0, 1, 2, 3 нейтрона. Например, дейтерий, имеющий на оболочке ядра p + 2n.
Химические элементы, как правило, представляют собой смесь изотопов, т. е. атомов с одинаковыми порядковыми номерами (зарядами), но разными массовыми числами. Наибольшее число изотопов (10) имеет олово (Z=50); у ксенона (Z=54) 9 изотопов, кадмий (Z=48) и теллур (Z=52) имеют по 8 изотопов; другие элементы имеют меньшее число изотопов. Есть элементы, у которых только один стабильный изотоп (22), и они считаются простыми. Сюда относятся F, Na, P, V, Мn, Аu и др. Технеций (Z=41) и прометий (Z=61) вообще не имеют стабильных изотопов. Совокупность изотопов элемента с определенным значением Z (если их больше одного) называют «плеядой». Распространенность отдельных изотопов в «плеяде» различна. Искусственно созданные изотопы быстро распадаются, поэтому эти химические элементы в природе отсутствуют. Нуклиды, имеющие Z < 32 называют легкими, остальные тяжелыми.
|
|
|
В мире атомных ядер обнаружилось одно удивительное явление – четные и нечетные ядра по количеству протонов и нейтронов различаются распространенностью и устойчивостью. Проф. Г. Оддо (1914) заметил, что химические элементы, принадлежащие к четным атомным числам, содержащие ядра гелия, т. е. элементы, атомная масса которых может быть разделена на 4, сильно преобладают в земной коре. Они образуют 86,5% ее общей массы. Большинство изотопов (173) имеют четные А, причем почти все из них содержат в ядрах атомов четные количества Z и N. Изотопов с нечетными Азаметно меньше (109). У элементов с четными Z не бывает больше двух изотопов c нечетными А (исключение – Аr с Z = 18 и Се с Z = 58, все их изотопы имеют четные А).
Позже аналогичные исследования были предприняты и углублены проф. В. Гаркинсом из Чикаго. Публикации вышли за период с 1917 по 1921г.г. Гаркинс доказал, что то же самое наблюдается и в метеоритах, где процентный перевес элементов с четными числами еще значительнее (табл. 1). Он доходит до 92,22% для металлических метеоритов и 97,69% для каменистых метеоритов. Метеориты — небесные тела, независимые от земли. В них наблюдается то же огромное преобладание элементов с четным зарядом ядер. Сейчас доказано, что это правило выполняется во всей видимой Вселенной. Как следствие этих исследований сформулировано правило Одда-Гаркинса: вещество по составу изотопов на Земле и космосе сходно и там и тут четные ХЭ преобладают над нечетными. В соответствии с этим правилом соотношение изотопов выдерживается очень строго и это указывает на способ образования элемента (тип реактора). Например, соотношение изотопов урана 238 и 235 равно 137,8. Это соотношение соблюдается и на Земле и на Луне и в минералах метеоритов, падающих на Землю.
|
|
|
Таблица 1 – Количество и распространенность естественных изотопов с четными и нечетными числами протонов и нейтронов в ядрах атомов и количество изотопов с массовыми числами кратными (q) четырем
| Число протонов Z | Число нейтронов N | Количество изотопов | Тип изотопа | Количество изотопов | Распространенность в хондритах |
| четное | четное | 167 | 4q | 90 | 89.6% |
| четное | нечетное | 57 | 4q + 1 | 53 | 2.9% |
| нечетное | четное | 53 | 4q + 2 | 86 | 5.5% |
| нечетное | нечетное | 9 | 4q + 3 | 57 | 2.5% |
|
|
|
Всего в настоящее время насчитывается 284 устойчивых изотопов, причем для каждого натурального числа от 1 до 209 известен стабильный атом.
Правило Маттауха или правило изобаров. Изобары – вещества, имеющие равное значение числа А, но разный заряд ядра атома. Это правило одно из наиболее фундаментальных законов мироздания аналогично закону всемирного тяготения. Правило позволяет предсказать стабильность изотопа или нестабильность. Если химические элементы являются изобарами и различаются зарядом ( Z ) на 1, а один из них устойчивый, то другой будет непременно склонен к распаду. Маттаух сформулировал принципы, позволяющие классифицировать изотопы в некоторой периодической системе.
Например, в паре изобаров 40Ar и 40К последний радиоактивен. Это правило дает возможность внести определенную ясность в некоторые особенности «изотопной статистики». Почему у элементов с Z = 43 и 61 нет стабильных изотопов? В принципе они могли бы иметь один или два устойчивых вида атомов. Однако соседние с технецием и прометием элементы (молибден и рутений, неодим и самарий соответственно) представлены в природе большим числом изотопов в широком диапазоне А. Согласно правилу изобаров, вероятные значения А для Z = 43 и 61 оказываются «запрещенными». Когда изотопы технеция и прометия были синтезированы, то выяснилось, что большинство из них характеризуются невысокой продолжительностью жизни.
Изобарные пары с изотопами соседних элементов (например, 87Pb с 87Sr, 115In c 115Sn и т. д.), но они радиоактивны в очень малой степени. Посредством различных ядерных реакций было синтезировано более 1600 искусственных изотопов в интервале Z от 1 до 112 (причем для некоторых элементов более 20). Из них стабильных изотопов всего 284.
Для «легких» представителей периодической системы при четных Z преобладают изотопы с меньшими значениями А. У последующих элементов, напротив, природа отдает предпочтение изотопам с большими значениями А. Из двух изотопов с нечетными Z более распространенным является тот, у которого А меньше. Отличие «легких» от «тяжелых» в том, что большинство стабильных легких не может иметь на оболочке ядра 3 нейтрона, а для тяжелых наоборот – это норма.
Исключительно важна проблема распространения изотопов. Решение ее стало возможным лишь в последние годы после изобретения масс-спектрометров – приборов, которые позволяют, в частности, определять соотношение изотопов. В настоящее время метод изотопных исследований получил широкое распространение, и стало возможным говорить о возникновении и развитии новой отрасли науки — геохимии изотопов. Изучение изотопного состава различных элементов показало, что он для многих элементов независимо от их происхождения в природе обладает постоянством.
Важно отметить, что был установлен один и тот же изотопный состав (в пределах достигнутой точности метода) как для элементов земного происхождения, так и для элементов метеоритов, в том числе для никеля, кремния, серы, железа, молибдена, вольфрама, олова и др. Так, для железа относительная распространенность изотопов сильно различается (табл. 2).
Таблица 2 – Относительная распространенность (%) стабильных изотопы железа
| Атомный вес изотопов | 54 | 56 | 57 | 58 |
| Весовое количество изотопов железа (в %) | ||||
| земного | 5,84 | 91,68 | 2,17 | 0,31 |
| метеоритного | 5,80 | 91,75 | 2,14 | 0,30 |
В целом же картина такова. У элементов от водорода до никеля (Z = 28) наблюдается резко повышенная распространенность какого-то одного изотопа. При больших значениях Z, хотя содержание изотопов в «плеяде» различается (иногда довольно существенно), фактор абсолютного «лидерства» уже не проявляется.
Распространенность нуклидов в природе
Окружающая природа создана из 8 ХЭ. Наиболее распространенными ХЭ являются (% масс. земной коры): кислород (47), кремний (29,5), алюминий (8,05), железо (4,65), кальций (2,96), натрий (2,5), калий (2,5) и магний (1,87). Их суммарное содержание более 99%. Следовательно, на долю остальных приходится менее 1%. Из этой «восьмерки» алюминий и натрий представлены единственным видом атомов (27А1 и 23Na); у других – один из изотопов имеет резко преобладающее содержание (16О, 28Si, 56Fe, 40Ca, 39K, 24Mg). Таким образом, перечисленные изотопы являются тем материалом, из которого фактически построена вся «земная твердь». Главными компонентами атмосферы являются изотопы 14N и 16O. Наконец, водное пространство – сочетания того же изотопа кислорода 16O с легким изотопом водорода (1Н). Водород, кислород вместе с углеродом, азотом, фосфором и серой входят во все растительные и животные организмы, в связи с чем, их выделяют в особую группу элементов – органогенов.
Таким образом, получается, что всего десять стабильных изотопов в решающей степени (по весу) обусловливают бесконечное разнообразие неорганической и органической природы.
Эти выводы имеют особо важное значение, указывая на единство состава земных и окружающих космических тел и тем самым подтверждается гипотеза об общности их происхождения всего вещества Солнечной системы. Такое постоянство отношения изотопов указывает на то, что вещество было сварено в одном котле.
Впервые таблица распространенности элементов была составлена Г. Зюссом и Г. Юри в 1956 году на основе химического состава земной коры, метеоритов и Солнца. Современные данные о распространенности нуклидов представлены на рис. 1, отражающего зависимостью содержания нуклидов от массового числа А. График завершается последними устойчивыми изотопами Pb и Bi и иллюстрирует многие особенности, отражающие характерные свойства различных процессов нуклеосинтеза. Среди наиболее заметных особенностей выделяется пик группы железа, содержание элементов в котором на 2-3 порядка выше, чем на сглаженной части. Имеются также небольшие двойные пики вблизи массовых чисел 90, 135 и 190, 210
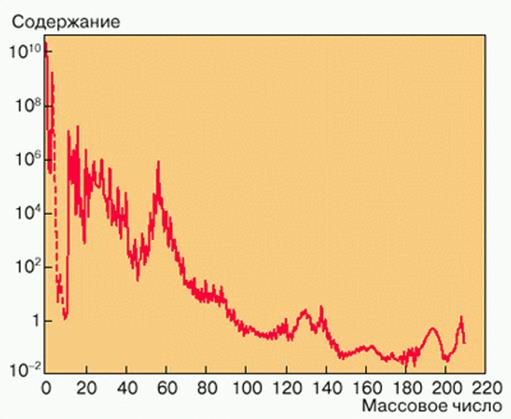
Рисунок 1. Распространенность ХЭ
В настоящее время доказано, что синтез элементов постоянно происходит в звездах, причем на разных стадиях их эволюции. Наиболее активна стадия зарождения звезды и гибели (взрыва) сверхновой.
Примерная схема:
1. 34He →12C
2. 12C + 4He →16O + γ.
3. 16O + 4He →20Ne + 
4. 14N + 4He →18F + γ, 18F →18O + e+, 18O + 4He →22Ne +  , 18O +4He →21Ne + n
, 18O +4He →21Ne + n
5. 20Ne(4He,  ) → 24Mg
) → 24Mg
6. 24Mg + р →25Al + γ.
В основе реакций ядерного синтеза лежит цикл горения 12C, 14N, 16O, 18O.
Для образования ХЭ важное значение имеет цикл «горения» 16O, в результате которого образуются 28Si, 31P, 31S, или 30Si, 24Mg, 27Al.


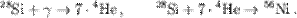
Ядра 56Ni в результате двух β- распадов превращаются в 56Fe. Горение кремния является конечной стадией термоядерного синтеза нуклидов в массивных звездах, на которой образуются ядра группы железа, обладающие максимальной удельной энергией связи. Последующий термоядерный синтез в результате присоединения легких ядер ядрами группы железа не имеет места, так как этот процесс должен протекать только с поглощением энергии.
Общепризнанной является гипотеза, объясняющая образования легких ядер (Li, Be, B) при реакции деления ядер C, N, O в результате столкновений с ядрами H и He либо в космических лучах, либо космических лучей с атомами межзвездных газовых облаков. Космические лучи – это поток заряженных частиц, содержащие ядра атомов достаточно большой массы и энергии, которые заполняют пространство Галактики. Считается, что основным источником космических лучей являются взрывы сверхновых звезд. В космических лучах содержание Li, Be, B приблизительно на пять порядков больше, чем в звездах.
В настоящий момент доказано, что источником тяжелых элементов являются взрывы сверхновых звезд. На начальном этапе развития эти звезды в 8-10 раз больше Солнца. Процессы сгорания исходного топлива при синтезе гелия проходят в 2 раза интенсивнее и при возрасте звезды ~ 4 млрд. лет все топливо выгорает и она превращается в красного гиганта. При падении температуры внутри звезды силы гравитации начинают превосходить силы расширения. Возникает сжатие до размеров солнца и взрыв. В этот момент происходит синтез тяжелых элементов.
Те или иные совокупности изотопов образуются благодаря различным ядерным реакциям. Получила достаточно удовлетворительное объяснение космическая распространенность элементов, которая заметно отличается от земной. Так, господствующими в космосе оказываются водород и гелий. Однако по мере увеличения Z это различие становится менее выраженным. «Каркас» современного изотопного состава элементов на Земле был построен многие миллиарды лет назад, а его «доводка» связана уже с процессами, происходившими на протяжении истории нашей планеты.
Природный ядерный реактор. В качестве примера такой доводки можно привести сенсационное сообщение в печати французских ученых (В 1972 г.) о том, что в урановом руднике Оккло, находящемся в государстве Габон, расположенном в Юго-Западной Африке у берегов Атлантического океана, ими обнаружен уран с крайне необычным изотопным составом (рис. 2). При этом утверждалось, что такой изотопный состав возник в результате протекавшей в этом районе около 1,8 миллиарда лет назад цепной реакции деления ядер урана. В общем, в своем сообщении французские ученые предположили, что 1,8 миллиарда лет назад в природе произошел ядерный взрыв.
В ходе цепной реакции (в том числе и приводящей к ядерному взрыву) изотопный состав урана изменяется. На рис. 2 показаны изотопные отношения урана, измеренные для руды в Оккло. Полученные значения имеют разброс до 40%, тогда как повсюду за пределами Оккло это значение остается практически постоянном (137,8), проявляя примечательную устойчивость. И необычно большие изотопные отношения урана можно объяснить, исходя из предположения о природном ядерном взрыве.
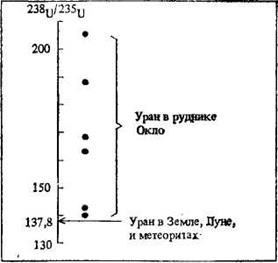
Рисунок 2. Изотопное отношение урана (U238/U235) из рудника Оккло
Следует отметить, что возможность природного ядерного взрыва в прошлом уже была предсказана к тому времени теоретически. Для того чтобы самопроизвольно началась цепная реакция, природный уран должен был быть в достаточной степени обогащен ураном-235, содержание которого в природном уране в настоящее время не превышает 0,72%. Дело в том, что сколько ни собирай вместе урана-238 (основного изотопа природного урана), цепная реакция не начнется. При распаде урана возникают быстрые нейтроны, которые, сталкиваясь с ядрами урана 235, вызывают его радиоактивный распад, а 238 их поглощает, при этом не распадаясь. Так как количества урана 238 значительно больше, чем урана 235, то цепная реакция не может возникнуть, так как все нейтроны окажутся поглощенными. Поэтому-то, для получения более эффективного горючего из природного урана для ядерных реакторов необходимо путем очень сложных и дорогостоящих операций повысить в нем концентрацию урана-235.
С другой стороны, в далеком прошлом соотношение между изотопами урана было иным. Уран-238 обладает очень длительным периодом полураспада – 4,5 миллиарда лет по сравнению с ураном-235, имеющим период полураспада 700 миллионов лет. И если мы мысленно отправимся в прошлое, то количество урана-235, имеющего более короткий период полураспада, станет быстро увеличиваться по сравнению с ураном-238. Сейчас количество урана-235 в природном уране не превышает 0,72%, а 1 миллиард лет назад оно уже должно было составлять около 2%.
Есть еще одно условие. Чтобы «разжечь» ядерное топливо, необходимо замедлить нейтроны так что, уран 238 их не сможет поглощать, а уран-235, поглощая их, распадается. Этот принцип используется в ядерных реакторах. В качестве замедлителя нейтронов в реакторах используется графит и тяжелая вода. Чтобы «заглушить» цепную реакцию, графитовые стержни выводят из реактора. Обычная вода тоже может быть использована как замедлитель нейтронов. Поэтому одним из условий, необходимым для начала цепной реакции, даже в обогащенном природном уране, является наличие воды. Правда, нигде за пределами Оккло следов подобного природного ядерного реактора не обнаружено.
Таким образом, соотношение изотопов в ЗК млрд. лет назад отличались от современного в сторону увеличения изотопов с меньшим периодом полураспада. Цепные реакции ядерного распада на Земле и окружающем космосе являются исключительным явлением и не играют заметной роли в распределении вещества в ОС. Однако, это указывает другой аспект – в природе оказывается возможно невозможное!
Однако, широко распространенные в природе U238 и U235, а также Th232 в процессе радиоактивного распада превращаются в Pb208, Pb207 и Pb206. Различное соотношение радиоактивных элементов в образце горной породы или в минерале влияет на соотношение изотопов свинца в этом же образце. Такова же схема изменения отношений изотопов при распаде К40, Rb87, образующих в процессе распада стабильные изотопы Аг40, SrS7 и Os187.
Как видим, отношения изотопов в свинце, аргоне, стронции, осмии и в ряде других элементов зависят от количества радиоактивных элементов или радиоактивных изотопов элементов, присутствующих в породе, и в разных образцах оказываются резко различными.
Разделение изотопов в природе. Стабильные изотопы подвержены гораздо меньшим колебаниям, поскольку химические и физические свойства изотопов очень близки. Все же существуют некоторые природные процессы (например, испарение воды), которые приводят к измеримому смещению отношений изотопов. При этом, чем легче элемент и чем больше разница в атомных весах его изотопов, тем скорее и глубже может пройти изотопное разделение. Значительный сдвиг изотопных отношений установлен для водорода, бора, углерода, кислорода, серы. Отношение изотопов водорода и кислорода воды, например, изменяется при испарении воды с поверхности океанов. Вода в паровой фазе заметно обогащается более легкими изотопами. Поэтому дождевые и речные воды также всегда обогащены легкими изотопами по сравнению с океаническими водами. Наибольшая концентрация легких изотопов водорода и кислорода обнаружена в полярных льдах Антарктиды.
Г. Юри установил, что равновесное содержание изотопов С = 18О/16О карбонатов и воды зависит от температуры воды.
В воде 18О/16О = 1/500, а карбонатах при 0 град. С= 1, 022/500, при 25 град. С = 1,026/500.
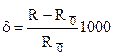 ,
,
где R = 18О/16О в исследуемом образце, R0 – в эталонном.
Четкое смещение отношения изотопов кислорода происходит при обмене изотопов между СаСО3 и водой. В равновесных условиях этот обмен зависит от температуры. Полагая, что изотопный состав океанической воды в течение геологического времени оставался постоянным, можно по изотопному составу кислорода в ископаемых известковистых раковинах рассчитать температуру воды, в которой обитало умершее животное. На этом основан палеотемпературный метод, который позволяет восстанавливать температуру древних морей с точностью, превышающей ±1°С.
Значительное разделение изотопов углерода и серы происходит в биосфере. Так, углерод органических веществ всегда обогащен легким изотопом С12 по сравнению с углеродом углекислого газа и карбонатов. Интересно, что изотопный состав углерода нефтей очень близок к составу органического углерода и практически одинаков для нефтей разного возраста, состава и местонахождения. На основе соотношения изотопов 14С и 13С производят датировки остатков живых организмов.
Радиоуглеродный метод определения абсолютного возраста (от 60-100 лет до 50-60 тыс. лет) основан на следующем
В природе встречаются несколько изотопов углерода:
• стабильные 12С (98.9%), 13С (1.1%)
• радиоактивные 14С (10-10%), который образуется постоянно в атмосфере за счет излучения Солнца. 14С в виде углекислого газа поглощается растениями в процессе фотосинтеза.
Радиоактивные изотопы 14С распадаются с образованием β–частиц, превращаясь в стабильные изотопы 13С. Соотношение 13С /14С при жизни организма поддерживается на постоянном уровне и одинаково для всех живых организмов.
• Если растение отмирает, то с этого момента происходит постоянное уменьшение в нем содержания 14С за счет его радиоактивного распада.
• Зная период полураспада 14С, можно по его количеству в растительных остатках или гумусе определить время, прошедшее с момента гибели по останкам организмов.
• Период полураспада радиоактивного изотопа 14С равен 5780 ±40 лет.
Смещение изотопного состава при сульфат редукции. Отношение изотопов серы изменяется в процессе восстановления сульфатов, которое идет обычно под влиянием сульфатредуцирующих бактерий. Сера образующегося сероводорода обогащается при этом легким изотопом, а сульфат, оставшийся невосстановленным, наоборот, обогащен тяжелым 34S. В результате постоянно идущего восстановления части сульфатов, растворенных в океанической воде, оставшийся сульфат оказывается сильно обогащенным (на 2%) тяжелым изотопом 32S по сравнению со средним изотопным составом серы земной коры. Это обогащение стабильно во всех океанах, на различных глубинах. Обогащение океанических сульфатов тяжелым изотопом серы характеризует отложения всех геологических эпох. Таким образом, сделанный выше вывод о постоянстве изотопного состава элементов разного происхождения является, по-видимому, лишь первым приближением к истине. Всего вероятнее, что дальнейшее уточнение методов исследования позволит заметить различия в изотопном составе, кроме перечисленных выше, и других элементов. Благодаря этому состав нашей планеты и других космических тел, происхождение и миграция элементов – эти важнейшие проблемы современной геохимии – получат более полное и глубокое освещение.
Дата добавления: 2022-06-11; просмотров: 31; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
