Реакция Вюрца- Гриньяра (для получения нечетных алканов)
Вывод:
Тип гибридизации sр3
Форма молекулы- тетраэдрическая
Угол между гибридными орбиталями 109028\
Расстояние между атомами углерода 0,154 нм (это в остальных алканах)
4 сигма связи
Сигма связь- это связь, образованная при перекрывании орбиталей по прямой, соединяющей центры двух атомов.
Строение молекулы этана
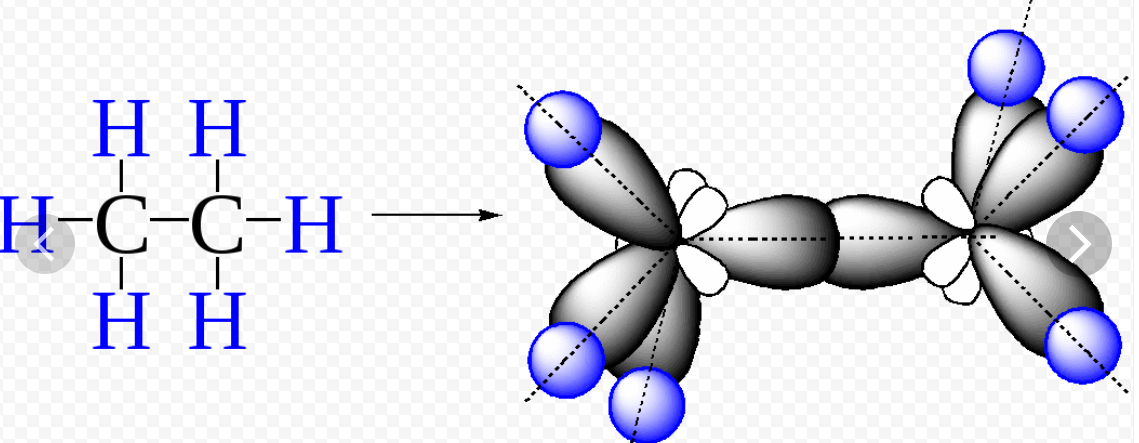
Начиная с пропана алканы имеют зигзагообразное строение: 
Физические свойства алканов

Предельные углеводороды — соединения неполярные. Они легче воды и практически нерастворимы в ней, однако, они способны растворяться в большинстве органических растворителей, в том числе и друг в друге. Жидкие алканы сами являются хорошими растворителями для многих органических веществ.
Метан и этан, а также высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит бесцветным пламенем.
Химические свойства алканов.
I . Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
|
|
|
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.

Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400оC.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
Хлорирование метана:
(hv — формула кванта света)
Механизм реакции
Реакция осуществляется в три стадии:
а) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:
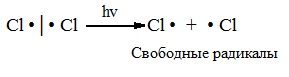
Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):

в) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
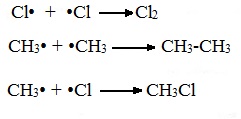
Постадийное хлорирование метана:
 Самая трудная стадия- первая, так как все 4 связи совершенно одинаковые и очень прочные. Самая легкая- последняя: три атома хлора стягивают на себя электронную плотность от атома углерода, вследствии чего на атоме углерода образуется недостаток электронной плотности и он стягивает ее от атома водорода- связь С-Н становится более слабой и легко замещаемой.
Самая трудная стадия- первая, так как все 4 связи совершенно одинаковые и очень прочные. Самая легкая- последняя: три атома хлора стягивают на себя электронную плотность от атома углерода, вследствии чего на атоме углерода образуется недостаток электронной плотности и он стягивает ее от атома водорода- связь С-Н становится более слабой и легко замещаемой.
|
|
|
Гомологи метана галогенируются, как и метан, с образованием смеси продуктов. Наиболее легко при этом замещается водород у третичного углерода, так как связь С—Н в этом случае наиболее слабая, если нет третичного, то замещается вторичный:
третичный > вторичный > первичный
2. Нитрование алканов- реакция КОНОВАЛОВА- проводится разбавленной азотной кислотой при нагревании. При нитровании алканов от С3 получается смесь изомерных нитроалканов среди которых преобладают продукты замещения у вторичных (или третичных, если есть) атомов углерода:

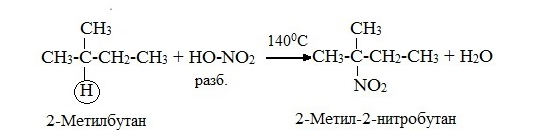
Нитрование предельных углеводородов азотной кислотой представляет собой цепной процесс, протекающий по механизму свободнорадикального замещения.
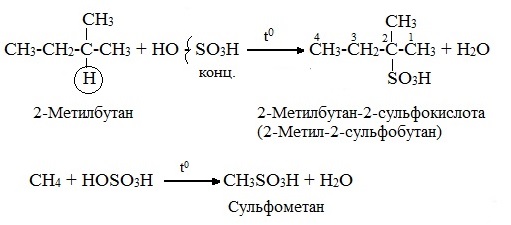
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
|
|
|
Наиболее легко замещается атом водорода у третичного атома углерода:
II . Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены-1с более короткой углеродной цепью. Крекинг бывает термический и каталитический. Термический крекинг протекает при сильном нагревании без доступа воздуха. При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой:
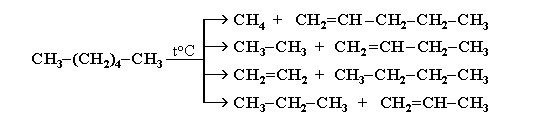
III. Дегидрирование – это процесс отщепления водорода от молекулы исходного вещества. Дегидрирование алканов проводят в присутствии катализаторов (Ni, Pt, Pd, Cr2O3).
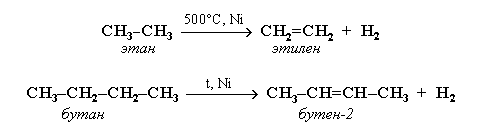
Реакция алканов C4 может может дать смесь различных продуктов:

Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений. При этом происходит дегидроциклизация – реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
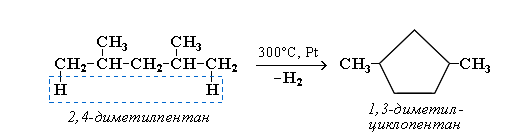
Дегидроциклизация и ароматизация алканов с цепью C6 и более всегда дает шестичленные циклы и легко продолжается до ароматического соединения (катализаторы: Рt или Cr2О3): 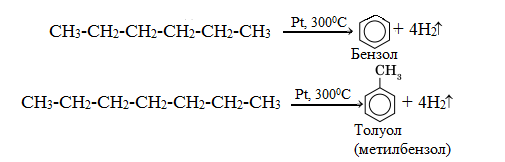
|
|
|
IV . Изомеризация алканов- превращение алканов нормального строения в изомерные им алканы с разветвленной углеродной цепью:

V . Получение реактива Гриньяра- магнийорганического соединения:
Реактивы Гриньяра получают реакцией галогеналкана с магнием в абсолютном эфире при нагревании, получается светло-серый раствор алкилмагнийгалогенида:
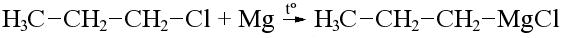 (пропилмагнийхлорид)
(пропилмагнийхлорид)
Реакция с галогеналканами напоминает реакцию Вюрца, однако с помощью синтеза Гриньяра можно получать не только симметричные алканы:

VI . Реакции окисления:
Реакция горения: 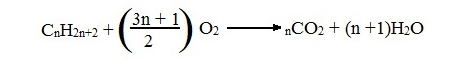
Каталитическое окисление бутана- получение синтетической уксусной кислоты:
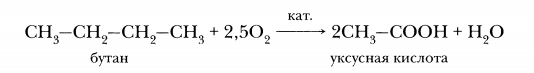
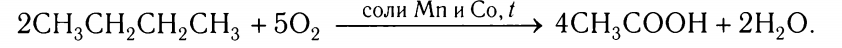
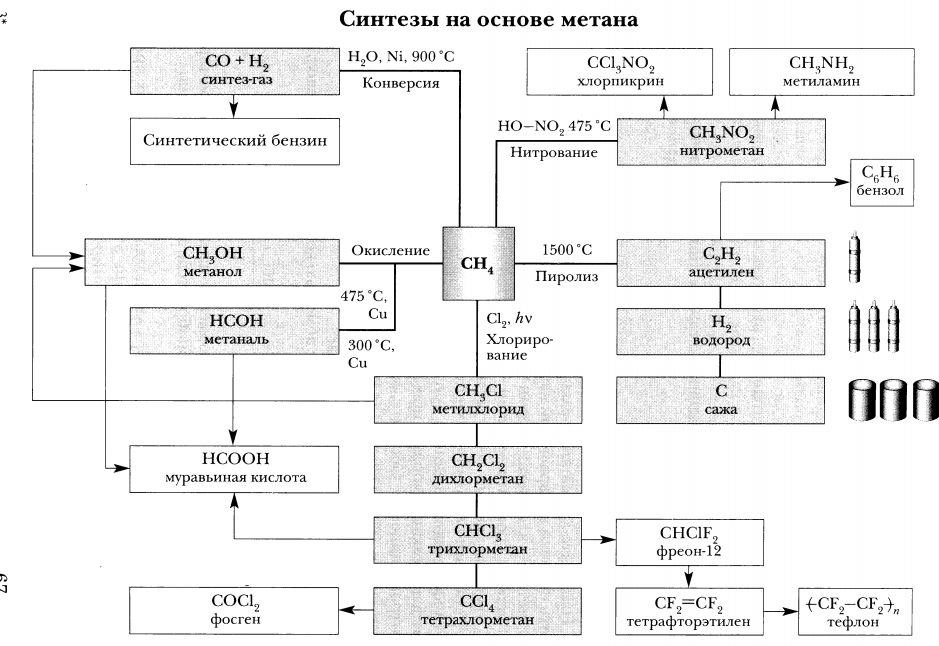
Особые свойства метана.
Пиролиз метана- разложение метана при высокой температуре без доступа кислорода:

Конверсия метана- нагревание метана с водяными парами:

Окисление метана: 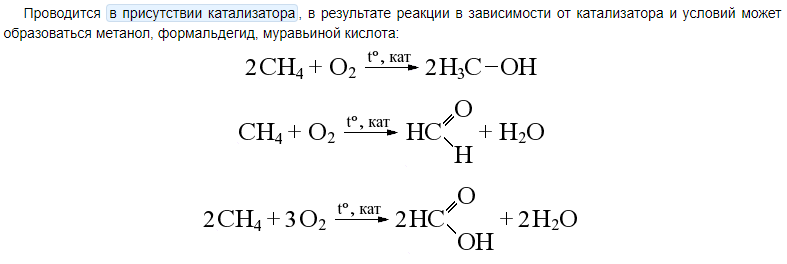
Способы получения алканов.
Получение метана.
Промышленный способ:
Газификация твердого топлива
C + 2H2 → CH4 + H2O (повышенное давление и to, kat = Ni, Mo или без катализатора).
2.Синтеза Фишера-Тропша:
CО + 3H2 → CH4 (kat = Ni, to = 200-300 оС);
Лабораторные способы:
1.Гидролиз карбида алюминия:
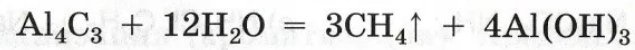
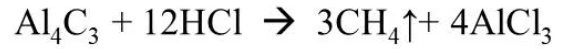


2. Сплавление ацетата калия (натрия) с аналогичной щелочью- реакция ДЮМА:

Получение гомологов метана.
Промышленные способы.
1. В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
2. Синтезом из водяного газа (СО+Н2) получают смесь алканов- синтез Фишера-Тропша
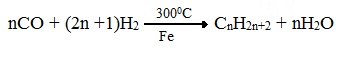
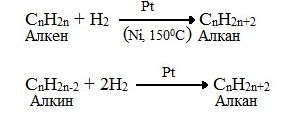
3. Каталитическое гидрирование (+Н2) непредельных углеводородов:
Лабораторные способы.
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)- происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:

Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:


Реакция Вюрца- Гриньяра (для получения нечетных алканов)

3. Реакция Ко́льбе — электрохимическая реакция получения углеводородов из карбоновых кислот или их солей.
к (-) 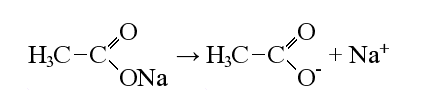

а(+)

Суммарное уравнение:
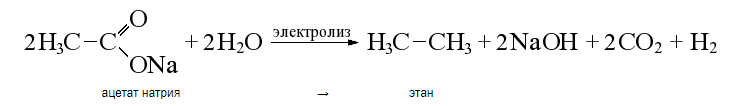

3. Реакция Дюма- сплавление солей карбоновых кислот со щелочами приводит к образованию углеводородов (не только алканов), которые будут содержать на один атом углерода меньше, чем исходная соль (этот атом углерода уходит в состав карбоната натрия):
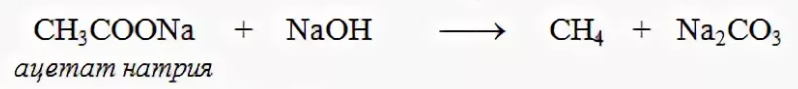
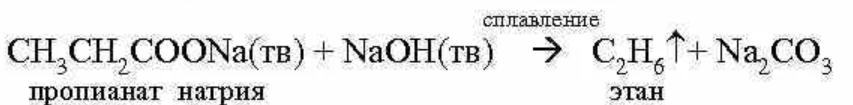
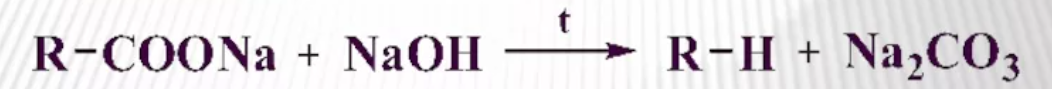
Дата добавления: 2022-01-22; просмотров: 449; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
