Рассмотрим задачи тренировочного блока урока.
Физика урок 35 дата 14.01.22г группа 2
Учебник Физика 11 кл Г.Я. Мякишев, Б.Б.Буховцев, В.М.Чаругин
Тема : Опыты Резерфорда
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны).
Размер атома: примерно 10-8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
|
|
|
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели - «Пудинг с изюмом» или «Булочка с изюмом».
|
|
|


Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10-31кг;
 - отношение заряда электрона к его массе.
- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
|
|
|

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Эрнест Резерфорд
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.

Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
|
|
|
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
| Угол отклонения α-частиц φ, ° | 15 | 60 | 105 | 150 | 180 |
| Число частиц N | 132000 | 477 | 70 | 33 | 1-3 |
Отсюда можно сделать вывод: такое поведение α-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряжённым телом малых по сравнению с атомом размеров.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц, он сам не верил в положительный результат. Он сравнил такой эффект с 15-дюймовым снарядом, как если бы его выстрелили в кусок тонкой бумаги, а снаряд возвратился бы и нанёс обратный удар.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра.
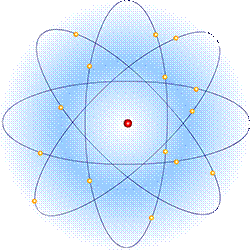
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, то есть от 10 до 100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
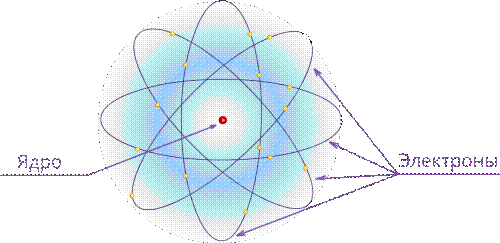
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Закон Кулона:

qα — заряд α-частицы;
q — положительный заряд атома;
r — его радиус;
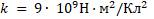 — коэффициент пропорциональности.
— коэффициент пропорциональности.
Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
В начале XX века было уже известно, что вещество излучает свет конкретных длин волн в определенных, очень узких спектральных интервалах - спектральных линиях, все линии имеют конечную длину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном состоянии). Классическим примером линейчатого спектра является спектр атома водорода.
Швейцарский физик и математикИоганн Якоб Бальмер определил, что в видимой части спектра атома водорода имеются четыре линии, соответствующие длинам волн: λ1 = 434 нм; λ2 = 486 нм; λ3 = 410 нм; λ4 = 656 нм
Частота излучений атома водорода составляет ряд серий, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний, переходов электрона с верхних энергетических уровней на нижние уровни.

На рисунке можно увидеть переходы электрона на другой энергетический уровень, частоты излучения которого находятся в видимой области спектра.
Серию уровней назвали в честь швейцарского учителя Иоганна Бальмера, который ещё в 1885 году основываясь на результатах экспериментов вывел формулу для определения частот видимой части спектра водорода:
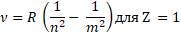
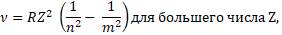
где Z – число протонов в атоме или порядковый номер в периодической таблице Менделеева;
n и m (целое число – 1, 2, 3, 4, 5, и так далее) - энергетические уровни, где m > n.
В этой формуле v — не частота, которая измеряется в с-1, а волновое число, которое равно обратному значению длины волны 1/λ и которое измеряется в м-1.
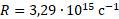
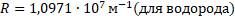
R — это постоянная Ридберга (для данного вещества), которая определена из спектральных данных, учитывая, что скорость распространения видимого излучения составляет:
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы. Все выводы об устойчивости атома и спектре, которые излучает атом будут подтверждены Нильсом Бором в 1913 году.
Рассмотрим задачи тренировочного блока урока.
1. Формула Бальмера – Ридберга для водорода приводится в виде:
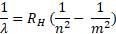
Коэффициент RH носит название постоянной Ридберга для водорода и его можно вычислить из данной формулы. Полученный результат равен _______·107 м-1, если известно, что при переходе атома водорода из четвёртого энергетического состояния во второе происходит излучение с длиной волны 486,13 нм.
Дано:
m = 4
n = 2
RH - ?
Решение:
Постоянная Ридберга для водорода:
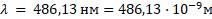
Выведем постоянную Ридберга RH из формулы Бальмера – Ридберга:
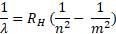

Подставим известные значения в формулу:


Ответ: 
2. Рассчитайте на какое наименьшее расстояние α-частица может приблизиться к ядру атома золота, двигаясь по прямой, проходящей через центр ядра. Масса α-частицы, её заряд, скорость движения и заряд ядра золота приведены в таблице:
| Масса α-частицы, кг | Заряд α-частицы, Кл | Скорость движения α-частицы, м/с | Заряд ядра золота, Кл | Расстояние сближения, м |
| 6,6·10-27 | 3,2·10-19 | 1,9·107 | 1,3·10-17 | ? |
По закону сохранения энергии максимальная кинетическая энергия α-частицы будет равна максимальной потенциальной энергии взаимодействия частицы с ядром атома золота:
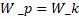
Потенциальная энергия кулоновского взаимодействия зарядов.
Для определения наименьшего расстояния между α-частицей и ядра атома золота используем формулу взаимодействия заряжённых частиц - закон Кулона:
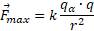
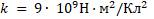 — коэффициент пропорциональности.
— коэффициент пропорциональности.
Чтобы определить силу взаимодействия зарядов на кратчайшем расстоянии, запишем II закон Ньютона, устанавливающий зависимость силы от ускорения, для движения тела движущегося по окружности с центростремительным ускорением:

Приравняем выражения для силы взаимодействия двух точечных зарядов:

Отсюда выразим расстояние сближения двух зарядов, считая его радиусом от центра ядра золота до точки сближения с α-частицей:

Подставим числовые значения в полученную формулу:

Ответ:
| Масса α-частицы, кг | Заряд α-частицы, Кл | Скорость движения α-частицы, м/с | Заряд ядра золота, Кл | Расстояние сближения, м |
| 6,6·10-27 | 3,2·10-19 | 1,9·107 | 1,3·10-17 | 3,1·10-14 |
Урок 36 дата 14.01.22г.
Тема Квантовые постулаты Бора. Модель атома водорода по Бору
Глоссарий по теме
Квантовые постулаты Бора – предположения(утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода;
Правило квантования орбит – правило, по которому электрон движется по орбитам, момент импульса которых равен целому числу постоянной планка (с чёрточкой); главное квантовое число – целое число, равное соответствующему номеру состояния атома; для основного состояния n = 1;
Энергетические уровни – уровень энергии для каждого значения главного квантового числа, начиная с 1 (единицы): Е1, Е2, Е3 и т.д.;
Индуцированное излучение – излучение возбуждённых атомов, вызванное действием другого (индуцирующего) излучения;
Лазер – устройство, в котором производится (генерируется) индуцированное когерентное излучение
Основное содержание урока
Модель атома Резерфорда противоречит классической электродинамике Максвелла. Выход из сложившейся ситуации был найден Нильсом Бором. В 1913 году он дополнил модель Резерфорда двумя постулатами, называемыми квантовыми постулатами Бора.
Первый постулат Бора (постулат стационарных состояний):
В атоме существуют стационарные орбиты, двигаясь по которым электрон не излучает.
Второй постулат (правило частот): Излучение и поглощение энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Энергия излучённого или поглощённого фотона равна разности энергий стационарных состояний
hvkn = Ek - En;
Частота излучения равна:
vkn = (Ek - En) / h
Или, длина волны излучения λ равна:
λkn = hc / (Ek - En), где h – постоянная Планка, с – скорость света в вакууме.
Если Ek > En, то происходит излучение фотона, если Ek < En, то происходит поглощение фотона, при котором атом переходит из одного стационарного состояния в другое. Энергия электрона, как и скорость и радиус орбиты, принимают дискретный набор значений, т. е. квантуются. Расчеты частот переходов с энергетических уровней для атома водорода дают значения, совпадающие с экспериментальными величинами спектра водорода.
Используя понятие энергетических уровней в атомах было открыто явление индуцированного излучения. Это явление используется в лазерах, устройствах, которые дают индуцированное излучение в различных диапазонах электромагнитного излучения.
Разбор тренировочных заданий
1. Выберите правильный ответ.
Какова энергия фотона, излучаемого атомом при переходе из возбуждённого состояния с энергией Е1 в основное состояние с энергией Е0?
Варианты ответов:
1) 
2) 
3) Е1– Е0
4) Е1+ Е0
Правильный вариант/варианты (или правильные комбинации вариантов): 3) Е1– Е0.
Подсказка: вспомните второй постулат Бора.
2.Решить задачу: «Максимальная длина волны, излучаемой в серии Бальмера равна ___ нм».
Решение:
По формуле Бальмера-Ридберга:
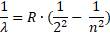
Отсюда:

Максимальная длина волны соответствует минимальному значению разности:

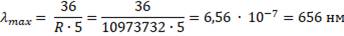
R = 10973732 м-1.
Ответ: 
д/з§74,75 основное законспектировать разобрать задачи
урок 37дата 14.01.22
Тема: Строение атома. Ядерные силы
Глоссарий по теме:
Протон – стабильная элементарная частица, ядро атома водорода.
Нейтрон – элементарная частица, не имеющая заряда.
Протонно-нейтронная модель ядра Гейзенберга-Иваненко: ядро любого атома состоит из положительно-заряжённых протонов и электронейтральных нейтронов.
Массовое число – сумма числа протонов Z и числа нейтронов N в ядре.
Нуклоны – протоны и нейтроны в составе атомного ядра.
Изотопы – разновидность данного химического элемента, различающиеся по массе атомных ядер, т. е. числом нейтронов.
Ядерные силы – это силы притяжения между нуклонами в ядре.
Дефект масс – разность масс нуклонов, составляющих ядро, и массы ядра
Дата добавления: 2022-01-22; просмотров: 20; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
