Координационная теория Вернера
Ответы на сессию по химии
1. Растворы. Классификация растворов. Растворимость.
Раствор – термодинамически устойчивая однородная система из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Классификация растворов:
1. По агрегатному состоянию (твёрдые, жидкие, газообразные)
2. По состоянию равновесия (насыщенные, не насыщенные, пересыщенные)
3. По концентрации (разбавленные, концентрированные)
4. По типу растворителя (водные, спиртовые, аммиачные, бензольные)
5. По электропроводности (электролиты, не электролиты, промежуточные)
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³).
Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
2. Способы выражения концентрации растворов
|
|
|
Массовая доля
w(в−ва)=m(в−ва)/m(р−ра)
Молярная концентрация
C=n/V n=m/M
Титр
T=m(в-ва)/V(р-ра)
Нормальная концентрация
Cн=Z/V(р-ра) Z- число эквивалентов
3. Расчет молярной массы эквивалента

Например: M оксида (Fe2O3)= 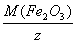 =
=  = 26.7 г/моль; где z = количество кислорода*степень окисления кислорода.
= 26.7 г/моль; где z = количество кислорода*степень окисления кислорода.
M кислоты (H2CO3) = 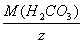 =
=  = 31 г/моль; где z = количество водорода
= 31 г/моль; где z = количество водорода
M основания (Cu(OH)2 ) =  =
= 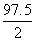 = 48.8 г/моль; где z= количество гидроксогрупп
= 48.8 г/моль; где z= количество гидроксогрупп
M соли (Al2(SO4)3)=  =
=  = 57 г/моль; где z = количество атомов металла*на степень окисления этого металла
= 57 г/моль; где z = количество атомов металла*на степень окисления этого металла
5. Энтропия процесса.
Энтропия-мера неупорядоченности системы, характеризующаяся вероятностью определенного состояния системы среди множества состояний
↑ беспорядок, ↑энтропия
S, Дж/моль*К
1. Энтропия ↑: Хим. Реакция протекает с ↑ числа молекул
При переходе из твердого в жидкое, газообразное
2. Энтропия ↓: Реакция протекает с ↓ числа молекул
С ↑ твердости вещества
6. Энергия Гиббса.
 Закон Гиббса. Для процессов в биологических системах в химических процессах характерно перейти в состояние с наименьшей энергией (DН ) и с мах возможной степенью беспорядка
Закон Гиббса. Для процессов в биологических системах в химических процессах характерно перейти в состояние с наименьшей энергией (DН ) и с мах возможной степенью беспорядка
|
|
|
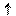 (DS ).
(DS ).
D Н и DS – движущие силы любого процесса.
Общая движущая сила процесса: изобарно-изотермический потенциал или энергия Гиббса.
Уравнение энергии Гиббса:
DG = D°DS°кДж/моль], Т – температура в Кельвинах (°С
Расчет свободной энергии Гиббса:
DG°) в химических реакциях.
DG°298 – стандартная из справочника.
DG°реакция = SDG°обр. проход. - SDG°обр.исх. вещества, с учетом стехиометрических коэффициентов.
2)DG°реакции = D°реакции DS°реакции
DG < 0, самопроизвольные реакции
DG > 0, обратная реакция
DG = 0, равновесие
1. Если DS = 0, то самопроизвольно процесс идет при D
2. Dсамопроизвольно при DS > 0
3. DDS > 0, то всегда DG < 0
4. DDSто всегда DG> 0
а) при стандартных условиях
DG -?
DGх.р. = SDGпрод. - SDG°исх. вещества = 2DG°HCL) - 2DG°кДж
DG < 0, реакция будет протекать
б) DGх.р. = D х.р. - DSх.р.
|
|
|
D х.р = -237,8 кДж
DS х.р. = -146,2 Дж/к

7. Обратимые и необратимые реакции.
Обратимыми называют химические реакции, протекающие при одних и тех же условиях и в прямом, и в обратном направлениях.
(N2 + 3H2 = 2NH3)
Необратимыми называют химические реакции, протекающие только в одном направлении.
13. Константа химического равновесия
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние химического равновесия.
Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ).
Химическое равновесие — диномическое состояние химической системы, когда при неизменяемых условиях скорость прямой реакции равна скорости обратной реакции.
Константа равновесия - количественная характеристика состояния химического равновесия.
Она определяется через концентрации всех участников реакции в состоянии равновесия, т. е. через равновесные концентрации.
Для обратимой реакции, протекающей в растворе или в газовой фазе (маленькие буквы обозначают коэффициенты, большие буквы — химические вещества):
|
|
|
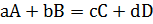
Константа равновесия равна произведению равновесных концентраций продуктов, деленному на произведение равновесных концентраций исходных веществ, при этом концентрация каждого вещества возводится в степень, равную коэффициенту при этом веществе в уравнении реакции.
То есть:
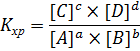
Для гомогенных:
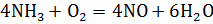

Для гетерогенных:
Концентрация чистого твердого или жидкого вещества всегда постоянна, поэтому такие вещества не учитываются при вычислении константы равновесия.
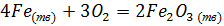

16. Правило Хунда
Полная электронная конфигурация атома – распределение всех электронов атома по уровням, подуровням и орбиталям. У шестого электрона, который есть, например, у атома углерода, "возникает проблема", где ему на 2р-ЭПУ выгоднее разместиться – на свободной АО, или на АО с неспаренным электроном.
На этот вопрос отвечает третий закон, который называется правилом Хунда (немецкий физик Фридрих Хунд сформулировал его в 1927 году). Вспомним, что электрон – заряженная частица, и, следовательно, электроны друг от друга отталкиваются; а раз так, то им выгоднее находиться на разных орбиталях одного подуровня, так как электронные облака этих орбиталей в пространстве не совпадают.
Несколько упрощенно правило Хунда звучит так: в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным.
Если шестой электрон сможет попасть на ту же орбиталь, что и предыдущий, то сумма спиновых квантовых чисел этих электронов по принципу Паули обязательно будет равна 1/2 + (–1/2) = 0 (электроны должны быть с разными спинами). А если этот электрон займет другую 2р-АО, то сумма спиновых квантовых чисел окажется равной 1/2 + 1/2 = 1, то есть больше, чем в первом случае. Модуль суммы окажется больше, чем в первом случае, и тогда, когда спиновые квантовые числа обоих электронов будут отрицательными. Следовательно, электроны занимают орбитали одного подуровня сначала по одному и только потом по два, и шестой электрон попадет на свободную р-орбиталь:

В жизни мы сталкиваемся с отдаленной аналогией правила Хунда: на конечной остановке незнакомые пассажиры, входя в троллейбус, обычно садятся сначала по одному на каждое сидение и только потом – по два.
17. Правило Клечковского. Получение энергетического ряда Клечковского.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантового чисел(n+l).При одинаковой сумме раньше заполняется орбиталь с меньшим значением главного квантового числа.
19. Потенциал ионизации. Сродство к электрону. Металлические свойства. Изменение по группе и периодам.
21. Метод валентных связей
Химическая связь между атомами образуется в результате перекрывания внешних атомных орбиталей путём обобщения электронов, находящихся на этих орбиталях.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
23. Ионный тип связи. Электроотрицательность, степень окисления.
Ионный тип связи - связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Электроотрицательность - способность атомов химических элементов оттягивать к себе общие электронные пары.
Степень окисления- условный заряд атома элемента, вычисленный на основе предположения, что связь ионная. Знак ставится на основе сопоставления ОЭО.
24. Теория электролитической диссоциации. классы неорганических соединений с позиции ТЭД.
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов:
1. Из диссоциации (распад молекул на ионы)
2. Ассоциации (процесс образования молекул из ионов).
Поэтому в уравнении электролитической диссоциации всегда ставят знак 
классы:
электролиты(соли , основания, кислоты)
неэлектролиты( оксиды)
25. Степень диссоциации электролитов. Константа диссоциации
α=n/N*100% AxBy=xA+yB
Kдис=[A]^x+[B]^y/[AxBy]
28. Окисление и окислитель. Восстановление и восстановитель.
Окисление- отдача электронов атомом, молекулой или ионом, т.е. повышение степени окисления
Восстановление- присоединение электронов атомом,молекулой или ионом, т.е. понижение степени окисления
Окислитель - это вещество или химический элемент, принимающие электроны в окислительно-восстановительной реакции.
Восстановитель - это вещество или химический элемент, отдающие электроны в окислительно-восстановительной реакции.
29. Порядок уравнивания окислительно-восстановительных реакций.
Метод электронного баланса
Для расстановки коэффициентов в окислительно-восстановительных реакциях по методу электронного баланса необходимо:
1.найти окислитель и восстановитель и записать реакции присоединения и отдачи электронов;
2.произвести баланс перенесенных зарядов;
3.произвести уравнивание в соответствии с балансом заряда;
4.проверить баланс по водороду;
5.проверить соблюдения баланса по кислороду.

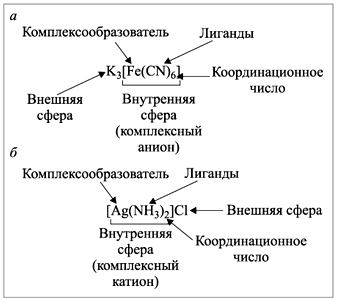
31. Комплексные соединения. Координационная теория Вернера.
Комплексное соединение состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.

Координационная теория Вернера
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Согласно теории Вернера, центральное положение в комплексных соединениях занимает, как правило, ион металла, который называют центральным ионом, или комплексообразователем.
Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет положительный заряд, является d-элементом, проявляет амфотерные свойства, имеет координационное число 4 или 6. Вокруг комплексообразователя располагаются (координируются) молекулы или кислотные остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие с ним непосредственно химические связи (например, ионы: Cl–, I–, NO3–, OH–; нейтральные молекулы: NH3, H2O, CO). Лиганды не связаны друг с другом, так как между ними действуют силы отталкивания. Когда лигандами являются молекулы, между ними возможно молекулярное взаимодействие. Координация лигандов около комплексообразователя является характерной чертой комплексных соединений.
Координационное число – это число химических связей, которые комплексообразователь образует с лигандами.
Комплексообразователь и окружающие его лиганды составляют внутреннюю сферу комплекса. Частица, состоящая из комплексообразователя и окружающих лигандов, называется комплексным ионом. При изображении комплексных соединений внутреннюю сферу (комплексный ион) ограничивают квадратными скобками. Остальные составляющие комплексного соединения расположены во внешней сфере.
33. Диссоциация комплексных соединений.
Первичная диссоциация: комплексные соединения диссоциируют как сильные электролиты на комплектный ион (внутреннюю среду) и ионы внешней среды.
K3 [Fe(CN)6] = 3K⁺+[Fe(CN)6]³⁻
Вторичная диссоциация: комплексные ионы диссоциируют как слабые электролиты. Можно применить закон действующих масс.
[Fe(CN)6] ³⁻⇄ Fe³⁺+6CN⁻
34. Классификация комплексных соединений.
По составу:
Соли: пример: K3[Fe (CN)6]
Основания: пример: [Ag(NH3)2]OH
Кислоты: пример: H[AuCl4]
2) по заряду комплексного иона:
Катионные – внутренняя сфера комплексного соединения заряжена положительно: [Cu(NH3)4]2+, [Cd(NH3)2] 2+, [Cr(H2O)6]3+.
Анионные – внутренняя сфера заряжена отрицательно: [Fe(CN)6]3-, [AIF4]-, [Al(OH)6]3-.
Электронейтральные – внутренняя сфера не имеет заряда: [Fe(CO)5]0, [Pt(NH3)2Br4]0.
По природе лиганда:
Аммиакаты – комплексы, в которых лигандами служат молекулы аммиака, как: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3.
Аквакомплексы – в которых лигандом выступает вода: [Co(H2O)6]Cl, [Al(H2O)6]Cl3.
Карбонилы – комплексные соединения, в которых лигандами являются молекулы оксида углерода (II): [Fe(CO)5], [Ni(CO)4].
Ацидокоплексы – комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4]; комплексные кислоты: H2[COCl4], H2[SiF6].
Гидроксокомплексы – комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Смешанные:
лиганды – различные молекулы и ионы.
35. Виды и основные стадии химического анализа.
Различают качественный, количественный и структурный анализ:
- качественный анализ служит для определения качественного химического состава и идентификации (установление идентичности с эталоном) веществ.
- количественный анализ служит для определения количественных соотношений между компонентами химической системы.
- структурный анализ служит для исследования внутри и межмолекулярной структуры веществ (например, молекула ДНК представляет собой две спирали, состоящие из пуриновых и пиримидиновых оснований, расположенных в определенной последовательности, и связанные между собой водородными связями).
В ходе любого анализа можно выделить следующие основные этапы:
1. отбор пробы для анализа (пробоотбор) и перевод ее в раствор (растворение).
2. разделение и концентрирование.
3. проведение анализа (конечное определение).
4. обработка полученных результатов.
41.
Осаждаемой формой (или формой осаждения) называется то соединение, которое осаждается из раствора при взаимодействии с соответствующим реагентом, а весовой формой — соединение, которое взвешивают для получения окончательного результата анализа.
Осаждаемая форма – тот осадок, который получается в результате химической реакции между осаждаемым ионом и осадителем.
Например:

К осаждаемой форме предъявляются следующие требования:
· малая величина растворимости, около 1•10–6 моль/л,
· осадок должен быть крупнокристаллическим,
· осаждаемая форма должна легко и полно превращаться в гравиметрическую форму.
Гравиметрическая форма или весовая – то вещество, которое получается после прокаливания осаждаемой формы.
Требования, предъявляемые к гравиметрической форме:
1. Состав гравиметрической формы должен точно соответствовать определенной стехиометрической формуле.
2. Она не должна менять своей массы на воздухе из-за поглощения паров H2O и CO2 или частичного разложения.
3. Содержание определяемого элемента в гравиметрической форме должно быть как можно меньше, т. к. в таком случае погрешности взвешивания в меньшей степени сказываются на результате.
Гравиметрический фактор — коэффициент, который отражает содержание определяемого компонента в анализируемом образце.
Представляет собой отношение молярных масс определяемого компонента и гравиметрической формы с учетом стехиометрических коэффициентов:

 *M-малярная масса
*M-малярная масса
Например:
 Опр. Форма грав. Форма
Опр. Форма грав. Форма
 2 Cr Cr2O3
2 Cr Cr2O3
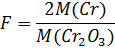
44. Произведение растворимости. Условия образования растворения осадков:
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются константой равновесия - так называемым произведением растворимости (ПР).
Произведение растворимости — постоянная величина, равная произведению активностей ионов в насыщенном растворе малорастворимого электролита. Например, при образовании осадка AgCl имеет место равновесие, которое описывается следующим ионным уравнением:
Ag+ + С1- ↔ AgCl↓.
При этом произведение растворимости записываем следующим образом
ПРAgCl = aAg+∙ aCl- = [Ag+ ]∙[Cl- ]∙f Ag+∙f Cl- ,
где aAg+ и aCl- - активности соответствующих ионов, [Ag+ ] и[Cl- ] — равновесные концентрации этих же ионов, моль/дм3 ; f Ag+ и f Cl- - коэффициенты активности ионов.
В растворах малорастворимых соединений концентрации ионов, как правило, очень низки. Если в растворе отсутствуют другие ионы, то концентрации мало отличаются от активностей ионов, например
aAg+≈ [Ag+ ] и aCl- ≈[Cl- ],
так как в отсутствие посторонних электролитов ионная сила раствора очень мала и коэффициенты активности близки к единице.
На этом основании для приближенных расчетов вместо активностей ионов можно использовать их молярные концентрации, так что произведение растворимости AgCl можно записать в виде следующего выражения:
ПРAgCl = [Ag+ ]∙[Cl- ].
Для некоторой труднорастворимой соли МpАq можно записать:
ПРМpАq = [M]p[A]q.
По опытным данным о растворимости малорастворимых электролитов рассчитывают их произведение растворимости, а также решают обратную задачу на основании табличных данных о произведении растворимости. При этом необходимо помнить, что растворимость веществ может быть выражена в любых единицах, а в ПР входит концентрация веществ в моль/дм3 . Значения ПР приведены в справочниках. Все вычисления, связанные с образованием и растворением осадков, выполняют по следующей схеме: а) составляют уравнения диссоциации электролитов, которые образуют ионы, участвующие в реакции осаждения; б) составляют ионные уравнения образования осадков; в) записывают выражение произведения растворимости в соответствии с ионным уравнением, описывающим образование осадка, и находят значения ПР по таблицам; г) вычисляют значения равновесных концентраций ионов или по заданным концентрациям сильных электролитов, или с учетом Кдисс для слабых электролитов; д) сопоставляя заданные концентрации и условия задачи, составляют алгебраическое уравнение, по которому определяют искомую величину.
Образование и растворение осадков:
Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором описывается уравнением:
АаВв(т)  АаВв(р)
АаВв(р) 
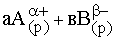 .
.
В рассматриваемых ниже случаях речь идет, в основном, о малорастворимых гидроксидах и солях. Эти соединения представляют собой сильные электролиты – та их часть, которая перешла в раствор, практически полностью диссоциирована, а если в растворе содержатся недиссоциированные молекулы 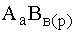 , то их концентрация ничтожна и, кроме того, в насыщенном растворе является величиной постоянной, поэтому рассматриваемое равновесие можно написать в виде
, то их концентрация ничтожна и, кроме того, в насыщенном растворе является величиной постоянной, поэтому рассматриваемое равновесие можно написать в виде
АаВв(т) 
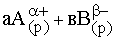 (43)
(43)
Константа равновесия этого процесса называется произведением растворимости малорастворимого соединения
 (44)
(44)
и при постоянной температуре является величиной постоянной.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов  и
и  , рассчитанное по формуле, больше, чем произведение растворимости
, рассчитанное по формуле, больше, чем произведение растворимости 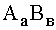 при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
Равновесие определяет полноту осаждения малорастворимого соединения: чтобы максимально полно вывести его из раствора в осадок, следует увеличивать концентрацию катиона  и (или)
и (или)  аниона
аниона 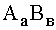 , добавляя в насыщенный раствор одноименные ионы
, добавляя в насыщенный раствор одноименные ионы  и (или)
и (или)  в виде их растворимых соединений – это так называемый «эффект одноименного иона».
в виде их растворимых соединений – это так называемый «эффект одноименного иона».
Если возникает необходимость растворить осадок 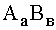 , то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения
, то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения 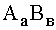
45. Понятие о стандартных веществах.
Стандартным веществом называется реагент, используемый для стандартизации раствора титранта. Стандартные вещества бывают первичными и вторичными. Первичным стандартным веществом называется вещество высокой степени очистки, используемое для стандартизации титранта либо для приготовления первичного стандартного раствора, который в дальнейшем будет выступать в роли самостоятельного титранта.
Вторичным стандартным веществом называют растворы веществ, способных реагировать с титрантом, концентрация растворенного вещества в которых установлена с помощью первичного стандартного вещества.
49. Кислотно-основное титрование. Кривые титрования. Точка эквивалентности. Выбор индикатора. Что такое интервал перехода индикатора?
Кривые титрования – графическое изображение изменения pH раствора в ходе титрования.
Кислотно-основное титрование основано на реакции взаимодействия кислоты и основания, а точнее, ионов Н+ и гидроксильной группы ОН-
В качестве титрантов используют сильные кислоты и основания. Если титрантом является кислота, метод называют ацидиметрия, если основание – алкалиметрия.
Точка эквивалентности – это конец реакции, когда количество прибавленного раствора титранта эквивалентно количеству определяемого вещества.
Для определения точки эквивалентности используют металл-индикаторы: органические красители, которые образуют с катионами металлов окрашенные комплексы.
Выбор индикатора: показатели титрования индикатора должны входить в пределы скачка титрования.
Интервал перехода индикатора – область значений pH, в которой становится видимым изменение цвета индикатора.
51. Перманганатометрия. Сущность метода. Титрант, его приготовление, хранение, стандартизация. Фиксирование точки эквивалентности.
Перманганатометрия - безиндикаторный метод количественного определения вещества. Сущность метода заключается в окислении восстановителей раствором перманганата калия.
Титрант- раствор с точно известными концентрациями(стандартные)
Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.( Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле)
Приготовление стандартных растворов:
1.Готовят из точной навески исходного, химически чистого вещества, растворяя ее в воде и разбавляя полученный раствор о требуемого в мерной колбе.
2.Приготовление из фиксанала. Таким способом можно приготовить стандартные растворы из любых веществ.
Приготовление стандартизованных растворов:
Не точную навеску вещества растворяют в неточном объеме воды. Точную концентрацию полученного раствора устанавливают, отбирая его аликвоту мерной пипеткой и титруя ее стандартным раствором.
растворы титрантов не должны менять свою концентрацию при хранении
Точка эквивалентности--момент окончания реакции, когда вещества прореагировали в эквивалентных количествах согласно уравнению реакции. Точка эквивалентности определяется с помощью индикаторов или инструментальными методами.
52.
Комплексонометрия – метод количественного титриметрического анализа, основанный на образовании комплексных соединений ионов металлов с комплексонами.
Ионы ЭДТА реагируют с катионами металлов в соотношении 1:1, независимо от заряда катиона
Наиболее часто применяется динатриевая соль этилендиаминтетрауксусной кислоты, также известная как комплексон III и трилон Б. Соль используется, поскольку она имеет лучшую растворимость в воде, чем сама кислота. Для краткости в формулах соответствующий анион записывают как Y4-, тогда комплексон III можно записать как Na2H2Y · 2 H2O
53. Жесткость воды, ее виды. Методы устранения
Жесткая вода- вода с большим содержанием солей
Виды:
А) Карбонатная (временная) – содержание гидрокарбонатов и карбонатов кальция и магния, устраняется путем кипячения;
Б) Некарбонатная (постоянная) – содержание хлоридов, сульфатов и нитратов кальция и магния (не устраняется кипячением)
В) Общая – суммарное содержание солей жесткости.
Удаление:
А)
1) Кипячение
Сa(HCO3)2 = CaCO3↓ + CO2 + H2O;
Mg(HCO3)2 = MgCO3↓ + CO2 + H2O;
при кипячении соли разрушаются с образованием труднорастворимых карбонатов и ионы Ca2+ и Mg2+ удаляются из раствора.
2) добавлением гидроксида кальция (известкового молока):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O;
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 = CaCO3↓+ 2NaHCO3.
Б) Удаление постоянной жесткости воды кипячением невозможно, поскольку хлориды и сульфаты магния и кальция не разрушаются, её можно удалить при добавлении соды или фосфата натрия:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4;
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl;
3CaSO4 + 2Na3PO4 = Ca3(PO4)2 + 3Na2SO4.
В) Для удаления общей жесткости воды используют ионообменную смолу:
1) катионный обмен:
2RH + Ca2+  R2Ca + 2H+;
R2Ca + 2H+;
2) анионный обмен:
2ROH + SO42-  R2SO4 + 2OH-
R2SO4 + 2OH-
(где R – сложный органический радикал).
54. Осадительное титрование. Общая характеристика метода. Аргентометрия . Стандартные растворы. Метод Мора.
Осадительное титрование
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, растворимых солей серебра. Эти методы также применяют для определения лекарственных препаратов: димедрола гидрохлорида, бромкамфоры, новокаина гидрохлорида и др.
Титриметрические методы осаждения основаны на применении при титровании реакций, сопровождающихся образованием малорастворимых соединений. От гравиметрического метода осаждения они отличаются тем, что при титровании к определяемому веществу прибавляют эквивалентное количество осадителя в виде стандартного раствора. Содержание определяемого компонента (вещества) рассчитывают по величине объема титранта, израсходованного на осаждение определяемого вещества.
В количественном анализе могут быть использованы только те реакции, которые отвечают следующим требованиям:
1. Реакция между определяемым веществом и стандартным раствором (титрантом) должна протекать в условиях, обеспечивающих образование осадка с минимальной растворимостью (S ≤ 10 -5 моль/дм3).
2. Реакция образования осадка должна протекать быстро, количественно, стехиометрично. При этом не должно наблюдаться образование пересыщенных растворов.
3. Должна быть возможность выбора индикатора для фиксирования конечной точки титрования.
4. Явления адсорбции и соосаждения не должны влиять на результаты определения.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами:
- серебра Аg+ + Вr- → AgВr↓
- ртути Hg22+ + 2Сl- → Hg2Cl2↓
- бария Ва2+ + SO42- → BaSO4↓
- свинца Pb2+ + CrO42- → PbСrO4↓ 97 - цинка 3Zn2+ + 2К+ + 2[Fe(CN)6]2- → Zn3К2[Fе(СN)6]2
Аргентометрия.
Аргентометрический титриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата для осаждения Сl-, Br-, I- и др.:
АgNO3 + NaCl ↔ АgCl↓ + NaNO3
Стандартный раствор 0,1 моль/дм3 нитрата серебра может быть приготовлен:
- как первичный стандартный раствор;
- как вторичный стандартный раствор.
Способы определения конечной точки титрования. В методе аргентометрии используют как безындикаторные, так и индикаторные способы фиксирования конечной точки титрования.
1. Безындикаторные способы.
Хлорид – ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). При этом анализируемый раствор титруют стандартным раствором серебра нитрата, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора нитрата серебра, в другую – каплю стандартного раствора хлорида натрия такой же концентрации. В недотитрованном растворе появляется помутнение в пробирке с серебра нитратом, в перетитрованном ‒ в пробирке с натрия хлоридом. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
2. Индикаторные способы.
В зависимости от применяемого индикатора в аргентометрии различают следующие методы:
- метод Мора, основанный на реакции между ионами серебра и галогенид – ионами в присутствии индикатора - раствора калия хромата, дающий с ионами серебра красно-бурый осадок хромата серебра:
NaBr + AgNO3 → AgBr↓ + NaNO3 98
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3
Когда определяемые галогенид-ионы практически полностью осаждаются в виде AgHal, только тогда начинает выпадать кирпично-красный осадок Ag2СrО4;
- метод Фольгарда (тиоцианатометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа (III) в качестве индикатора:
Ag+ + NCS- → AgNCS↓
После осаждения ионов серебра в виде белого осадка AgNCS избыточная капля титранта реагирует с индикатором - раствором железоаммонийных квасцов NH4[Fe(SO4)2] ∙12Н2О с образованием растворимого красного комплекса:
Fе3+ + 3NCS- → [Fе(NСS)3]
- метод Фаянса – Ходакова, основанный на применении адсорбционных индикаторов, которые адсорбируются на поверхности осадка, изменяя его цвет. В качестве адсорбционных индикаторов в аналитической практике чаще всего используют флуоресцеин, дихлорфлуоресцеин, эозин и другие соединения.
В титриметрии применяют также метод меркурометрии, основанный на осаждении малорастворимых солей ртути (I), таких как Hg2C12, Hg2Br2, Hg2I2:
Hg22+ + 2Сl- ↔ Hg2Cl2↓
Стандартные растворы
Для приготовления рабочих растворов (титрантов) применяют три спо-соба.
1. Первичный стандартный раствор. Титрованные растворы некоторых веществ можно получить по точной навеске, отвешенной на аналитических весах с точностью до четвертого знака после запятой. Навеску вещества высыпают в мерную колбу определенного объема и растворяют в воде, налитой до отметки. Приготовленный таким образом раствор часто называют раствором с приготовленным титром, по которому устанавливают точные титрованные растворы. Этот способ приготовления рабочих растворов можно применять только в тех случаях, когда растворимое вещество химически чис-тое и не изменяется при хранении. Такие вещества называются стандартными.
2. Вторичный стандартный раствор. Поскольку химически чистых веществ немного, то обычно используют другой способ: сначала готовят раствор исследуемого вещества приблизительно той концентрации, которая требуется. Для этих целей на технических весах отвешивают немного больше вещества, чем нужно по расчетной норме, и растворяют в мерной колбе определенного объема. Затем точно устанавливают его титр по раствору известной концентрации. Растворы, полученные таким образом, называют растворами с установленным титром.
3. Титрованные растворы готовят из так называемых фиксаналов, вы-пускаемых промышленностью. Фиксаналы представляют собой точную на-веску вещества, насчитанную на определенный объем и запаянную в ампулах. Для приготовления титрованного раствора из фиксанала содержимое ампулы переносят в мерную колбу и доводят водой до определенного объема
Точка эквивалентности (ТЭ) - момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества согласно уравнению реакции. ТЭ еще можно назвать стехиометрической точкой, теоретической конечной точкой титрования. В момент эквивалентности титрование прекращают, по объему титранта и его концентрации вычисляют результат анализа. Конечная точка титрования - это точка (момент) титрования, устанавливаемая экспериментально по изменению цвета индикатора или какого-либо физико-химического свойства раствора.
Метод Мора


Дата добавления: 2022-01-22; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
