Определение карбонатной жесткости методом нейтрализации.
Лабораторная работа № 1
Тема: Определение жесткости воды (общей, карбонатной, некарбонатной)
Цель работы: Методом комплексонометрии определить общую жесткость воды; методом нейтрализации определить карбонатную, временную и постоянную жесткость.
Посуда и реактивы: бюретка емкостью 25 мл, колбы для титрования, пипетка емкостью 100 мл, мерный цилиндр емкостью 10 мл или градуированная пробирка, раствор индикатора хромогена черного, метилоранжа раствор аммонийной буферной смеси, раствор соляной кислоты.
Ход работы:
Опыт 1. Определение общей жесткости
Ход определения. В коническую колбу на 250мл пипеткой отобрать 100мл исследуемой воды, добавить 5мл аммиачной буферной смеси и на кончике лопатки (несколько крупинок) индикатора. Окрашенный раствор титровать рабочим раствором трилона Б до перехода вишнево-красной окраски в синюю. Внимание! Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б следует прибавлять по каплям. Записать результаты титрования.
Расчет. Общую жесткость воды рассчитать по формуле (1), используя закон эквивалентов для растворов:
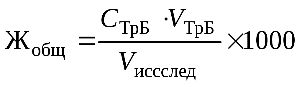 (1)
(1)
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
|
|
|
Опыт 2. Определение карбонатной жесткости
Метод основан на связывании ионов НСО3- и СО32- кислотой в присутствии метилоранжа. При титровании протекают реакции:
СО32- + НСО3- ; НСО3- + Н+ = CO2 + H2O
Ход определения. В коническую колбу на 250мл пипеткой отмерить 100мл исследуемой воды, прилить 2 капли метилоранжа. Оттитровать пробу 0,1н рабочим раствором соляной кислоты до перехода желтой окраски в оранжевую. Записать результаты титрования.
Расчет. Карбонатную жесткость воды рассчитать по формуле (2), используя закон эквивалентов для растворов:
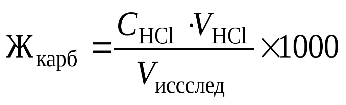 , (2)
, (2)
где Жк - карбонатная жесткость, мг-экв/л; Сн(НС1) - нормальность рабочего раствора соляной кислоты, мл; V(HC1) - объем соляной кислоты, пошедший на титрование, мл; V(иссл) - объем пробы воды, мл.
Опыт 3. Определение некарбонатной жесткости
Жнк = Жоб - Жк - некарбонатная жесткость, вычисленная по разнице общей и карбонатной жесткости определенных в опытах 1 и 2, мг-экв/л
Произвести вычисления и сделать вывод по работе:
Контрольные вопросы
|
|
|
1. Что называется жесткостью? Укажите единицы измерения жесткости.
2. Перечислите классы жесткости, виды жесткости.
3. Каким образом количественно определяют жесткость воды?
4. Охарактеризуйте способы умягчения воды.
Методические рекомендации к работе № 1
Жесткость воды обусловлена наличием в ней растворимых солей кальция, магния. Жесткостью называется количество мг-экв ионов Са2+, Mg2+, содержащихся в 1л воды. 1 мг-экв (русский градус жесткости) соответствует 40,08/2=20,04 мг/л Са2+ или 24,3/2=12,15 мг/л Mg2+.
Различают общую, карбонатную, временную и постоянную и некарбонатную жесткость.
Общей жесткостью называется суммарная концентрация ионов Са2+, Mg2+ или солей кальция, магния.
Временной жесткостью называется часть общей жесткости, удаляющаяся кипячением воды при атмосферном давлении Она равна разности между общей и постоянной жесткостью. Обусловлена наличием в воде гидрокарбонатов калия и магния, которые при кипячении разлагаются:
Ca(HCO3)2 = CaС03 + СO2 + Н2O Mg(HCO3)2 = Mg(OH)2 + 2СО2
Постоянной жесткостью называется часть общей жесткости, остающаяся после кипячения воды при атмосферном давлении. Она обусловлена наличием кальциевых и магниевых солей серной, соляной, азотной, фосфорной и кремниевой кислот, которые при кипячении воды остаются в растворе.
|
|
|
Карбонатной жесткостью называется часть общей жесткости, эквивалентная концентрации карбонатов и гидрокарбонатов кальция и магния.
Некарбонатной жесткостью называется часть общей жесткости, она равна разности между общей и карбонатной жесткостью.
По жесткости воду разделяют на: очень мягкую (0-1,5мг-экв/л солей), мягкую (1,5-3), средней жесткости (6-10) и очень жесткую (свыше 10).
Определение карбонатной жесткости методом нейтрализации.
В основе метода лежит реакция нейтрализации - взаимодействия между кислотой и щелочью. Точку эквивалентности определяют, используя кислотно-основные индикаторы.
По ГОСТ 1974-82 допустимая жесткость воды для хозяйственно- питьевого водоснабжения должна составлять не более 7мг-экв/л. Соли, обусловливающие жесткость воды, не являются вредными для живых организмов, однако наличие их в воде в больших количествах нежелательно, поскольку вода становится непригодной для хозяйственно-бытовых нужд.
Процесс, приводящий к снижению жесткости воды, называется умягчением. Умягчение сводится к уменьшению концентрации солей кальция и магния. Существующие способы умягчения воды можно разделить на три группы: реагентные методы: содово-известковый, щелочью, солями бария, фосфатами; метод ионного обмена с использованием ионитов; термический метод.
|
|
|
Определяют жесткость объемным методом - комплексонометрическим и нейтрализации.
Определение общей и временной жесткости воды комплексонометрическим методом.
Это наиболее точный и распространенный метод определения общей жесткости, основанный на образовании ионами Са2+ и Mg2+ прочных внутрикомплексных соединений с двунатриевой солью этилендиаминтетрауксусной кислоты Na2Н2Еdta или трилоном Б: 
При титровании воды трилоном Б происходит связывание ионов кальция и магния, а в раствор уходят ионы водорода, что приводит к увеличению кислотности воды. Накопление ионов водорода выше определенных значений, может вызвать разрушение образовавшегося комплекса, поэтому титрование ведут при рН=8-10. Такое значение рН достигается с помощью аммиачного буферного раствора. Точка эквивалентности определяется с помощью металл-индикаторов Н2Ind: мурексид. кислотный хромоген черный и другие, которые образуют с ионами кальция и магния менее стойкие комплексы, чем внутрикомплексные соединения трилона Б, разрушающиеся в процессе титрования. Поэтому в точке эквивалентности малиново-красная окраска раствора переходит в синюю, обусловленную окраской аниона индикатора Ind:
Н2 Ind = 2Н+ + Ind2- Малиново-красный синий
Са2+ + Ind2- = Са Ind Вишнево-красный ( рН=8-10)
СаInd + Na2Н2Еdta = СаNa2Еdta + 2Н+ + Ind2- Бесцветный синий
Дата добавления: 2022-01-22; просмотров: 118; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
