Закон сохранения энергии в механических процессах
Законы сохранения в микромире
(К динамическим теориям относятся классическая динамика Ньютона, классическая равновесная термодинамика, классическая электродинамика Максвелла).
Статистические законы — это такие законы, когда любое состояние представляет собой вероятностную характеристику системы. Здесь действуют статистические распределения величин. Это означает, что в статистических теориях состояние определяется не значениями физических величин, а их распределениями. Нахождение средних значений физических величин — главная задача статистических теорий, связи между самими величинами при этом неоднозначны.
Первым, кто ввел в физику понятие вероятности, используемое математиками при анализе случайных явлений, был Дж. К. Максвелл. В 1859 г. изучая динамику поведения систем, состоящих из очень большого числа частиц, он осознал, что такие системы нужно описывать по-другому, случайное поведение частиц/молекул подчиняется не детерминированным законам классической механики, а вероятностным (или статистическим) законам.
Максвелл исходил из того, что в принципе невозможно не только проследить за изменениями положений и импульсов каждой частицы на протяжении большого интервала времени, но и точно определить импульсы и координаты всех молекул газа или любого другого макроскопического тела в заданный момент времени. Их следует рассматривать как случайные величины, которые могут принимать различные значения, подобно тому, как при бросании игральной кости может выпасть любое число очков от 1 до 6. Несомненно, что поведение молекул в сосуде гораздо сложнее движения брошенной игральной кости. Но и здесь можно надеяться обнаружить определенные количественные закономерности, если ставить задачу так же, как и в теории игр, а не как в классической механике. Нужно отказаться, например, от неразрешимой задачи определения точного значения импульса молекулы в данный момент, а попытаться найти вероятность того, что этот импульс имеет то или иное значение.
|
|
|
И динамические и статистические закономерности вводят в качестве основного понятия состояние физической системы, однако определяется это расстояние по разному.
- в классической механике, являющейся динамической теорией, состояние задается координатами и импульсами материальных точек.
- в классической (феноменологической, эмпирической) термодинамике — состояние системы определяется давлением, объемом и температурой некоторой массы вещества.
- в классической электродинамике, также являющейся динамической теорией, состояние системы — это определенные значения напряженностей и индукции электрического и магнитного полей.
|
|
|
Эволюция этих состояний описывается соответствующими уравнениями — уравнением движения (в форме II закона Ньютона) в механике, уравнениями переноса в термодинамике неравновесных процессов, уравнениями Максвелла в электродинамике.
В статистической механике состояние системы определяется совершенно иначе: не положениями и импульсами частиц, а вероятностями того, что та или иная частица имеет координаты и импульсы в определенном диапазоне возможных значений.
Чтобы лучше представить себе специфику такого подхода, рассмотрим конкретный пример. Пусть в результате многократного измерения координаты x некоторой частицы получено N значений, в общем случае отличающихся друг от друга, x1, x2, ..., x N. (6.1) 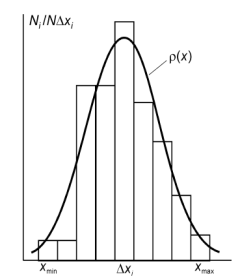 Чтобы наглядно представить эти значения, строят ступенчатый график, который называется гистограммой (рис. 6.2). Для этого интервал [xmin, xmax] на оси абсцисс, в который попадают все значения серии (6.1), разбивают на k одинаковых по ширине интервалов _x i, (i = 1, 2, ..., k) и на каждом из них строят прямоугольник, высота которого равна относительному числу значений из (6.1), попавших в соответствующий интервал, деленному на ширину интервала N i / (N_x). Тогда при достаточно больших N i и N площадь каждого прямоугольника будет равна вероятности P i = N i / N попадания результатов измерения (6.1) в соответствующий интервал _x i . Если теперь устремить N к бесконечности и одновременно ширину интервалов _x к нулю, то ступенчатый график — гистограмма — перейдет в плавную кривую _(x) (см. рис. 6.2), которая называется плотностью вероятности (или функцией распределения) случайной величины x. Смысл этой функции остается прежним: ее значение в той или иной точке x определяет вероятность dP того,что измеренное значение случайной величины x попадет в малый интервал [x, x + _x]: dP = _(x)dx. (6.2)
Чтобы наглядно представить эти значения, строят ступенчатый график, который называется гистограммой (рис. 6.2). Для этого интервал [xmin, xmax] на оси абсцисс, в который попадают все значения серии (6.1), разбивают на k одинаковых по ширине интервалов _x i, (i = 1, 2, ..., k) и на каждом из них строят прямоугольник, высота которого равна относительному числу значений из (6.1), попавших в соответствующий интервал, деленному на ширину интервала N i / (N_x). Тогда при достаточно больших N i и N площадь каждого прямоугольника будет равна вероятности P i = N i / N попадания результатов измерения (6.1) в соответствующий интервал _x i . Если теперь устремить N к бесконечности и одновременно ширину интервалов _x к нулю, то ступенчатый график — гистограмма — перейдет в плавную кривую _(x) (см. рис. 6.2), которая называется плотностью вероятности (или функцией распределения) случайной величины x. Смысл этой функции остается прежним: ее значение в той или иной точке x определяет вероятность dP того,что измеренное значение случайной величины x попадет в малый интервал [x, x + _x]: dP = _(x)dx. (6.2)
|
|
|
Так например, если в классической механике состояние N материальных точек (являющихся, например, теоретической моделью идеального газа) задается значениями N радиус_векторов r i и N импульсов p i, то в статистической механике состояние тех же N материальных точек определяется функцией распределения (плотностью вероятности) (r1, p1; r2, p2; ... r N, p N; t), с помощью которой можно вычислить вероятность того, что координаты и импульсы этих N точек находятся между определенными интервалами значений r1 и r1 + dr1, p1 и p1 + dp1, ..., r N и r N + dr N, p N и p N + dp N.
|
|
|
Главной особенностью статистических уравнений движения (Лиувилля, Больцмана и др.) является то, что их решения соответствуют необратимой трансформации функции распределения к некоторому равновесному значению. Это означает, что какой бы ни была начальная функция распределения частиц (например, она может соответствовать ситуации, когда все частицы сосредоточены в каком-то определенном месте объема), в конце концов, эта функция распределения, постепенно изменяясь, станет равновесной (в частности, будет соответствовать равномерному распределению частиц по объему). Таким образом, статистическая механика позволяет адекватно описать необратимое поведение системы, состоящей из большого числа частиц. В этом отношении у статистических теорий нет никакого отличия от динамических.
Статистические законы и теории являются более совершенной формой описания физических закономерностей, так как любой известный сегодня процесс в природе более точно описывается статистическими законами, чем динамическими, что не умаляет практической ценности динамических законов в определенных границах.
Именно статистические законы имеют отношение к объяснению порядка и беспорядка (хаоса) в природе. Феномены порядка и беспорядка (хаоса) в природе объясняются в физике на основе начал (законов) термодинамики. Термодинамика – это раздел физики, изучающий тепловые явления в термодинамических системах.
Системы (макроскопические тела - газы, жидкости, твердые вещества), состоящие из большого количества частиц (атомов, молекул), способные обмениваться с окружающей средой энергией и веществом, и описываемые макроскопическими параметрами (такими как температура, давление, объем, концентрация веществ и др.) называются термодинамическими.
Изучения состояния и поведения термодинамических систем возможно двумя способами:
1) термодинамический подход (частный случай феноменологического способа описания сложных систем) - при котором, процессы протекающие в системе, характеризуются макроскопическими величинами, регистрируемыми приборами, которые не влияют на поведение микрочастиц системы. Любая термодинамическая система описывается с помощью соответствующих параметров. Поэтому изменение любого параметра приводит к изменению поведения самой системы. Термодинамическое рассмотрение ограничивается в основном изучением особенностей превращения тепловой формы движения в другие формы, не интересуясь вопросом микроскопического движения частиц, составляющих вещество, то есть без учета молекулярного строения вещества.
2) Молекулярно-кинетический подход – основывается на 3 основных принципах
- любое вещество — газообразное, жидкое или твердое — состоит из мельчайших частиц, называемых молекулами. броуновское движение
- молекулы любого вещества находятся в постоянном хаотическом, беспорядочном движении, которое определяет макроскопические параметры системы, такие как температура, давление и проч.
- интенсивность движения молекул зависит от температуры вещества.
То есть макропроявления систем есть результат суммарного действия огромной совокупности хаотически движущихся молекул. При этом молекулярно-кинетическая теория использует статистический метод, интересуясь не движением отдельных молекул, а только средними величинами, которые характеризуют движение огромной совокупности частиц. Отсюда другое ее название - статистическая физика.
Классическая термодинамика занимается изучением соотношения и превращения теплоты и других форм энергии и работы в макроскопических системах. Законы термодинамики относятся к наиболее общим законам природы, которым подчиняются любые превращения энергии из одной формы в другие.
В основе термодинамики лежит различие между двумя типами процессов - обратимыми и необратимыми. Обратимым называется процесс, который может идти как в прямом, так и в обратном направлении, и по возвращении системы в исходное состояние не происходит никаких изменений. Любой другой процесс называется необратимым.
Законы классической механистической исследовательской программы являются обратимыми. С возникновением термодинамики в физику входит представление о необратимости процессов, что указывает на границы применимости динамического описания явлений.
Законы термодинамики называют также Началами термодинамики. Первое начало термодинамики связывают с работами таких ученых, как Жан Батист Фурье (математический закон теплопроводности), Роберт Майер (определение количественного соотношения превращения механической работы в теплоту), Джеймс Прескотт Джоуль (превращение тепловой энергии в механическую в строго определенных количествах), Сади Карно (труды по повышению эффективности паровых машин), Герман Гольц (работы по сохранению энергии).
Несколько формулировок начал
Первое начало термодинамики есть по сути закон сохранения энергии для тепловых систем – «Энергия не создается и не уничтожается, но может превращаться из одной формы в другую».
Во всех тепловых превращениях энергия не возникает из ничего и не исчезает никуда, а остается неизменной.
Другими словами «Количество теплоты Q, сообщенное системе равно сумме приращения ее внутренней энергии Δ U и совершенной механической работой А»

Тепло, полученное системой, не исчезает, а затрачивается на увеличение внутренней энергии и производство работы. Из закона сохранения энергии следует невозможность существования вечного двигателя первого рода, который мог бы совершать работу без внешнего источника энергии. (Вечный двигатель I рода – это устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Согласно закону сохранения энергии, все попытки создать такой двигатель обречены на провал. Невозможность осуществления вечного двигателя первого рода постулируется в термодинамике как первое начало термодинамики). Поскольку часть энергии внешнего источника расходуется на тепловые потери, постольку невозможно полностью затратить его энергию на получение работы.
Однако в этом законе ничего не говорится о направлении протекания тепловых процессов (гипотетически – переход тепла от более холодного тела к более горячему не противоречит 1 закону термодинамики, но противоречит реальным явлениям природы).
Необратимость тепловых процессов отражает второй закон/начало термодинамики, которое существует в нескольких эквивалентных (вытекающих одна из другой) формулировках.
- тепло не может самопроизвольно перетекать от холодного тела к горячему, то есть в природе возможны процессы, которые протекают только в одном направлении – от более горячих тел к менее горячим. То есть тепловые процессы НЕОБРАТИМЫ!!!!
- невозможно осуществить процесс, единственным результатом которого было бы превращение тепла в работу при постоянной температуре (С.Карно, тепловые машины, работа осуществляется в результате перехода тепла от более горячего тела к более холодному) идеальный цикл теплового двигателя Карно – СРС
для совершения работы теплового двигателя обязательно нужно, чтобы где-то в одном месте была более высокая температура, а в другом — более низкая. Если в термодинамической системе (а тепловая машина — это система, включающая рабочее тело, холодильник и нагреватель) разные части имеют разные температуры, то такая система, по определению, находится в неравновесном состоянии. В процессе работы тепловой машины происходит выравнивание температур, в результате чего система переходит в равновесное состояние, при котором все части системы имеют одинаковую температуру. А в состоянии равновесия тепловая машина работать не может! Таким образом, макроскопическая работа может совершаться только в процессе перехода из неравновесного в равновесное состояние. Чтобы совершать механическую работу, надо постоянно поддерживать неравновесное состояние в системе. Этот вывод имеет огромное значение не только для термодинамики, но и для всей физики, для всего естествознания и даже для социально-экономических процессов в обществе.
Например, гидроэлектростанция может работать только в том случае, когда вода из верхнего резервуара переливается в нижний. Когда уровни воды в этих резервуарах сравняются, турбины гидроэлектростанции остановятся, хотя в воде по-прежнему запасена огромная потенциальная энергия. Стоит только слить воду из нижнего водохранилища, то есть снова создать разность уровней воды, как вода из верхнего резервуара начнет вращать турбины. Еще один пример из области электричества. Ток в электрической цепи может течь и совершать полезную работу (например, вращать двигатель электромотора), только если имеется разность потенциалов (напряжение), которое обусловлено неравновесным состоянием электрических зарядов. В состоянии равновесия, когда, прежде разделенные, положительные и отрицательные заряды объединились, разность потенциалов становится равной нулю, ток не течет и работа не совершается.
Итак, второе начало термодинамики утверждает, что полезная работа может совершаться только системами, находящимися в неравновесном состоянии, характеризующемся разными температурами, электрическими потенциалами и т. п. При переходе в равновесное состояние
такие системы теряют способность совершать макроскопическую работу.
- нельзя построить вечный двигатель второго рода, который совершал бы полезную работу только за счет охлаждения теплового резервуара (нет разности температур – не совершается работа)
- при любом переходе из одного вида в другой некоторое количество первичной энергии всегда теряет свое качество и, следовательно, способность выполнять полезную работу. Рассеивание части энергии в виде низкокачественного тепла есть понижение ее качества, переход ее в низкокачественную форму. То есть мы практически никогда не можем восстановить или повторно использовать высококачественную энергию для выполнения полезной работы. Будучи однажды использованной, энергии, которая содержалась в хлебе, бензине, каменном угле, куске урана, выполняет работу и рассеивается в окружающей среде в виде низкокачественного тепла.
Дальнейшее развитие второго начала термодинамики связано с введением понятия Энтропии – S немецким физиком Рудольфом Клаузиусом как особой функции состояния системы, по изменению которой можно судить о направлении термодинамических процессов. Клаузиус установил, что в обратимых процессах некоторая физическая величина, (названная им энтропией S), сохраняется. Это означает, что энтропия системы может рассматриваться как функция состояния системы, ибо изменение ее не зависит от вида процесса, а определяется только начальным и конечным состояниями системы.
По определению Клаузиуса, энтропией называется такая физическая величина, приращение которой ΔS равно количеству тепла ΔQ, полученному системой, деленному на абсолютную температуру (-273оК, 0оС):
ΔS = ΔQ / T.
Энтропия замкнутой термодинамической системы, т.е. системы, ко торая не обменивается с окружающей средой ни энергией, ни веществом, возрастает и достигает максимума в точке термодинамического равновесия.
Понятие энтропии позволяет отличать в случае изолированных систем обратимые процессы (энтропия максимальна и постоянна) от необратимых процессов (энтропия возрастает).
Энергия определенного качества может переходить только в энергию более низкого качества, энтропия, таким образом, является величиной, определяющей качество энергии (по Клаузиусу).
Процессы в живой и неживой природе в целом протекают так, что энтропия в замкнутых изолированных системах возрастает, а качество энергии понижается – смысл 2 начала термодинамики.
Впоследствии австрийский физик Л. Больцман (1844—1906) стал рассматривать тепловые процессы с точки зрения молекулярно-кинетической теории как хаотическое движение огромного числа молекул. Поскольку с увеличением температуры системы эта хаотичность возрастает, то Больцман стал истолковывать энтропию как рост беспорядка и дезорганизации системы. Энтропия - это мера хаотичности, беспорядка или неупорядоченности в системе.
Например, частицы газа находятся в хаотичном движении, они более не упорядочены, чем частицы твердых тел. Следовательно, энтропия газов больше, чем энтропия твердых тел. Вещество высокого качества, хорошо упорядоченное или сконцентрированное или высококачественная энергия - обладает низкой энтропией. Вещество низкого качества, рассеянное или энергия, рассеивающаяся в окружающую среду, характеризуется высокой энтропией. Таким образом, энергия низкого качества, обладающая высокой энтропией, рассеяна настолько, что не способна выполнять полезную работу, то есть высококачественная энергия (низкая энтропия) в отличие от вещества не может быть восстановлена или использована повторно.
Применив статистический метод описания, Больцман стал интерпретировать энтропию в терминах изменения порядка в системе. Когда энтропия системы возрастает, то соответственно усиливается беспорядок в системе. А это означает, что такие системы эволюционируют в сторону увеличения в них энтропии, беспорядка, хаоса и дезорганизации, пока не достигнут точки термодинамического равновесия, в которой всякое производство работы становится невозможным.
Больцман установил также связь между энтропией и вероятностью достижения системой состояния термодинамического равновесия: Всякое макросостояние системы может быть осуществлено различными способами, каждому из которых соответствует некоторое микросостояние системы. Число различных микросостояний, соответствующих данному макросостоянию, называется статистическим весом W, или термодинамической вероятностью макросостояния. Больцман первым увидел связь между энтропией и вероятностью и связал понятие энтропии S с натуральным логарифмом статистического веса W: S = klnW , где k - коэффициент пропорциональности, названный постоянной
Больцмана (чем больше вероятность нахождения системы в каком-то определенном состоянии, тем больше энтропия системы в таком состоянии).
Дата добавления: 2022-01-22; просмотров: 36; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
