Стадии развития метаболического синдрома в сочетании с дисгоромональным дисгармональными нарушениями и ожирением.
Некоторые биохимические аспекты сердечно-сосудистых заболеваний и ожирения.
Лекция
Профессора Канской Н.В. и ст. преп. Поздняковой И.А.
Избыточная масса тела (ИМТ) - один из показателей состояния здоровья. Лишние килограммы значительно повышают риск развития таких серьезнейших заболеваний как артериальная гипертензия (АГ), сахарный диабет (СД) 2 типа, ишемическая болезнь сердца (ИБС), поэтому очень важно следить за своим весом.
Наиболее популярным методом оценки веса на сегодняшний день является вычисление индекса Кетле, отражающего запасы жира в организме. Чтобы получить эту величину, нужно разделить свой вес (в килограммах) на рост (в метрах), возведенный в квадрат. Если, например, рост человека равен 175 см, а вес — 85 кг, то индекс Кетле для него будет составлять 85/(1,75•1,75) = 27,8
Ожирение - это:
- накопление жира в организме, приводящее к увеличению избыточной массы тела. Ожирение характеризуется избыточным отложением жира в жировых депо организма.
- результат такого потребления калорий с пищей, которое превышает расход калорий, то есть результат поддержания положительного энергетического баланса в течение длительного времени.
- хроническое заболевание, требующее длительного медицинского лечения и наблюдения, направленных на стабильное снижение массы тела, уменьшение частоты сопутствующих заболеваний и смертности. До 75% пациентов, соблюдавших диету (особенно очень низкокалорийную - около 400-800 ккал/сутки), набирают большую часть из потерянного веса в пределах 1 года.
|
|
|
Степени ожирения
В зависимости от массы тела различают ожирение
1-ой степени (увеличение массы по сравнению с “идеальной” более чем на 29%);
2-ой степени (избыток массы тела составляет 30—49%);
3-ей степени (избыток массы тела равен 50—99%);
4-ой степени (избыток массы тела составляет 100% и более).
Классификация ожирения
I.Первичное ожирение. Алиментарно-конституциональное (экзогенно конституциональное)
1. Конституционально - наследственное
2. С нарушением пищевого поведения (синдром ночной еды, повышенное потребление пищи на стресс)
3. Смешанное ожирение
II. Вторичное ожирение
1. С установленными генетическими дефектами
2. Церебральное ожирение
- опухоли головного мозга
- травма основания черепа и последствия хирургических операций
- синдром пустого турецкого седла
- травмы черепа
- воспалительные заболевания (энцефалит и др.)
3. Эндокринное ожирение
- гипофизарное
- гипотиреоидное
- климактерическое
- надпочечниковое
- смешанное
4. Ожирение на фоне психических заболеваний и/или приема нейролептиков
|
|
|
Стадии ожирения
а) прогрессирующая,
б) стабильная.
Типы ожирения
1. "Верхний" тип (абдоминальный), мужской
2. "Нижний тип" (бедренно-ягодичный), женский
Жир может располагаться
1. В подкожножировой клетчатке (подкожный жир)
2. Вокруг внутренних органов (висцеральный жир)
Подкожно-жировая клетчатка в области живота + висцеральный жир брюшной полости = АБДОМИНАЛЬНЫЙ ЖИР
Отложение жировой клетчатки в абдоминальной области (верхний тип ожирения, или центральное ожирение) более четко связано с заболеваемостью и смертностью, чем нижний тип ожирения или чем степень ожирения!
Многочисленные исследования показали, что большое количество абдоминальной жировой ткани связано с высоким риском развития дислипопротеинемия, сахарного диабета, сердечно-сосудистых заболеваний. Эта зависимость не связана с общим содержанием жира в организме. При одинаковом индексе массы тела (ИМТ), абдоминальное ожирение, или увеличенное отложение жировой клетчатки в области живота, сопровождается более высоким риском развития сопутствующих заболеваний, чем ожирение по нижнему типу.
Абдоминальное распределение жира увеличивает риск смертности у мужчин и женщин. Предварительные данные также свидетельствуют о наличии взаимосвязи данного типа отложения жира и саркомы у женщин.
|
|
|
Напомним, что наиболее простым показателем распределения жировой ткани является индекс ОТ/ОБ (отношение объема талии к объему бедер).
Высокое значение соотношения ОТ/ОБ означает преимущественное накопление жировой ткани в абдоминальной области, т.е. в верхней части тела. Мужчины и женщины входят в группу риска в том случае если ОТ/ОБ больше или равен 1,0 и 0,85 соответственно.
Для мужчин ОТ/ОБ 1,0
Для женщин ОТ/ОБ 0,85
Идеальный вес. Определение идеального веса.
Идеальный вес рассчитывают с учетом параметров роста, пола, возраста, телосложения.
Выделяют три типа телосложения - нормостенический, гиперстенический и астенический.
Определить этот тип можно по так называемому реберному углу, по индексу Соловьева ( диаметр самого узкого места на запястье), а также по внешним признакам. Астеник. Реберный угол острый (меньше 90 градусов). Индекс Соловьева: менее 15 см у женщин, и менее 18 у мужчин. У людей, имеющих астенический (тонкокостный) тип телосложения, продольные размеры преобладают над поперечными: конечности длинные, тонкая кость, шея длинная, тонкая, мышцы развиты сравнительно слабо. Нормостеник: Реберный угол примерно равен 90 градусам. Индекс Соловьева: 15 - 17 см у женщин,18 - 20 – у мужчин.
Телосложение нормостеников (нормокостный тип) отличается пропорциональностью основных размеров тела и правильным их соотношением. Гиперстеник: Реберный угол тупой (больше 90 градусов).Индекс Соловьева: более 17 см у женщин, 20 у мужчин.У представителей гиперстенического (ширококостного) телосложения поперечные размеры тела значительно больше, чем у нормостеников и особенно астеников. Их кости толсты и тяжелы, плечи, грудная клетка и бедра широкие, а ноги короткие.
|
|
|
Формула Брока
Идеальный вес = рост в см.- 100 При росте до 165 см
Идеальный вес = рост в см.- 105 При росте 166-175 см
Идеальный вес = рост в см.- 110 При росте более 175 см
При астеническом типе телосложения полученое значение уменьшают на 10%, при гиперстеническом увеличивают на 10%.
Пример.
Женщина в 33 лет, ростом 1м 66см, с нормостеничной фигурой должна весить:
Идеальный вес = 166 - 105 = 61кг
Росто-весовой коэффициент
Для определения нормального веса тела часто используют так называемый росто – весовой коэффициент. В нижеприведенной таблице весо-ростовой коэффициент (вес в г делится на рост в см) для женщин возраста от 15 до 40 лет. Рекомендуемый весо–ростовой коэффициент (г/см)
Таблица 1
Взаимозависимость возраста и типа телосложения
| Возраст | Типы телосложения | ||
| астенический | нормостенический | гиперстенический | |
| 15–18 | 315 | 325 | 355 |
| 19–25 | 325 | 345 | 370 |
| 26–39 | 335 | 360 | 380 |
Пример.
Женщина в 33 лет, ростом 1м 66см, с нормостеничной фигурой должна весить:
Идеальный вес =166 х 360 = 59,8 кг
Идеальный вес, при котором вероятность заболеваний, связанных с ожирением – гипертонии, ишемической болезни сердца или сахарного диабета минимальна. Чем выше вес, тем больше вероятность всех этих заболеваний, тем дороже страховка. Ниже приведена таблица идеальной массы тела в зависимости от пола, роста и типа телосложения ( A – астенический тип телосложения, N – нормостенический тип телосложения, G – гиперстенический тип телосложения).
Таблица 2
Зависимость веса от пола и телосложения
| Рост | Мужчины | Женщины | ||||
| А | N | G | А | N | G | |
| 160 | 52,2 – 55,8 | 54,9 – 60,3 | 58,5 – 65,3 | 47,6 – 51,3 | 49,9 – 55,3 | 53,5 – 60,8 |
| 162 | 53,2 – 56,9 | 55,9 – 61,9 | 59,6 – 66,7 | 48,7 – 52,3 | 51,0 – 56,8 | 54,6 – 62,2 |
| 164 | 54,3 – 57,9 | 57,0 – 62,5 | 60,7 – 68,8 | 49,8 – 53,4 | 52,0 – 58,2 | 55,9 – 63,7 |
| 166 | 55,4 – 59,2 | 58,1 – 63,7 | 61,7 – 69,6 | 50,8 – 54,6 | 53,3 – 59,8 | 57,3 – 65,1 |
| 168 | 56,5 – 60,6 | 59,2 – 65,1 | 62,9 – 71,1 | 52,0 – 56,0 | 54,7 –- 61,5 | 58,8 – 66,5 |
| 170 | 57,9 – 62,0 | 60,7 – 66,7 | 64,3 – 72,9 | 53,4 – 57,9 | 56,1 – 62,9 | 60,2 – 67,9 |
| 172 | 59,4 – 63,4 | 62,1 – 68,3 | 66,0 – 74,7 | 54,8 – 58,9 | 57,5 – 64,3 | 61,6 – 69,3 |
Таблица 3
Классификация ожирения по ИМТ и риск сердечно-сосудистых заболеваний
| Типы ожирения | ИМТ кг/м2 | Риск сопутствующих заболеваний |
| Дефицит массы тела | <19,0 | Имеется риск других заболеваний |
| Нормальная масса тела | 19,0–24,9 | Обычный |
| Избыточная масса тела | 25,0–27,0 | Умеренный |
| Ожирение 1 степени | 27,0–29,9 | Повышенный |
| Ожирение 2А степени | 30,0–34,9 | Высокий |
| Ожирение 2Б степени | 35,0–39,9 | Очень высокий |
| Ожирение 3 степени | >40,0 | Чрезвычайно высокий |
Ожирение часто сочетается с такими заболеваниями, как сахарный диабет 2 типа, артериальная гипертензия, дислипопротеинемия, ишемическая болезнь сердца (ИБС).
Известно также, что ожирению нередко сопутствуют инсулинорезистентность (ИР) и гиперинсулинемия. Частота и тяжесть сопряженных с ожирением нарушений и заболеваний зависят не только от степени ожирения (по ИМТ) ,но и особенностей отложения жировой ткани в организме. Еще в 1947 году J. Vague описал два типа отложения жира – андроидный (мужской) и геноидный (женский), - обратив внимание на то, что андроидное ожирение чаще, чем геноидное сочетается с СД, ИБС, подагрой, тем самым подчеркнув значение топографии жировой ткани в организме в развитии заболеваний, связанных с ожирением. В последующие годы многочисленные наблюдения и исследования подтвердили: избыточное накопление абдоминальной жировой ткани, как правило, сопровождается метаболическими нарушениями и в значительной мере увеличивает риск развития АГ, СД 2 типа, атеросклеротических заболеваний. Разнообразные сочетания метаболических нарушений и заболеваний при ожирении описывались под различными названиями – метаболический синдром, полиметаболический синдром, синдром «изобилия». Все авторы предполагали наличие взаимосвязей между описываемыми ими метаболическими нарушениями и неизменно указывали на их роль в ускорении развития ИБС и других АС заболеваний. В 1988 году G. Reaven описал симптомокомплекс, включавший гиперинсулинемию, нарушение толерантности к глюкозе (НТГ), гипертриацилглицеридемию, низкий уровень холестерола ЛПВП и АГ, под названием «синдром Х». Он впервые выдвинул гипотезу о том, что нарушения, объединенные рамками синдрома, связаны единым происхождением – инсулинорезистентностью и компенсаторной гиперинсулинемией, а так же отметил важность описанных изменений для развития ИБС. Он не относил абдоминальное ожирение к числу обязательных признаков синдрома. Однако уже в 1989 году Каплан, описав «смертельный квартет», определил абдоминальное ожирение, наряду с НТГ, АГ и гипертриацилглицеридемией, в качестве существенной составляющей синдрома. Более поздние работы G. Reaen, других исследователей показали и подтвердили тесную связь абдоминального ожирения с инсулинорезистентностью, другими гормональными и метаболическими нарушениями, которые в большинстве своем являются факторами риска развития СД 2 типа и сердечно-сосустых заболеваний атерогенного генеза.
Метаболический синдром характеризуется наличием у пациентов сочетания АГ, ожирения, дислипопротеинемии, инсулиннезависимого СД и повышенной толерантности к глюкозе, являющихся факторами риска развития атеросклероза (АС). Следовательно, метаболический синдром сочетает в себе не менее трех синдромов и трех заболеваний. Показано, что в основе каждой патологии из названного сочетания, как и синдрома в целом, лежит единый биохимический механизм – повышение резистентности тканей к инсулину, характеризующийся устойчивой тенденцией к понижению инсулинзависимого транспорта глюкозы в клетки, особенно мышечной ткани, а именно миокарда.
Синонимы метаболического синдрома: полиметаболический синдром, синдром «изобилия», метаболический трисиндром, синдром «Х», «смертельный квартет», синдром инсулинорезистентности, смертельный секстет, метаболический сосудистый синдром.
В 1993 году L. M. Resnick опубликовал свою теорию формирования синдрома Х. Согласно ей АГ, инсулинонезависимый СД, ожирение, АС, гипертрофия левого желудочка (ЛЖ) – это важнейшие клинические проявления единого заболевания – «генерализованной сердечно-сосудистой метаболической болезни». Основным ее этиологическим фактором является мембранный дефект, приводящий к повышению концентрации свободных цитозольных кальция и натрия и к понижению внутриклеточной концентрации ионов магния, а так же рН.
Основной гормональный дисбаланс описываемой патологии – это инсулинорезистентность, которая является нарушением механизма биологического действия инсулина, сопровождающегося понижением потребления глюкозы тканями, главным образом, скелетной мускулатурой. При этом нарушается в большей степени неокислительный путь потребления глюкозы – синтез гликогена. Развитию инсулинорезистентности способствуют как генетические факторы (дефект инсулиновых рецепторов или пострецепторный дефект), так и влияние внешних факторов, среди которых в первую очередь следует выделить формирование ожирения (особенно андрогенного) и понижение объемного кровотока в капиллярах скелетной мускулатуры в результате их вазоконстрикции, что увеличивает путь диффузии глюкозы к клеткам. В свою очередь, данные нарушения могут быть обусловлены гиподинамией, гиперкалорийным питанием, повышением активности симпатической нервной системы (частые стрессы) – всем, что объединяют в литературе под понятием «западный образ жизни».
При наличии инсулинорезистентности  -клетки островкового аппарата поджелудочной железы (ПЖЖ) увеличивают синтез и секрецию инсулина, чтобы компенсировать нарушение чувствительности к нему и сохранить нормальную толерантность к глюкозе. Развивается гиперинсулинемия. Влияя на сосуды непосредственно, инсулин вызывает вазодилатацию, поэтому острая гиперинсулинемия, вызванная инфузией инсулина у здоровых добровольцев, сопровождается гипотензией. Медиатором вазодилатации является оксид азота. Однако, при наличии инсулинорезистентности вазодилатирующий эффект инсулина исчезает. Возможно, решающую роль при этом играет нарушение синтеза оксида азота в результате повышения концентрации свободных жирных кислот, что часто имеет место при ожирении. Хроническая гиперинсулинемия вызывает пародоксальную вазоконстрикцию и увеличение минутного объема кровообращения в результате стимуляции симпатической нервной системы, увеличение объема циркулирующей крови (ОЦК) в результате увеличения реабсорбции ионов натрия и воды в проксимальных и дистальных канальцах нефронов, сужение просвета артериол за счет пролиферации их гладкомышечных клеток, т.к. инсулин является мощным фактором, стимулирующим клеточный рост. Поскольку инсулин является гормоном, регулирующим ряд механизмов трансмембранного переноса ионов, увеличение его концентрации приводит к повышению внутриклеточной концентрации ионов натрия и кальция. Последнее в гладкомышечных клетках артериол сопровождается повышением их чувствительности к прессорному влиянию норадреналина и ангиотензина. В результате хроническая гиперинсулинемия ведет к развитию артериальной гипертензии.
-клетки островкового аппарата поджелудочной железы (ПЖЖ) увеличивают синтез и секрецию инсулина, чтобы компенсировать нарушение чувствительности к нему и сохранить нормальную толерантность к глюкозе. Развивается гиперинсулинемия. Влияя на сосуды непосредственно, инсулин вызывает вазодилатацию, поэтому острая гиперинсулинемия, вызванная инфузией инсулина у здоровых добровольцев, сопровождается гипотензией. Медиатором вазодилатации является оксид азота. Однако, при наличии инсулинорезистентности вазодилатирующий эффект инсулина исчезает. Возможно, решающую роль при этом играет нарушение синтеза оксида азота в результате повышения концентрации свободных жирных кислот, что часто имеет место при ожирении. Хроническая гиперинсулинемия вызывает пародоксальную вазоконстрикцию и увеличение минутного объема кровообращения в результате стимуляции симпатической нервной системы, увеличение объема циркулирующей крови (ОЦК) в результате увеличения реабсорбции ионов натрия и воды в проксимальных и дистальных канальцах нефронов, сужение просвета артериол за счет пролиферации их гладкомышечных клеток, т.к. инсулин является мощным фактором, стимулирующим клеточный рост. Поскольку инсулин является гормоном, регулирующим ряд механизмов трансмембранного переноса ионов, увеличение его концентрации приводит к повышению внутриклеточной концентрации ионов натрия и кальция. Последнее в гладкомышечных клетках артериол сопровождается повышением их чувствительности к прессорному влиянию норадреналина и ангиотензина. В результате хроническая гиперинсулинемия ведет к развитию артериальной гипертензии.
Инсулин регулирует скорость синтеза липопротеинов очень низкой плотности (ЛПОНП) печенью. При повышении его концентрации происходит рост синтеза данных липопротеинов. Элиминация липопротеинов очень низкой плотности (ЛПОНП) регулируется ферментом липопротеинлипазой, актианость которой также находится под контролем исулина. При наличии инсулинорезистентности данный фермент, как и другие ткани, оказывается резистентным к влиянию инсулина. Поэтому элиминация ЛПОНП замедляется. Рост синтеза и замедление элиминации приводят к повышению концентрации ЛПОНП (триацилглицеридов) в плазме крови. Понижение активности липопротеинлипазы сопровождается понижением содержания липопротеинов высокой плотности (ЛПВП), так как они образуются в организме в процессе гидролиза ЛПОНП. Более того, показано, что гиперинсулинемия непосредственно способствует катаболизму ЛПВП. Таким образом, развитие иммунорезистентности и гиперинсулинемии сопровождается развитием дислипопротеинемии, характеризующейся повышением концентрации ЛПОНП (триацилглицерола) и понижением коцентрации ЛПВП в плазме крови. Данная дислипопротеинемия является атерогенной.
Гиперинсулинемия является «атерогенным» фактором не только потому, что повышение концентрации инсулина способствуют развитию атерогенной дислипидемии, но так же потому, что усиливает пролиферацию гладкомышечных клеток и фибробластов, увеличивает активность рецепторов липопротеинов низкой плотности и синтез эндогенного холестерола в клетках сосудистой стенки, а также коллагена – одного из основных составляющих атеросклеротического повреждения. Являясь фактором роста, инсулин стимулирует образование и других веществ с подобным действием, например инсулиноподобных факторов роста-1 и 2.
Наконец известно, что прогрессированию атеросклеротических поражений и, особенно, развитию их острых осложнений, в частности, острого инфаркта миокарда (ОИМ) при ИБС, способствуют коагуляционные нарушения. Было показано, что гиперинсулинемия вызывает гиперфибриногенемию и повышение активности ингибитора тканевого активатора плазминогена 1 типа, что ведет к понижению фибринолиза. Таким образом, гиперинсулинемия, являясь компенсаторной ответной реакцией, поддерживающей нормальный транспорт глюкозы в клетки одновременно является патологической, т.к. приводит к целой серии метаболических нарушений, конечным результатом которых является быстрое развитие и прогрессирование АС , в частности, ИБС и ОИМ, которые в значительной степени и определяют прогноз состояния здоровья у данных больных.
Особенно важным представляется то обстоятельство, что развитие гиперинсулинемии сопровождается рядом патологических нарушений, замыкающих «патологические круги». Например, гиперинсулинемия вызывает активизацию симпатической нервной системы, которая последовательно влечет за собой патологическую вазоконстрикцию, уменьшение объемного кровотока, а именно ОЦК в капиллярах скелетной мускулатуры, что является причиной прогрессирования инсулинорезистентности и дальнейшего роста гипоинсулинемии. Поэтому, инсулинорезистентность имеет тенденцию к прогрессированию. Гиперинсулинемия нарастает по мере развития инсулинорезистентности, этот процесс продолжается до тех пор, пока ПЖЖ сохраняет способность к увеличению секреции инсулина. Но, начиная с определенного момента, больной проходит верхнюю точку «старлинговской кривой поджелудочной железы» и секреция инсулина оказывается уже недостаточной для поддержания нормальной толерантности тканей к глюкозе. Развивается нарушение толерантности к глюкозе. По мере дальнейшего его развития, декомпенсация функции ПЖЖ нарастает, соответственно, концентрация инсулина в плазме крови начинает падать уже натощак. Развивается сахарный диабет (СД).
Проблема метаболического синдрома особенно остро стоит в кардиологии. Было показано, что такие группы препаратов, как  -блокаторы и тиазидовые диуретики, широко применяемые для лечения артериальной гипертензии, вызывают прогрессирование инсулинорезистентности тканей. Поэтому, положительно влияя на один из компонентов синдрома, они вызывают его прогрессирование в целом.
-блокаторы и тиазидовые диуретики, широко применяемые для лечения артериальной гипертензии, вызывают прогрессирование инсулинорезистентности тканей. Поэтому, положительно влияя на один из компонентов синдрома, они вызывают его прогрессирование в целом.
Согласно современным представлениям, объединяющая основа всех проявлений метаболического синдрома – первичная инсулинорезистентность и сопутствующая системная гиперинсулинемия, т.е. дисгормональные нарушения метаболизма. Гиперинсулинемия, с одной стороны, является компенсаторной, то есть необходимой для преодоления инсулинорезистентности и поддержания нормального транспорта глюкозы в клетки; с другой – патологической, способствующей возникновению и развитию метаболических, гемодинамических и органных нарушений, приводящих в конечном итоге к развитию СД 2 типа, ИБС и других проявлений атеросклероза. Это доказано большим количеством экспериментальных и клинических исследований.
До настоящего времени окончательно не изучены все возможные причины и механизмы развития инсулинорезистентности при абдоминальном ожирении, не все составляющие метаболического синдрома можно четко связать и объяснить инсулинорезистентностью.
Инсулинорезистентность – это снижение реакции инсулинчувствительных тканей на инсулин при его достаточной концентрации. Изучение генетических факторов, обусловливающих развитие инсулинорезистентности, показало ее полигенный характер. В развитии нарушений чувствительности к инсулину могут иметь значение мутации генов субстрата инсулинового рецептора (СИР-1), гликогенсинтетазы, гормончувствительной липазы,  -аденорецепторов, фактора некроза опухолей-
-аденорецепторов, фактора некроза опухолей- 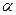 , разобщающего протеина (UCP-1), а также молекулярные дефекты белков, передающих сигналы инсулина (увеличение экспрессии Rad-белка и UPC-1 – ингибитора тирозинкиназы инсулинового рецептора в мышечной ткани, снижение мембранной концентрации и активности внутриклеточных транспортеров глюкозы - GLUT-4 в мышечной ткани)
, разобщающего протеина (UCP-1), а также молекулярные дефекты белков, передающих сигналы инсулина (увеличение экспрессии Rad-белка и UPC-1 – ингибитора тирозинкиназы инсулинового рецептора в мышечной ткани, снижение мембранной концентрации и активности внутриклеточных транспортеров глюкозы - GLUT-4 в мышечной ткани)
Важную роль в развитии и прогрессировании инсулинорезистентности и связанных с ней метаболических расстройств играет жировая ткань абдоминальной области, нейрогормональные нарушения, сопутствующие абдоминальному ожирению, повышенная активность симпатической нервной системы.
Применение компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) позволили изучить топографию жировой ткани в абдоминальной области и разделить ее на висцеральную (интраабдоминальную) и подкожную. Удалось подтвердить и взаимосвязь между висцеральной жировой тканью, инсулинорезистентностью и нарушениями метаболизма. Исследования показали, что значительное увеличение массы висцеральной жировой ткани (по данным КТ соответствующее площади 130 см2), как правило, сочетается с метаболическими нарушениями. Установлена четкая корреляция между степенью развития жировой ткани и величиной окружности талии (ОТ). Висцеральной жировой ткани, имеющей площадь 130 см², как у мужчин, так и женщин в возрасте до 40 лет, соответствует окружность талии 100см, в возрасте 40-60 лет 90 см. Висцеральная жировая ткань, в отличие от жировой ткани другой локализации, богаче иннервирована, имеет более широкую сеть капилляров и непосредственно сообщается с портальной системой. Висцеральные адипоциты имеют высокую плотность  -рецепторов (особенно 3 типа), кортикостероидных и андрогенных рецепторов и относительно низкую плотность
-рецепторов (особенно 3 типа), кортикостероидных и андрогенных рецепторов и относительно низкую плотность  -адренорецепторов и рецепторов к инсулину. Эти особенности определяют высокую чувствительность висцеральной жировой ткани к липолитическому действию катехоламинов и низкую – к антилиполитическому действию инсулина (особенно в постпрандиальный период), обеспечивая хорошую восприимчивость к гормональным изменениям, часто сопровождающим абдоминальное ожирение.
-адренорецепторов и рецепторов к инсулину. Эти особенности определяют высокую чувствительность висцеральной жировой ткани к липолитическому действию катехоламинов и низкую – к антилиполитическому действию инсулина (особенно в постпрандиальный период), обеспечивая хорошую восприимчивость к гормональным изменениям, часто сопровождающим абдоминальное ожирение.
Гормональные нарушения, сопутствующие висцерально-абдоминальному ожирению:
· повышение кортизола
· повышение тестостерона и андростендиона у женщин
· снижение прогестерона
· снижение тестостерона у мужчин
· снижение соматотропного гормона
· повышение инсулина
· повышение норадреналина
Гормональные нарушения в первую очередь способствуют отложению жира преимущественно в висцеральной области, а так же непосредственно или опосредованно – развитию инсулинорезистентности и метаболических нарушений.
Важную роль в развитии и прогрессировании инсулинорезистентности играет сама висцеральная жировая ткань. Экспериментальные и клинические исследования показали прямую зависимость между степенью развития абдоминально-висцеральной жировой ткани и выраженностью инсулинорезистентности.
Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК), преимущественно в портальную систему и печень. В печени СЖК препятствуют связыванию инсулина гепатоцитами, обусловливая развитие инсулинорезистентности на уровне печени, снижение экстракции инсулина печенью и развитие системной гиперинсулинемии.
В свою очередь, гиперинсулинемия через нарушение ауторегуляции инсулиновых рецепторов усиливает периферическую инсулинорезистентность. СЖК также подавляют тормозящее действие инсулина на глюконеогенез, способствуя увеличению продукции глюкозы печенью. В мышечной ткани СЖК, конкурируя с субстратом в цикле глюкоза – ЖК, препятствуют утилизации глюкозы миоцитами, что так же способствует развитию гипергликемии и компенсаторной гиперинсулинемии.
Как показали исследования последних лет, жировая ткань обладает ауто-, пара- и эндокринной функцией и секретирует большое количество веществ, обладающих различными биологическими эффектами, которые могут вызвать развитие сопутствующих ожирению осложнений, в том числе и инсулинорезистентности.
Наиболее изученными на сегодняшний день являются ФНО- 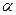 и лептин. Многие исследователи рассматривают ФНО-
и лептин. Многие исследователи рассматривают ФНО- 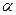 , как медиатор инсулинорезистентности при ожирении. Экспрессия ФНО-
, как медиатор инсулинорезистентности при ожирении. Экспрессия ФНО- 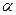 более всего выражена в адипоцитах висцеральной жировой ткани. ФНО-
более всего выражена в адипоцитах висцеральной жировой ткани. ФНО- 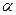 снижает активность тирозинкиназы инсулинового рецептора и фосфорилирование тирозина субстрата инсулинового рецептора, а также тормозит экспрессию внутриклеточных переносчиков глюкозы ГЛЮТ-4 в мышечной и жировой ткани. Как показано in vivo, ФНО-
снижает активность тирозинкиназы инсулинового рецептора и фосфорилирование тирозина субстрата инсулинового рецептора, а также тормозит экспрессию внутриклеточных переносчиков глюкозы ГЛЮТ-4 в мышечной и жировой ткани. Как показано in vivo, ФНО- 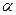 может действовать в синергизме с другими цитокинами, секретируемыми адипоцитами – интерлейкинами-1 и 6, а также стимулировать секрецию лептина.
может действовать в синергизме с другими цитокинами, секретируемыми адипоцитами – интерлейкинами-1 и 6, а также стимулировать секрецию лептина.
Лептин, секретируемый преимущественно адипоцитами, осуществляет свое действие на уровне гипоталамуса, регулируя пищевое поведение и активность симпатической нервной системы, а также ряд нейроэндокринных функций. Участие лептина в регуляции обмена глюкозы интенсивно изучается. Многими исследованиями показано, что в печени он может тормозить действие инсулина на глюконеогенез, путем влияния на активность фосфоэнолпируваткарбоксикиназы – фермента, ограничивающего скорость глюконеогенеза. В некоторых исследованиях было обнаружено, что лептин может оказывать тормозящее влияние на фосфорилирование тирозина – субстрата ИРС-1 в мышечной ткани. В жировой ткани лептин может подавлять стимулированный инсулином транспорт глюкозы (аутокринное действие). Показана не зависящая от ИМТ положительная корреляция между продукцией лептина, гиперинсулинемией и инсулинорезистентностью. Однако имеется несколько сообщений о том, что лептин способен повышать поглощение глюкозы жировыми клетками.
Из внешних факторов, неблагоприятно влияющих на чувствительность тканей к инсулину, наибольшее значение имеют гиподинамия и избыточное потребление жира. Гиподинамия сопровождается снижением транслокации транспортеров глюкозы (ГЛЮТ-4) в мышечных клетках. Примерно у 25% лиц, ведущих малоподвижный образ жизни, можно обнаружить инсулинорезистентность.
Избыточное потребление животных жиров, содержащих насыщенные ЖК, приводит к структурным изменениям фосфолипидов мембран клеток и нарушению экспрессии генов, контролирующих проведение инсулинового сигнала внутрь клетки, т. е. к развитию инсулинорезистентности (ИР). Гипертриглицеридемия, в особенности постпрандиальная, часто наблюдаемая у пациентов с абдоминальным типом ожирения, сопровождается избыточным отложением липидов в мышцах, которое нарушает активность ферментов, участвующих в метаболизме глюкозы. Иначе говоря, вызывает ИР.
Основные клинические симптомы и проявления метаболического синдрома (МС):
· абдоминально-висцеральное ожирение
· инсулинорезистентность и гиперинсулинемия
· дислипопротеинемия
· артериальная гипертензия
· нарушение толерантности к глюкозе/СД 2 типа
· ранний АС/ИБС
· нарушение гемостаза (гиперагрегация)
· гиперурикемия и подагра
· микроальбуминурия
· гиперандрогения
Практически все составляющие метаболического синдрома (МС) являются установленными факторами риска развития сердечно-сосудистных (СС) заболеваний, а их сочетание многократно ускоряет их развитие. Причем сочетание отдельных компонентов синдрома могут рассматриваться в рамках МС только при наличии ИР.
Нарушения, объединенные рамками МС, а также дисгормональные изменения и ранние стадии ожирения длительное время протекают бессимптомно, нередко начинают формироваться в подростковом и юношеском возрасте, задолго до клинической манифестации СД 2 типа, АГ и атеросклеротических поражений сосудов. Наиболее ранними проявлениями МС являются дислипопротеинемия и АГ. Разумеется не все компоненты МС встречаются одновременно. Каким фенотипом проявится МС, зависит от взаимодействия факторов генетических и внешней среды.
В условиях ИР при абдоминально-висцеральном ожирении, вследствие изменения активности липопротеинлипазы и печенечной триглицеридлипазы, замедляется распад липопротеинов, богатых триацилглицеридами, развивается гипертриацилглицеридемия, что приводит к обогащению триацилглицеридами ЛВП и липопротеинов низкой плотности (ЛПНП); происходит увеличение концентрации мелких плотных частиц ЛПНП и снижение уровня холестерола ЛПВП плазмы. Избыточное поступление СЖК в печень способствует усилению синтеза триацилглицеридов и секреции ЛПОНП и аполипопротеина В.
В целом дислипопротеинемия при абдоминально-висцеральном ожирении характеризуется:
· повышением уровня СЖК
· гипертриацилглицеридемией
· снижением холестерола ЛПВП
· повышением холестерола ЛПНП
· увеличением содержания мелких плотных частиц ЛНП
· повышением уровня аполипопротеина В
· увеличением соотношения холестерола ЛПНП/холестерола ЛПВП
· выраженным постпрандиальным подъемом уровня липопротеинов, богатых триацилглицеридами.
Наиболее частым вариантом дислипопротеинемии при МС является липидная триада: сочетание гипертриацилицеридемии, низкого уровня холестерола ЛПВП и повышением фракции мелких плотных частиц ЛПНП.
Наличие такой триады у пациентов без СД 2 типа увеличивает риск развития коронарной болезни сердца в 3-5 раз.
Для больных с висцеральным ожирением характерно также сочетание гиперинсулинемии, повышение аполипопротеина В и фракции мелких плотных частиц ЛПНП, которое выделяют под названием атерогенной метаболической триады. Наличие такой триады увеличивает риск развития сердечно-сосудистых заболеваний в 20 раз. Маркерами этой триады являются окружность талии >90 см и уровень триглицеридов >2,3 ммоль/л.
Нарушения метаболизма липопротеинов в постпрандиальный период, сопровождающие абдоминальное ожирение, как показали исследования, способствуют раннему развитию ИБС.
В последние годы многие исследователи придают большое значение гипертриацилглицеридемии, особенно в постпрандиальный период, как фактору, ускоряющему развитие сердечно-сосудистых заболеваний. Имеются сообщения о наличии независимой корреляции между гипертриацилглицеридемией и атеросклерозом сонных артерий.Многие исследования свидетельствуют о том, что гипертриацилглицеридемия, особенно в постпрандиальный период, способствует понижению уровня холестерола ЛПВП, образованию мелких плотных частиц ЛПНП и нарушению гомеостатической системы: повышению факторов VII и ПАИ-1, а также нарушению реологических свойств крови (гиперагрегации).
Нарушения со стороны свертывающей системы крови при метаболическом синдроме характеризуются повышением уровня фибриногена и содержания уровня ингибиторов фибринолиза - фактора VII и ингибитора активатора плазминогена 1 (ПАИ-1). Высокий уровень ПАИ-1, секретируемого преимущественно висцеральной жировой тканью, рассматривается, как один из важнейших параметров метаболического синдрома. Высокий уровень ПАИ-1, как свидетельствуют исследования, является независимым предиктором инфаркта у мужчин с ИБС.Предполагается, что в повышении уровня ПАИ-1 у больных с метаболическим синдромом имеют значение также гиперинсулинемия, гипертриацилглицеридемия и высокий уровень ФНО- 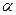 . Показано также, что уменьшение массы висцерального жира сопровождается снижением уровня ПАИ-1.
. Показано также, что уменьшение массы висцерального жира сопровождается снижением уровня ПАИ-1.
Артериальная гипертензия часто является одним из первых клинических проявлений метаболического синдрома. Хотя взаимосвязь между артериальной гипертензией, инсулинорезистентностью и гиперинсулинемией при метаболическом синдроме до сих пор продолжает активно обсуждаться. В развитии артериальной гипертензии при синдроме инсулинорезистентности ведущее значение имеет комплексное влияние гиперинсулинемии и сопутствующих метаболических нарушений.
Основная взимосвязь механизмов воздействия хронической гиперинсулинемии и повышения артериального давления заключается в следующем:
•блокируются трансмембранные ионообменные механизмы (Na+, K+ и Са2+-зависимой АТФазы), повышая тем самым содержание внутриклеточного Na+ и Са2+, уменьшая содержание К+, приводящее к увеличению чувствительности сосудистой стенки к прессорным воздействиям.
•повышается реабсорбция Na+ в проксимальных и дистальных канальцах нефрона, способствуя задержке жидкости и развитию гиперволемии, а также повышению содержания Na+ и Са2+ в стенках сосудов.
•стимулируется пролиферация гладкомышечных клеток сосудистой стенки, влекущая за собой сужение артериол и увеличение сосудистого сопротивления.
•стимулируется активность симпатической нервной системы, что приводит к увеличению сосудистого тонуса.
•стимулируется активность ренин-ангиотензиновой системы.
Все эти эффекты в совокупности способствуют повышению артериального давления.
Инсулинорезистентность и гиперинсулинемия являются одним из основных факторов, ведущих к развитию СД 2 типа, особенно у лиц с наследственной предрасположенностью. Известно, что одними из важнейших последствий инсулинорезистентности являются гиперинсулинемия и гипергликемия. В условиях инсулинорезистентности происходит снижение утилизации глюкозы периферическими тканями, повышается продукция глюкозы печенью, что способствует развитию гипергликемии. При адекватной способности  -клеток реагировать на повышение глюкозы в крови сохраняется состояние нормогликемии. Однако постоянная стимуляция
-клеток реагировать на повышение глюкозы в крови сохраняется состояние нормогликемии. Однако постоянная стимуляция  -клеток в сочетании с вероятными генетическими нарушениями, влияющими на их функциональные возможности, и воздействием повышенной концентрации СЖК на
-клеток в сочетании с вероятными генетическими нарушениями, влияющими на их функциональные возможности, и воздействием повышенной концентрации СЖК на  -клетки (феномен липотоксичности), способствуют развитию секреторной дисфункции
-клетки (феномен липотоксичности), способствуют развитию секреторной дисфункции  -клеток, прогрессирующему нарушению секреции инсулина. С течением времени развивается СД 2 типа.
-клеток, прогрессирующему нарушению секреции инсулина. С течением времени развивается СД 2 типа.
При развитии СД 2 типа возникающая гипергликемия способствует дальнейшему прогрессированию нарушения секреции инсулина  -клетками (феномен глюкозотоксичности) и усугублению периферической инсулинорезистентности.
-клетками (феномен глюкозотоксичности) и усугублению периферической инсулинорезистентности.
При синдроме инсулинорезистентности развивается дисфункция эндотелия сосудов и, в частности, нарушается синтез оксида азота в сосудистой стенке (оксид азота является мощным вазодилататором). Он оказывает сдерживающее влияние на пролиферацию гладкомышечных клеток, тормозит адгезию моноцитов к эндотелию сосудистой стенки, снижает перекисное окисление липидов, т.е. предохраняет стенки сосудов от повреждения. Поэтому развивающаяся дисфункция эндотелия способствует ускорению развития атеросклеротических повреждений сосудов, что и подтверждено многочисленными исследованиями. По данным литературы, среди больных с метаболическим синдромом смертность от ИБС в 2-3 выше, чем в общей популяции.
Таким образом, инсулинорезистентность, гиперинсулинемия и ожирение при метаболическом синдроме самостоятельно или опосредованно (через сопутствующие метаболические нарушения), оказывая патологическое воздействие на сердечно-сосудистую систему, в конечном итоге ускоряют развитие атеросклеротических сосудистых заболеваний (ИБС и ОИМ).
Диагностика.
По данным литературы, среди больных с метаболическим синдромом смертность от ИБС в 2-3 выше, чем в общей популяции. Поэтому ранняя диагностика метаболического синдрома и ожирения - это в первую очередь профилактика, предупреждение или отсрочка манифестации СД 2 и атеросклеротических сосудистых заболеваний. Важно разработать оптимальную схему ранней диагностики и выявления больных, относящихся к группе высокого риска развития метаболического синдрома.
Наиболее точными и доступными показателями, которые можно использовать при обследовании больных без клинических проявлений синдрома, являются:
· величина окружности талии, как маркер абдоминально-висцерального ожирения;
· уровень триацилглицеридов, как показатель, коррелирующий с наличием мелких плотных частиц ЛПНП;
· уровень аполипротеина В, как показатель атерогенных липопротеидов (при отсутствии возможности его определения, вычисляется коэффициент атерогенности - отношение холестерола ЛПНП/холестерола ЛПВП);
- уровень инсулина натощак, как косвенный показатель инсулинорезистентности.
Оценке степени риска развития сопутствующих абдоминально-висцеральному ожирению нарушений и осложнений помогает тщательно собранный семейный и социальный анамнез, позволяющий выявить пациентов с наследственной предрасположенностью и особенностями образа жизни, предопределяющими развитие метаболического синдрома.
Схема обследования больных на стадии доклинических проявлений:
• выявление наследственной предрасположенности к ожирению, СД, ИБС, АГ;
• социальный анамнез (особенности образа жизни, пищевые привычки);
• антропометрические измерения (рост, вес, ИМТ, объем талии, бедер, ОТ/ОБ);
• мониторинг артериального давления, ЭКГ - исследование;
• определение биохимических показателей уровня триацтлглицеридов, холестерола ЛПВП, холестерола ЛПНП, апо-В плазмы;
• определение глюкозы крови натощак;
• инсулина крови натощак;
• по показаниям - проведение глюкозо-толерантного теста.
Выделяют полную и неполную формы метаболического синдрома. Наличие 2-3 составляющих свидетельствует о неполной форме, более 4-х нарушений - о полной форме метаболического синдрома. Возможно сочетание метаболического синдрома с ожирением и другими заболеваниями.
При наличии поздних проявлений метаболического синдрома, таких как нарушение толерантности к глюкозе или СД 2 типа, диагноз метаболического синдрома можно поставить при наличии двух из нижеперечисленных признаков метаболического синдрома:
· ОТ/ОБ у мужчин >0,9, у женщин >0,85,
· АД > 160/9 мм рт. ст.,
· триацилглицериды >1,7 ммоль/л,
· микроальбуминурия >20 мг/сут,
· холестерол ЛПВП <0,9 у мужчин и <1,0 ммоль/л у женщин.
Методы оценки инсулинорезистентности и гиперинсулинемии и биохимические критерии метаболического синдрома.
Как уже отмечалось, в основе развития ожирения и метаболического синдрома лежит резистентность тканей к инсулину. "Золотым стандартом" измерения чувствительности тканей к инсулину является эугликемический гиперинсулинемический "клэмп"-тест (дословный перевод "зажим", "защепка"). При данной методике осуществляется постоянная инфузия инсулина в дозе 1 мЕд/мин/кг в течение 2 ч. Одновременно проводится инфузия глюкозы в дозе, которая обеспечивала бы поддержание ее концентрации в плазме крови на эугликемическом уровне. Два часа необходимы для достижения равновесного состояния, когда скорость введения глюкозы становится равна скорости ее потребления организмом. В этом состоянии осуществляется расчет общего потребления глюкозы организмом в мл/мин/кг на 1 мкЕд инсулина, которое и характеризует чувствительность тканей к инсулину. Из-за инвазивности, дороговизны и методической сложности данный метод рекомендован для использования только в специальных научных исследованиях и не подходит для широкого клинического применения.
Предложено несколько модификаций теста с внутривенной инфузией глюкозы с последующим введением толбутамида для подавления эндогенной продукции глюкозы печенью. Количественная оценка инсулинрезистентности проводится по величине клиренса глюкозы отнесенной к степени гиперинсулинемии, вызванной введением глюкозы. Данный метод дает менее точные результаты, нежели "клэмп"-тест но не менее трудоемок и дорог, чем последний.
В клинической практике в настоящее время применяется в основном пероральный тест оценки толерантности к глюкозе (нагрузка 75 г глюкозы) с определением концентрации не только глюкозы, но и иммунореактивного инсулина (ИРИ) в плазме крови. С помощью перорального теста определяется не резистентность тканей к инсулину, а наличие и степень выраженности гпперинсулинемии. Однако, именно гиперинсулинемия является центральным звеном в патогенезе развития основных клинических проявлений метаболического синдрома. С другой стороны, наличие резистентности к инсулину удается выявить с помощью "клэмп"-теста примерно у 25% практически здоровых людей. Поэтому, с точки зрения клинической диагностики, выявление гиперинсулинемии представляется даже более важным, чем собственно инсулинорезистентности.
К сожалению, сегодня не существует единых общепринятых критериев
гиперинсулинемии. Различные авторы предлагают считать гиперинсулинемией состояние, когда концентрация ИРИ в плазме крови утром натощак превышает 25 мкЕд/мл. В качестве критерия гиперинсулинемии рекомендуется также считать уровень содержания ИРИ более 25 - 28 мкЕд/мл через 2 ч. после нагрузки глюкозой до 200 мкЕд/мл.
Предложены и более сложные расчетные показатели, характеризующие инсулиновый ответ: площадь под инсулиновой кривой, которая равна сумме концентраций ИРИ плазмы крови до начала перорального теста, а также через 30, 60, 90 и 120 мин. после приема глюкозы; индекс Haffher, который рассчитывается как сумма концентраций ИРИ плазмы крови, определенных через определенные промежутки времени после приема глюкозы и умноженных на соответствующие коэффициенты: 0,25 (исход) + 0,5 (30 мин) + 0,75 (1 ч.) + 0,5 (2 ч.).
Дополнительную трудность в унификации критериев гиперинсулинемии создает то обстоятельство, что абсолютный уровень ИРИ зависит также от метода определения и наборов, при помощи которых это определение производится. Диагностическая ценность перорального теста в диагностике метаболического синдрома возрастает, если наряду с концентрацией глюкозы и ИРИ определять еще и уровень С-пептида в плазме крови. В качестве критериев метаболического синдрома автор предлагает концентрации С-пептида более 1,2 нмоль/л до начала теста и более 1,4 нмоль/л через 2 ч. после приема 75 г глюкозы.
Достаточно достоверным критерием наличия инсулинорезистентности является снижение отношения концентрации глюкозы крови (в мг/дл) к уровню ИРИ (в мкЕд/мл) ниже 6 (при измерении концентрации глюкозы в ммоль/л количественным критерием является значение 0,33. Глюкоза ммоль/л, ИРИ мкЕд/мл, норма (верх 5:5=1) – низ (5:15)=33.
В настоящее время все авторы оценивают состояние углеводного обмена по критериям предложенным Американской ассоциацией диабета. Согласно им, углеводный обмен считается нормальным, если уровень содержания глюкозы в плазме венозной крови натощак составляет менее 6,7 ммоль/л, а через 2 ч. после нагрузки 75 г глюкозы - менее 7,8 ммоль/л. Если же уровень глюкозы натощак менее 6,7 ммоль/л, но через 2 ч. наводится в пределах от 7,8 до 11,1 ммоль/л, то это состояние классифицируют как нарушение толерантности к глюкозе. Если же уровень глюкозы плазмы крови превышает 6,7 ммоль/л натощак и/или превышает 11,1 ммоль/л через 2 ч, то ставится диагноз сахарный диабет.
АГ при ИР отличается механизмом формирования "гипертонического сердца". Особенностями его является развитие избыточной гипертрофии ЛЖ,неадекватной уровню АД. Важнейшим клиническим проявлением гипертонического «гипертонического сердца» при этом служит развитие на поздних стадиях пароксизмальной мерцательной аритмии.
Особенностью АГ при метаболическом синдроме является относительно умеренная гипертензия с отсутствием адекватного снижения АД в ночные часы.
На сегодня установлена положительная связь между "ночной" АГ, частотой и выраженностью микроальбуминурии (наиболее раннего маркера поражения почек). Именно это сочетаниеявляется независимым фактором риска развития гипертрофии левого желудочка, инсульта, инфаркта. Относительный риск смерти от сердечно-сосудистых заболеваний,когда ночное снижение АД отсутствует, составляет 6,26 против риска 3,70 при типичном профиле АД.
Лечение.
Цели лечения больных с метаболическим синдромом и ожирение - максимальное снижение общего риска сердечно-сосудистой заболеваемости и летальности.
Предполагается, что улучшение чувствительности к инсулину и уменьшение хронической гиперинсулинемии у лиц без клинических проявлений синдрома способны предотвратить клиническую манифестацию синдрома, а при развившихся клинических проявлениях снизить тяжесть их течения. В связи с тем, что избыточное накопление висцеральной жировой ткани является одним из основных патогенетических факторов формирования синдрома инсулинорезистентности, ведущее место в комплексном лечении больных должны занимать мероприятия, направленные на уменьшение массы абдоминально-висцерального жира. Это прежде всего рациональное питание. Рацион составляется с учетом массы тела, возраста, пола, уровня физической активности и пищевых пристрастий больных. Ограничивается потребление жира до 25-30% от суточной нормы калорий (уменьшение поступление насыщенных жиров до 8-10% от общего количества жира, полиненасыщенных - менее 10%, мононенасыщенных - 15% от нормы потребления жира). Снижение потребления холестерина до 250 мг в сутки. Ограничение потребления быстроусвояемых углеводов. Введение в рацион большого количества пищевых волокон. Снижение потребления алкоголя, отказ от курения, увеличение физической активности.
Снижение массы тела на 10-15% от исходной сопровождается уменьшением массы висцеральной жировой ткани. Это, как правило, приводит к улучшению чувствительности к инсулину, уменьшению системной гиперинсулинемии, улучшению показателей липидного и углеводного обмена, снижению артериального давления.
Однако применяя только немедикаментозные методы лечения (даже на фоне снижения массы тела и висцерального жира в том числе), не всегда удается компенсировать нарушения липидного и углеводного обмена и уменьшить инсулинорезистентность и гиперинсулинемию. Поэтому при лечении больных с метаболическим синдромом активно применяется медикаментозная терапия, особенно включение в арсенал средств терапии медикаментозных препаратов, способных воздействовать на инсулинорезистентность.
Многочисленными работами показано, что метформин улучшает чувствительность периферических тканей к инсулину, способствует торможению процессов глюконеогенеза и гликогенолиза в печени. Препарат способствует снижению системной гиперинсулинемии. Показано также гиполипидемическое, гипотензивное действие метформина и его влияние на фибринолитическую активность крови. Имеются сообщения об успешном применении препарата в лечении больных с метаболическим синдромом без НТГ и СД 2 типа.
Для ускорения снижения массы тела, улучшения показателей липидного и углеводного обмена применяется препарат орлистат (Ксеникал). Оказывая тормозящее влияние на липазу желудочно-кишечного тракта, препарат препятствует расщеплению и последующему всасыванию пищевых жиров. Показано также, что на фоне применения препарата уменьшается масса висцерально-абдоминального жира, улучшается чувствительность тканей к инсулину, уменьшается гиперинсулинемия.
Больным с выраженной дислипопротеинемией, неподдающейся коррекции диетотерапией, назначаются гиполипидемические препараты: статины (ловастатин, симвастатин, правастатин) или фибраты (клофибрат). Решение о медикаметозном лечении дислипопротеинемии базируется как на данных определения уровня липидов после соблюдения гиполипидемической диеты не менее 3-6 мес, так и на данных определения суммарной степени риска развития атеросклероза.
При развитии у больных СД 2 типа проводится соответствующее лечение. Назначая симптоматическую терапию (гипотензивными и мочегонными препаратами) больным с метаболическим синдромом, имеющим артериальную гипертензию, необходимо учитывать влияние этих препаратов на показатели липидного и углеводного обменов.
Применение тиазидовых и петлевых диуретиков в высоких дозах может привести к повышению уровня триацилглицеридов, общего холестерола и холестерола ЛПНП. Эти нежелательные эффекты диуретиков могут быть нивелированы назначением их в низких дозах в сочетании с диетой.  -блокаторы, особенно неселективные, в высоких дозах могут увеличивать уровень триацилглицеридов, приводить к усугублению инсулинорезистентности, развитию дислипопротеинемии и снижению уровня холестерола ЛПВП. Поэтому предпочтительны ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы кальциевых каналов,
-блокаторы, особенно неселективные, в высоких дозах могут увеличивать уровень триацилглицеридов, приводить к усугублению инсулинорезистентности, развитию дислипопротеинемии и снижению уровня холестерола ЛПВП. Поэтому предпочтительны ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы кальциевых каналов, 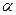 -адреноблокаторы, селективные
-адреноблокаторы, селективные  -блокаторы.
-блокаторы.
Следует учитывать, что при наличии у больного высокого суммарного риска развития СД 2 типа или сердечно-сосудистых заболеваний используется весь комплекс немедикаментозных и медикаментозных мероприятий.
Стадии развития метаболического синдрома в сочетании с дисгоромональным дисгармональными нарушениями и ожирением.
Отсутствие метаболического синдрома (0 стадия) характеризуется нормальными ТТГ, уровнем ИРИ натощак, через 2 ч после нагрузки и суммарным инсулиновым ответом.Первая стадия синдрома - стадия компенсированной гиперинсулинемии. При данной стадии гиперинсулинемия выявляется только в виде увеличения величины площади под инсулиновой кривой. Остальные показатели остаются нормальными. Обычно на этой стадии отмечаются один, максимум два компонента синдрома.
Вторая стадия - стадия субкомпенсированной гиперинсулинемии. Для нее характерен не только повышенный суммарный инсулиновый ответ, но и повышенный уровень ИРИ через 2 ч после нагрузки. В то же время, нормальный уровень ИРИ натощак свидетельствует о том, что гиперинсулинемия не является постоянной, уровень гормона может понижаться до нормального уровня.
В клинической картине обычно имеют место 2-3 компонента синдрома. Поэтому говорить о "субкомпенсации" можно лишь пока, "поджелудочная железа не прошла верхнюю точку своей старлинговской кривой".
Во второй стадии выделяют 2 периода - А и Б. Стадия ПА характеризуется полностью компенсированным углеводным обменом (ТТГ нормальный). Однако, у некоторых лиц может отмечаться уже и нарушение толерантности к глюкозе - это признак ПБ стадии.
Третья стадия - стадия декомпенсации. Гиперинсулинемия носит постоянный характер, но и этого уже не достаточно для поддержания нормального обмена глюкозы.
В данной стадии также следует выделить 2 периода - А и Б. В стадии IIА поджелудочная железа еще в состоянии синтезировать повышенное количество гормона, хотя этого количества и недостаточно для поддержания нормального углеводного обмена. В стадии IIБ в результате длительной чрезмерной нагрузки происходит уже деградация  -клеток островкового аппарата железы, их секреторная способность падает. "Нормализация" показателей инсулинового обмена отражает не нормализацию тканевой чувствительности к инсулину, а полное истощение функциональных возможностей поджелудочной железы.
-клеток островкового аппарата железы, их секреторная способность падает. "Нормализация" показателей инсулинового обмена отражает не нормализацию тканевой чувствительности к инсулину, а полное истощение функциональных возможностей поджелудочной железы.
Разделение стадии на два периода оправдано еще и тем, что они могут требовать различных терапевтических подходов.
Итак, проблема ожирения и метаболического синдрома - одна из важнейших в современной клинике внутренних болезней. Широкое профилактика метаболического синдрома и ожирения могут привести к снижению заболеваемости и смертности от сердечно-сосудистой патологии в будущем.
Список литературы.
1. Reaven G.M. Role of insulin resistance in human disease.// Diabetes.-1988 -V. 37.-P.1595-1607.
2. Kaplan N.M. The deadly quartet: upper-body obesity, glucose intolerance, hypertriglyceridemia and hypertension. //Arch.Intern. Med.-1989.-V.149.-P.1514 - 1520.
3. Haffner S.M., Valdez R.A., Hazuda H.P. et al. Prospective an alyses of the insulin resistance syndrome (Syndrome X).// Diabetes.-1992.-V. 41.-P. 715 - 722.
4. Resnick L.M. Ionic basis of hypertension, insulin resistance, vascular disease and related disorders.//Am. J. Hypertens.-1993.-V.6.-P. S123 - S134.
5. Henefeld M., Leonhardt W. Das metabolische Syndrome. Deutsch.// Ges. Wes.-1980.-V. 36.-P. 545 - 551.
6. Williams B. Insulin resistance: the shape of things to come. //Lancet- 1994.-V. 344.-P. 521 – 524
7. Биохимия. Учебник/Под ред. Е.С. Северина .- 2-е изд., испр. – М.: ГЭОТАР – МЕД. 2004.- 784с.
8. Еганян Р.А. , Калинина А.Н. Коррекция избыточной массы тела – необходимое условие профилактики сердечно–сосудистых заболеваний. Журнал "Медицинская сестра" № 2 2003 год
9. Зимин Ю.В. Происхождение, диагностическая концепция и клиническое значение синдрома инсулинорезистентности или метаболического синдрома X. //Кардиология -1998.-N. 6.-с. 71-81.
Дата добавления: 2022-01-22; просмотров: 29; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
