Лекция 8. Карбонильные соединения (оксосоединения)
Лекция 7. Многоатомные спирты
Важнейшие из многоатомных спиртов – этиленгликоль и глицерин:
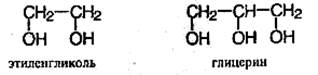
Это – вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):

2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
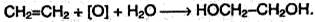
3. Глицерин образуется при гидролизе жиров.
Химические свойства
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами , а трехатомных – глицератами .
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко-синее окрашивание при действии свежеосажденного гидроксида меди (II).
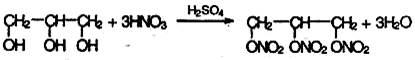
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NО2 непосредственно связана с атомом углерода):
Применение
|
|
|
Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах его используют также для получения диоксана, важного (хотя и токсичного) лабораторного растворителя.
Глицерин находит широкое применение в косметике, пищевой промышленности, фармации, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита – взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать.
Фенолы
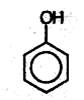 Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Названияфенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Простейший представитель этого класса – собственно фенол, С6Н5ОН.
|
|
|
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров: орто -, мета- и пара-крезолов:
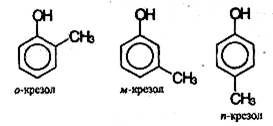
Физические свойства
Фенолы в большинстве своем – кристаллические вещества (мета-крезол– жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде, но хорошо в горячей и особенно в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения и плавления. Так, собственно фенол представляет собой бесцветные кристаллы с tпл = 41 °С и tкип = 182 °С. С течением времени кристаллы краснеют и темнеют.
Способы получения
1. Получение из галогенбензолов:
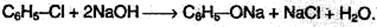
2. При каталитическом окислении изопропилбензола (кумола):
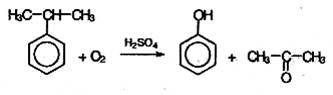
Это – основной промышленный способ получения фенола.
Химические свойства
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как со щелочными металлами:
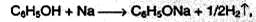
так и с их гидроксидами (отсюда старинное название «карболовая кислота»):
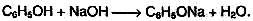
 Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
|
|
|
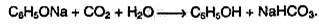
2. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах:
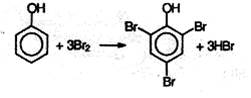
Взаимодействие с бромной водой – качественная реакция на фенол.
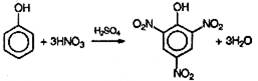
При нитровании фенола нитрующей смесью три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола:
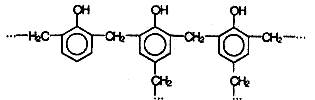
Применение
Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других ценных веществ. Пикриновую кислоту применяют в промышленности в качестве взрывчатого вещества. Крезолы используют как вещества с сильным дезинфицирующим действием.
Лекция 8. Карбонильные соединения (оксосоединения)
Номенклатура и изомерия
Органические соединения, в молекуле которых имеется карбонильная группа 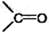 , называют карбонильными соединениями, или оксосоединениями . Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом:
, называют карбонильными соединениями, или оксосоединениями . Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом:
|
|
|
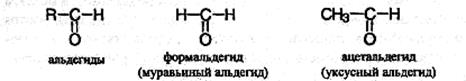
метаналь этаналь
а в молекулах кетонов – с двумя углеводородными радикалами:
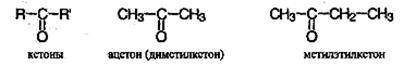
Для альдегидов часто используют тривиальные названия, например формальдегид Н2С=О. По международной номенклатуре названия альдегидов образуют, прибавляя окончание -аль к названию углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи.
Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, например метилэтилкетон СН3-СО-СН2-СН3. По международной номенклатуре к названию предельного углеводорода добавляют окончание -он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к карбонильной группе конца цепи, например: метилэтилкетон – это то же самое, что бутанон-2. Общая формула предельных альдегидов и кетонов СnН2nО.
Физические свойства
Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. Низшие альдегиды и кетоны – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Получение
1. Гидратация алкинов. Из ацетилена получают альдегид, из его гомологов – кетоны:
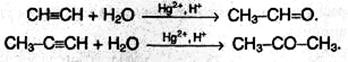
2. Общий способ получения карбонильных соединений – окисление спиртов. В качестве окислителя можно использовать, например, оксид меди (II) при нагревании:
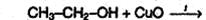
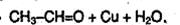
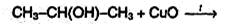
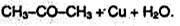
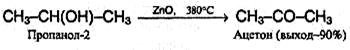
3. Дегидрирование спиртов. Одним из промышленных способов получения альдегидов и кетонов является дегидрирование спиртов в газовой фазе над металлическими медью, серебром, и др., например:
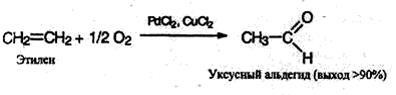
4. Окисление алкенов:
Химические свойства
Альдегиды и кетоны – химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму нуклеофильного присоединения. Самый активный из альдегидов – формальдегид Н2СО.
Важнейшие реакции присоединения:
Реакции восстановления:
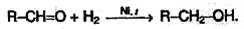
Кетоны в аналогичной реакции дают вторичные спирты.
Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Кетоны к действию окислителей инертны, в частности, они не окисляются кислородом воздуха.
Реакция «серебряного зеркала» – это окисление альдегидов аммиачным раствором оксида серебра, иногда эту реакцию записывают в упрощенном виде:
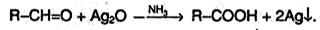
Реакции поликонденсации - см. схему реакции фенола с формальдегидом.
Применение
Формальдегид – газ с резким раздражающим запахом. 40% водный раствор формальдегида называется формалином. Формальдегид получают в промышленности в крупных масштабах окислением метана или метанола. При нагревании формальдегида с аммиаком А.М. Бутлеров синтезировал сухое горючее (уротропин): (СН2)6N4 Формальдегид обладает бактерицидным действием и применяется в качестве дезинфицирующего средства для обработки зерно- и овощехранилищ, для протравливания семян, для консервации анатомических препаратов. На основе реакции поликонденсации формальдегида с фенолом получают фенолформальдегидные смолы, с мочевиной – карбамидные смолы.
Ацетон – бесцветная жидкость с характерным запахом, смешивается с водой во всех соотношениях, хороший растворитель органических веществ. Ацетон используют как растворитель лаков, красок, в производстве ацетатного волокна, бездымного пороха и других химических продуктов.
 Лекция 9. Карбоновые кислоты
Лекция 9. Карбоновые кислоты
Номенклатура и изомерия
Карбоновыми кислотами называют соединения, содержащие карбоксильную группу
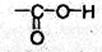
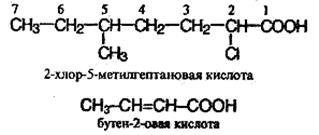
В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.  Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
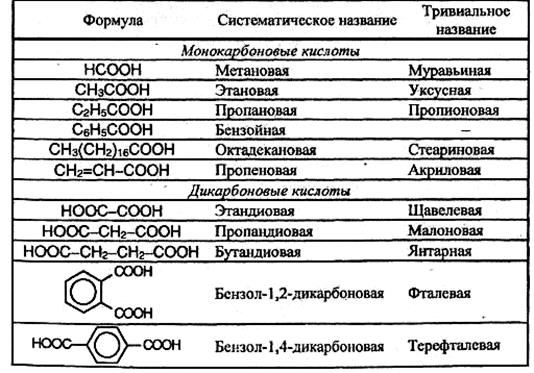
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами; кислотные свойства имеет фенолы.
У карбоновых кислот возможны следующие основные виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
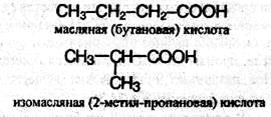
2. Изомерия положения кратной связи, например:
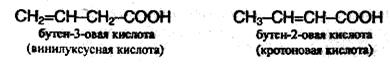
3. Цис- транс- изомерия, например.
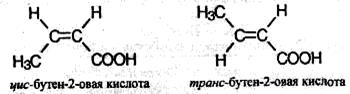
4. Межклассовая изомерия: например, масляной кислоте (СН3СН2СН2СООН) изомерны метиловый эфир пропановой кислоты (СН3СН2-СО-О-СН3) и этиловый эфир уксусной кислоты (СН3-СО-О-СН2СН3).
Физические свойства
Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда – вязкие, «маслообразные» жидкости; начиная с С10 – твердые вещества. Кислоты, содержащие 1-3 атома углерода, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
Получение
1. Окисление первичных спиртов:
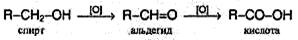
2. Другой общий способ – гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
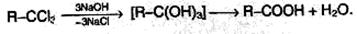
3. Гидролиз сложных эфиров:
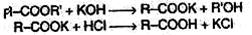
4. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
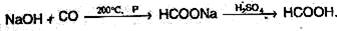
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
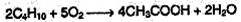
Для получения бензойной кислоты используют окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
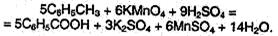
Химические свойства
В водном растворе карбоновые кислоты диссоциируют:
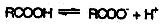
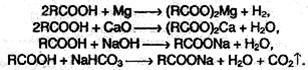
1. Образование солей. Карбоновые кислоты реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
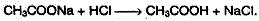
Соли карбоновых кислот в водных растворах гидролизованы:
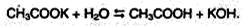
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
2. Образование функциональных производных карбоновых кислот.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
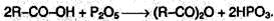
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
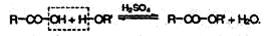
3. Окислительно-восстановительные реакции карбоновых кислот
:
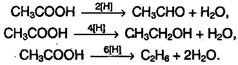
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
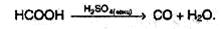
Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она дает реакцию «серебряного зеркала», в упрощенном виде:
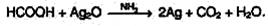
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
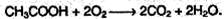
4. Реакции декарбоксилирования . Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании:
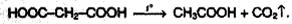
Применение
Насыщенные кислоты. Муравьиная кислота НСООН. Название связано с тем, что кислота содержится в выделениях муравьев. Широко применяется в фармацевтической и пищевой промышленности.
Уксусная кислота СН3СООН. Консервирующее действие кислоты связано с подавлением развития гнилостных бактерий и плесневых грибков. Основную часть производимой уксусной кислоты используют для производства искусственных волокон на основе целлюлозы.
Пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты входят в состав животных жиров и растительных масел. Натриевые и калиевые соли этих кислот входят в состав мыла.
Щавелевая кислота НООС-СООН. Широко распространена в растительном мире. Применяется в текстильной и кожевенной промышленности.
Ненасыщенные кислоты. Одной из наиболее распространенных во многих растениях и организмах животных является олеиновая кислота; она содержится в оливковом масле (от которого и произошло ее название), а также в свином жире. Особенно нужно подчеркнуть роль линоленовой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в день). Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза.
Ароматические кислоты. Бензойная кислота широко распространена в природе. Применяют в фармацевтической промышленности для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов. Фталевые кислоты находят широкое применение в производстве высокомолекулярных соединений.
Гетерофункциональные кислоты. Наиболее известные представители оксокислот – молочная, яблочная (гидроксибутандиовая), лимонная (2-гидроксипропан-1,2,3-трикарбоновая) и салициловая (2-гидроксибензойная). Яблочная и лимонная кислоты являются метаболитами цикла Кребса, который также называют циклом лимонной кислоты. Молочная кислота образуется в мышцах человека и животных при интенсивной мышечной работе. Молочная кислота образуется при молочнокислом брожении:

Такие процессы идут при квашении капусты, приготовлении сыра, силосовании кормов. Молочная кислота используется как консервирующее средство в пищевой промышленности. Она применяется также в текстильной промышленности, в кожевенном производстве, как исходное вещество во многих синтезах. Яблочная и лимонная кислоты применяются в пищевой промышленности. Лимонная кислота находит применение в медицине, входит в состав комбинированного препарата «цитрамон» и других лекарственных средств. 5% раствор цитрата натрия используется для консервирования крови.
Дата добавления: 2022-01-22; просмотров: 19; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
