Понятие о физико-химическом анализе. Термический анализ
Основные понятия и определения
Гетерогенной называется система, состоящая из нескольких фаз.
Фазой называется совокупность гомогенных частей системы, одинаковых по составу, химическим и физическим свойствам и ограниченных от других частей поверхностью раздела. Например, смесь двух кристаллических веществ, различающихся по химическому составу или представляющих собой две полиморфные модификации вещества одного химического состава, является гетерогенной двухфазной системой. Или, например, кристаллы вещества, находящиеся в равновесии с насыщенным водным раствором этого же вещества.
По числу фаз системы делят на однофазные, двухфазные, трехфазные и многофазные. Жидкие и твердые фазы называются конденсированными. Равновесие в системе, состоящей из нескольких фаз, называется фазовым, или гетерогенным, равновесием.
Составляющие вещества системы - это вещества, которые можно выделить из системы в индивидуальном виде. Например, нитрат калия KNO3 в воде существует в виде ионов K+ и NO3-. Однако, составляющими веществами системы являются KNO3 и H2O, т.к. ионы не могут существовать отдельно, не могут быть выделены в чистом виде вне системы.
Числом независимых компонентов в системе называется наименьшее число составляющих веществ, с помощью которых можно охарактеризовать как состав каждой фазы, так и состав системы в целом.
Термодинамические системы можно условно разделить на физические и химические. В физических системах происходят фазовые превращения, в химических - химические реакции.
|
|
|
Число независимых компонентов в физических системах равно числу составляющих веществ. В химических системах число независимых компонентов меньше количества составляющих веществ на число уравнений, связывающих их равновесные концентрации (или парциальные давления).
При одном и том же числе составляющих веществ системы число независимых компонентов может быть разным. Рассмотрим в качестве примеров число независимых компонентов в двух гетерогенных системах, полученных в результате термического разложения NH4Cl(т) и CaCO3(т):
NH4Cl(т) = NH3(г) + HCl(г) и CaCO3(т) = CaO(т) + CO2(г) (4.1)
В первом случае гетерогенная система состоит из твердого исходного вещества NH4Cl(т) и двух газообразных продуктов реакции: NH3(г) и HCl(г). Число независимых компонентов системы равно единице, так как равновесные парциальные давления составляющих веществ системы могут быть связаны между собой двумя уравнениями: 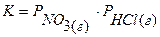 (по закону действующих масс) и
(по закону действующих масс) и 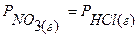 . Если система образована произвольными количествами всех трёх компонентов, то число независимых компонентов такой гетерогенной системы равно двум. Один из них – это твердый компонент, второй – любой из двух газов (так как содержание второго газообразного вещества находится из условия: сумма мольных долей компонентов в газовой фазе равна единице).
. Если система образована произвольными количествами всех трёх компонентов, то число независимых компонентов такой гетерогенной системы равно двум. Один из них – это твердый компонент, второй – любой из двух газов (так как содержание второго газообразного вещества находится из условия: сумма мольных долей компонентов в газовой фазе равна единице).
|
|
|
При разложении CaCO3(т) продукты реакции находятся в разных фазах, поэтому число независимых компонентов не может быть меньше двух.
Числом термодинамических степеней свободы «С» или вариантностью системы называется наименьшее число независимых термодинамических параметров состояния системы (Р, V, Т, x, y...), произвольное изменение которых в определенных пределах не вызывает изменения числа сосуществующих фаз или их природы.
Правило фаз Гиббса
Правило фаз Гиббса связывает количество фаз в системе, находящейся в равновесном состоянии или в равновесном процессе, с числом компонентов и термодинамических степеней свободы этой системы.
Рассмотрим систему, состоящую из Ф фаз и К компонентов. При равновесии температура и давление всех фаз одинаковы. Химический потенциал m каждого компонента имеет одинаковое значение во всех фазах. Состав каждой фазы определяется концентрациями (К-1) компонентов (т.к. концентрацию последнего компонента можно найти, учитывая, что сумма мольных долей всех компонентов равна единице). Состав Ф фаз определится Ф(К-1) концентрациями. С учетом температуры и давления общеечислопараметров, определяющих состояние системы, составит Ф(К-1)+2.
|
|
|
Применим известное алгебраическое правило: в системе уравнений число независимых переменных (т.е. число степеней свободы С) равно разности общего числа переменных и числа связывающих их уравнений). Общее число переменных мы нашли: Ф(К-1)+2. Число уравнений, связывающих эти переменные, определим из условий равновесия в гетерогенных системах, а именно: из равенства химических потенциалов любого компонента в каждой из сосуществующих фаз. Так как химические потенциалы компонентов при постоянных Р и Т являются функциями их концентраций, то эти равенства и определят число уравнений, связывающих концентрации компонентов равновесной системы.
Запишем эти равенства для «К» компонентов, обозначая верхним индексом номер фазы, а нижним - компонента:
m11=m12; m12=m13; ... m1Ф-1=m1Ф
m21=m22; m22=m23; ... m2Ф-1=m2Ф
. . . . . . . . . . . . . . . . . . . . . . . .
mк1=mк2; mк2=mк3; ... mкФ-1=mкФ
Очевидно, что для каждого компонента имеется (Ф-1) уравнений, а для всех К компонентов К(Ф-1) уравнений.
|
|
|
Тогда число степеней свободы
С = Ф(К-1) + 2 - К(Ф-1)
или
С = К - Ф + 2 (4.2)
Это уравнение выражает основной закон фазового равновесия, или правило фаз Гиббса (1867 г.): число термодинамических степеней свободы равновесной гетерогенной системы, на которую влияют только Т и Р, равно числу компонентов минус число фаз плюс 2.
Если на равновесие в системе кроме Т и Р влияют другие факторы (магнитные, электрические или гравитационные поля, например), то в уравнении (4.2) число внешних факторов будет не 2, а 3 или, в общем случае, n:
С = К - Ф + n (4.3)
Если гетерогенная система состоит только из конденсированных фаз, то давление, как правило, не влияет на состояние гетерогенного равновесия в системе в широких пределах (до тысяч атм), и число внешних параметров n=1 (температура).
Тогда правило фаз имеет вид:
С = К - Ф + 1 (4.4)
По числу фаз, компонентов и вариантности гетерогенные системы классифицируют следующим образом: однофазные, двухфазные, трехфазные, многофазные; одно-, двух-, трех- и многокомпонентные; ин- (или нон-) вариантные (С=0), моно-, би- и поливариантные.
Понятие о физико-химическом анализе. Термический анализ
Для изучения гетерогенных систем применяют методы физико-химического анализа. В основе его лежит изучение какого-либо физического свойства системы (плотности, вязкости, электропроводности, температуры фазового перехода и др.) в зависимости от состава системы.
Найденные из опыта зависимости изображают в виде диаграмм состояния «состав-свойство».
Диаграмма - это совокупность геометрических элементов (точек, линий, плоскостей и т.д.), которые изображают связь между параметрами, определяющими состояние системы, и ее составом. Изучение диаграмм состояния позволяет определить число и состав фаз, составляющих систему при данных условиях, определить границы существования фаз. В основе анализа диаграмм лежат принципы непрерывности и соответствия. Эти принципы сформулированы основателем физико-химического анализа - академиком Н.С. Курнаковым.
Принцип непрерывности: при непрерывном изменении параметров, определяющих состояние системы, свойства ее отдельных фаз изменяются непрерывно до тех пор, пока не изменится число или природа ее фаз.
Принцип соответствия: каждой фазе или совокупности фаз, находящихся в системе в равновесии, соответствует на диаграмме определенный геометрический образ (плоскость, кривая, точка).
Одним из наиболее распространенных видов физико-химического анализа является термический анализ. В основе его лежит экспериментальное изучение температур, при которых в равновесной системе происходят фазовые превращения. Эти температуры определяют по кривым охлаждения (или термограммам), t°=f(t). Кривые охлаждения получают экспериментально для систем с различным соотношением компонентов, фиксируя изменение температуры во времени в процессе естественного охлаждения. Процессы фазового перехода, происходящие в системе, сопровождаются тепловыми эффектами и приводят к появлению изотермических остановок или изменению угла наклона термограммы.
Построение термограмм широко применяется при изучении свойств и состава сплавов, природных и искусственных минералов. По кривым охлаждения строят диаграммы состояния (фазовые диаграммы) гетерогенных систем. Они позволяют определять области существования возможных фаз гетерогенной системы в зависимости от условий: состава системы, температуры, давления. Нами будут рассмотрены далее основные типы диаграмм состояния одно- и двухкомпонентных гетерогенных систем. В качестве примеров приведены некоторые фазовые диаграммы минералов и сплавов. Более сложные типы диаграмм многокомпонентных систем можно найти в специальной литературе. В списке литературы, приведенном в конце учебного пособия, приведено несколько таких изданий.
Дата добавления: 2022-01-22; просмотров: 141; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
