СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПУТИ
Лекция 3
ЭЛЕМЕНТЫ КИНЕТИЧЕСКОЙ ТЕОРИИ
И ГАЗОВЫЕ ЗАКОНЫ
УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ
Описание газовых законов дополним рассмотрением уравнения состояния реальных газов, так как при значительном повышении давления (плотности) газа начинает сказываться влияние сил межмолекулярного взаимодействия и собственного объема молекул, которые, как мы знаем, в уравнении состояния идеального газа не учитываются.
Из предложенных различными авторами уравнений состояния реальных газов наиболее удачным считается уравнение Ван-дер-Ваальса (1873 год):
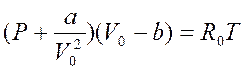
где V0 – объем киломоля газа;
a и b – постоянные величины, зависящие от рода газа;
Поправка (a / V 2 0 ) учитывает влияние так называемых сил Ван-дер-Ваальса, обусловленых электромагнитными и квантовыми взаимодействиями между молекулами газа: по мере сближения молекул происходят такие перегруппировки их зарядов, что сначала действуют силы взаимного притяжения, возрастающие при сближении молекул, а затем – силы их взаимного отталкивания. Пройдя через положение, при котором силы притяжения и отталкивания уравновешиваются, молекулы под действием быстро возрастающих сил взаимного отталкивания разлетаются в разных направлениях.
Силы взаимодействия между молекулами внутри объема газа направлены во все стороны и, следовательно, взаимно уравновешиваются, но они сказываются на краевых молекулах, находящихся вблизи стенок сосуда, содержащего газ, и проявляются в виде дополнительного слагаемого к давлению р. Это значит, что в данном объеме газ удерживается не только внешним давлением р, оказываемым стенками, но частично и внутренними силами межмолекулярного взаимодействия в самом газе. Таким образом, поправка (a / V 2 0 ) представляет собой «внутреннее» давление в газе.
Поправкой b учитывается влияние собственного объема молекул, за счет которого уменьшается объем, свободный от молекул.
Уравнение Ван-дер-Ваальса позволяет с гораздо большей точностью, чем уравнение (1.14), определять параметры состояния газов при повышенных давлениях. Однако при давлениях, меньших 105 Па, оба уравнения дают близкие и достаточно точные для практики результаты.
ЗАКОН РАСПРЕДЕЛЕНИЯ МОЛЕКУЛ ГАЗА ПО СКОРОСТЯМ
Скорости теплового движения отличаются не только по величине, но и по направлению, а тепловое движение молекул хаотично. Поэтому при этих условиях трудно говорить об определенном значении средней скорости, зависящей от температуры и молекулярной массы газа
Отсюда для характеристики состояния газа говорят или о средней скорости одной молекулы за длительный промежуток времени или средней скорости всех молекул газа в данном объеме в момент времени.
Значение средней квадратичной скорости, с помощью которой удобно характеризовать кинетическую энергию молекул газа, может быть найдено из формулы (1.15).
Максвелл (1860 г.) показал, что газ, не подвергающийся какому-либо постороннему механическому или температурному воздействию, всегда приходит в такое состояние, когда молекулы распределяются по скоростям теплового движения, следуя вполне определенному статистическому закону. На основе этого закона можно подсчитать значение наиболее вероятной, т. е. относительно наиболее часто встречающейся у молекул, скорости теплового движения, м/с:
uB = 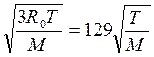
Подсчет средней арифметической скорости молекул таза, т. е. ua = (u1 + u2 + ... + uN )/ N , дает следующее значение, м/с:
ua = 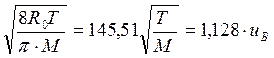
Для средней квадратичной скорости на основании закона распределения Максвелла получается:
u = 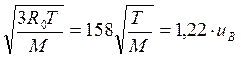
Представление о характере закона распределения молекул газа по скоростям можно получить из рассмотрения рис. 1, где показаны графики распределения молекул по скоростям при двух температурах (Т2 > Т1), где 1/N×dN/du – концентрация молекул с данной скоростью u, м/с.
Общее количество молекул, характеризуемое площадью, заключенной между кривой и осью абсцисс, принято одинаковым. Как видно, возрастание температуры приводит к сдвигу максимума кривой в сторону больших скоростей.
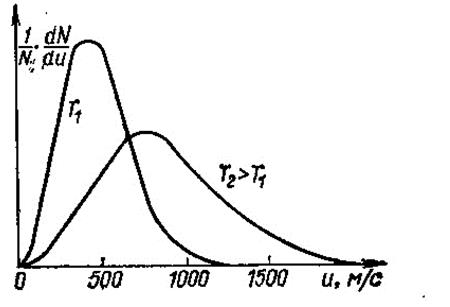
Как видно, при любой температуре сравнительно небольшое количество молекул обладает очень малыми скоростями. По мере роста скоростей относительные доли молекул постепенно возрастают. Закон распределения по скоростям позволяет однозначно определять значения средних скоростей теплового движения молекул в зависимости от температуры и молекулярной массы газа.
Представление об абсолютных значениях скорости теплового движения молекул различных газообразных веществ дает таблица, из которой видно, что средние скорости молекул значительны и примерно в полтора раза превышают скорость звука.
В формулах кинетической теории газов используются всегда средние значения скоростей теплового движения; причем если имеет значение только скорость молекулы, учитывается средняя арифметическая скорость, а когда имеет значение кинетическая энергия, учитывается средняя квадратичная скорость.
Средние квадратичные скорости а теплового движения молекул некоторых газообразных веществ
| Газ или пар | Молекулярная масса, кг | Средняя квадратичная скорость, м/с | |
| при 273 К | при 293 К | ||
| Водород Н2 | 2 | 1838 | 1904 |
| Азот N2 | 28 | 493 | 511 |
| Кислород О2 | 32 | 461 | 478 |
| Ртутный пар | 201 | 184 | 191 |
СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПУТИ
Тепловое движение молекул сопровождается не только ударами молекул о стенки сосуда, в котором заключен газ, но и их взаимными столкновениями. Вследствие этого путь молекулы газа при тепловом движении представляет собой, вообще говоря, пространственную ломаную линию, прямолинейные участки которой соответствуют свободному пути молекулы (без столкновений) (рис. 2); точки, где молекула меняет свое направление, соответствуют моментам столкновения данной молекулы с какой-либо другой. Поскольку тепловое движение беспорядочно, прямолинейные пути молекул между двумя столкновениями не могут быть одинаковы; тем не менее благодаря существованию определенного закона распределения мы и здесь сможем аналогично понятию о средней скорости теплового движения ввести понятие о среднем расстоянии, проходимом молекулами между двумя столкновениями, или, короче, о средней длине свободного пути молекул газа (обозначим ее через l).


Дата добавления: 2022-01-22; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
