Расчет работы расширения идеального газа в
ЛЕКЦИЯ 1
Задачи и разделы физической химии. Основные термодинамические понятия и определения. Первый закон термодинамики. Работа расширения при различных процессах. Энтальпия. Закон Гесса. Стандартные теплоты образования и теплоты сгорания веществ. Теплоемкость. Уравнение Кирхгофа.
Задачи и разделы физической химии.
Современное определение физической химии – это наука, объясняющая химические явления и устанавливающая их общие закономерности на основе принципов физики и с использованием физических экспериментальных методов.
Важнейшая проблема современной физической химии – установление связи между строением вещества и его реакционной способностью. Первый учебник по физической химии был издан Нернстом в 1893 году, он назывался “Теоретическая химия на основе правила Авогадро и термодинамики”.
При изучении физико-химических явлений применяют следующие методы:
Квантово -механический метод, использующий понятие дискретности энергии, а также другие ее свойства, относящиеся к элементарным частицам;
Термодинамический (феноменологический) метод, основанный на нескольких законах, обобщающих опытные данные. Он позволяет выяснить свойства системы, не используя сведения о строении молекул или механизме процессов;
Статистический метод, объясняющий свойства веществ, состоящих из большого числа частиц (макроскопические свойства), исходя из свойств отдельных частиц (микроскопические свойства) и их распределения в соответствии с теорией вероятности.
|
|
|
Основными разделами физической химии являются:
1. строение вещества;
2. химическая термодинамика (сюда включаются три закона термодинамики, учение о химическом и фазовом равновесии, учение о растворах);
3. электрохимия;
4. химическая кинетика и катализ
Основные понятия химической термодинамики.
Термин термодинамика был введен в середине XIX века и происходит от двух греческих слов “термо” – температура и “динамика” – работа. Химическая термодинамика изучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Вопрос о скорости протекания химических процессов термодинамика не рассматривает. Химическая термодинамика основана на трех законах (постулатах), иначе называемых началами термодинамики. Эти законы не доказываются, а являются обобщением множества опытных данных, накопленных человечеством. На основе этих законов получены многочисленные следствия, которые лежат в основе строгого описания окружающего нас мира.
Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной).
|
|
|
Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем.
Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т.е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными(неоднородными), состоящими из двух или более фаз.
Термодинамические параметры состояния системы – (температура, объем, давление и т.д.) – это определенные измеряемые свойства системы, характеризующие ее состояние.
Состояние системы – это совокупность термодинамических параметров системы.
Параметры состояния связаны между собой (в явном или неявном виде) так называемым уравнением состояния. Например, для идеального газа уравнением состояния является уравнение Менделеева-Клапейрона, которое для 1 моль газа имеет вид: pV = RT, или  , или f (p,V,T) = 0.
, или f (p,V,T) = 0.
|
|
|
Различают: экстенсивные и и нтенсивные свойства
1. Экстенсивные свойства, зависят от массы системы (V, m, U, H и т. д.) и обладают аддитивностью: свойство системы равно сумме свойств ее частей.
2. Интенсивные свойства, не зависят от массы системы (T, p, m , r и т. д.). Эти свойства не суммируются, а выравниваются.
Важными в термодинамике являются понятия функции состояния и функции процесса.
Функция состояния – это такое термодинамическое свойство системы, величина которого целиком определяется данным состоянием системы, а ее изменение в каком-либо процессе (т.е. при переходе системы из одного состояния в другое) не зависит от пути перехода, а определяется только конечным и начальным состоянием.
Примеры функций состояния: внутренняя энергия U, энтальпия Н = U + pV, энтропия S, энергия Гельмгольца F= U - TS, энергия Гиббса G = H - TS.
Функция состояния Z обладает следующими свойствами:
1. Пусть Z = Z(х,у), тогда dZ – бесконечно малое изменение функции Z – является полным дифференциалом, что можно записать математически:

2.  . Т.е. определенный интеграл от полного дифференциала dZ не зависит от пути интегрирования.
. Т.е. определенный интеграл от полного дифференциала dZ не зависит от пути интегрирования.
|
|
|
3.  . Интеграл по замкнутому контуру от dZ равен нулю.
. Интеграл по замкнутому контуру от dZ равен нулю.
Функции процесса (F) зависят от пути перехода из одного состояния в другое. Они не имеют полного дифференциала. Их бесконечно малую величину (количество) обозначают dF, причем
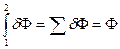 и
и  .
.
Функциями процесса являются например работа (А) и теплота (Q).
Термодинамический процесс – это изменение состояния системы, сопровождающееся изменением хотя бы одного из параметров состояния (свойств системы).
Изменение состояния системы может происходить при различных условиях, поэтому различают:
1) Равновесные и неравновесные процессы.
Равновесные процессы - это процессы, проходящие через непрерывный ряд равновесных состояний.
Равновесное состояние системы – состояние, не изменяющееся во времени и не требующее для своего поддержания воздействия каких-либо внешних факторов.
Неравновесные процессы — это процессы, после протекания которых систему нельзя вернуть в исходное состояние без того, чтобы в ней не осталось каких-либо изменений..
2). Обратимые и необратимые процессы .
Обратимые процессы –это процессы при протекании которых система возвращается в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
В дальнейшем часто можно считать понятия обратимого и равновесного процесса совпадающими
3). Самопроизвольные и несамопроизвольные процессы.
Самопроизвольные – процессы, происходящие сами собой не требующие затраты энергии извне и приближающие систему к равновесию.
Несамопроизвольные – процессы, требующие затраты энергии извне.
Отметим некоторые частные виды процессов, с которыми в дальнейшем придётся иметь дело:
а) изотермический (T = const);
б) изобарный (p = const);
в) изохорный (V = const);
г) адиабатический (нет обмена теплотой между системой и окружающей средой);
д) изобарно-изотермический (p = const , T = const);
е) изохорно-изотермический (V = const , T = const).
Химическая реакция – это разновидность процесса, при котором наблюдается изменение химического состава системы.
Рассмотрим ещё некоторые понятия.
Энергия – мера способности системы совершать работу.
Внутренней энергией системы называется сумма всех видов энергии, за исключением кинетической энергии системы в целом и ее потенциальной энергии положения.
Полная энергия системы равна сумме ее внутренней энергии, кинетической и потенциальной энергии системы как целого.
За энергию системы в термодинамике принимается ее внутренняя энергия. Внутренняя энергия обозначается символом U. Внутренняя энергия является. экстенсивным свойством системы. Нельзя определить абсолютную величину внутренней энергии системы, поскольку неизвестна, например, внутренняя энергия при 0 К. Можно определить только изменение внутренней энергии в результате того или иного процесса (DU).В равновесном состоянии система обладает определённым запасом энергии, поэтому внутренняя энергия является функцией состояния.
Работа и теплота – две возможные формы передачи энергии от одной системы к другой.
В случае работы энергия передается путем согласованного, упорядоченного, движения частиц.
Работа обозначается символом A, при этом работа положительна (А > 0), если она совершается системой против внешних сил, и отрицательна (А < 0), если она выполняется над системой
В случае теплоты – энергия передается путем хаотического движения частиц тела.
Теплота обозначается символом Q, при этом она положительна (Q > 0), если теплота поступает в систему (такой процесс называется эндотермическим), и отрицательна (Q < 0), если теплота отводится из системы (такой процесс называется экзотермическим).
В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы, поэтому Q и A являются функциями процесса. Передача теплоты или совершение работы осуществляются лишь при взаимодействии системы с внешней средой или другой системой.
Первый закон термодинамики.
Первый закон (начало) термодинамики является постулатом, т.е. он не может быть доказан логическим путем. Справедливость его доказывается тем, что ни одно из его следствий не противоречит опытным данным. Количественное выражение первого закона термодинамики для бесконечно малых, элементарных, процессов имеет следующий вид:
dQ = dU + dA или (1)
dU = dQ – dА (2)
Здесь d обозначает полный дифференциал и стоит перед функцией состояния.
U – внутренняя энергия (функция состояния).
dU – бесконечно малое изменение внутренней энергии системы U.
d – бесконечно малая величина (количество) какого–либо свойства, не являющегося функцией состояния системы.
dA – элементарная работа (бесконечно малое количество работы).
Формулировки первого закона термодинамики:
1. Теплота, подводимая к системе, идет на изменение внутренней энергии (функция состояния системы) и на совершение системой работы.
2. Энергия системы постоянна.
3.Энергия не исчезает бесследно и не возникает из ничего, переход её из одного вида в другой происходит в строго эквивалентных количествах .
4. Вечный двигатель 1 первого рода невозможен .
Вечный двигатель (perpetuum mobile) первого рода,такая периодически действующая машина (механизм), которая дает возможность получить работу, не затрачивая на это соответствующего количества энергии.
Элементарную работу dA обычно записывают в виде двух слагаемых:
dА = dА¢ + pdV (3)
dА¢ ‑ элементарная полезная работа,
pdV ‑ элементарная объемная работа, ее часто называют элементарной работой расширения, она относится к случаю, когда система сама совершает работу против внешнего давления. Если система совершает работу только против внешнего давления, тогда dА¢ = 0 и dА = pdV.
В общем случае выражение первого закона термодинамики в дифференциальном виде можно записать как:
dQ = dU + dА¢ + pdV (4)
Из дифференциальной формы записи первого закона путем интегрирования легко можно получить интегральную форму записи:
Q = DU + A или (5)
DU = Q – A (6)
При р = const:
Q = DU + A¢ + pDV (7)
Расчет работы расширения идеального газа в
Различных процессах.
Идеальный газ – это такой газ, молекулы которого не имеют собственного объема и не взаимодействуют между собой.
Идеальные газы подчиняются закону Менделеева-Клапейрона:
pV = nRT.
Экспериментально и теоретически показано, что внутренняя энергия идеального газа не зависит ни от объема, занимаемого газом, ни от давления, а зависит только от температуры (закон Джоуля). Иными словами, для внутренней энергии идеального газа справедливы следующие соотношения:
U ¹ f (V);  ; (8)
; (8)
U ¹ f (p);  ;U = f (T). (9)
;U = f (T). (9)
Рассмотрим работу расширения dА = pdV, совершаемую одним молем идеального газа, в различных условиях:
1. Изохорный процесс Для него V = const, тогда
dV = 0, dА = 0, A = 0 (10)
2. Изобарический процесс. Для него р = const, тогда
 . (11)
. (11)
Но для 1 моль идеального газа выполняется уравнение Менделеева-Клапейрона pV = RT, откуда
 ,
,  , pDV = RDT. (12)
, pDV = RDT. (12)
Поэтому получим
A = pDV= RDT=R(T2-T1) где T = 8,314  (13)
(13)
3. Изотермический процесс. Для него Т = const
dA = pdV;  , но pV = RT, отсюда
, но pV = RT, отсюда  ,
,
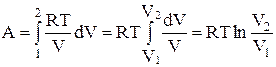 . (14)
. (14)
Но поскольку процесс изотермический, то справедлив закон Бойля – Мариотта: р1V1 = р2V2,
откуда  , поэтому получим
, поэтому получим
 (15)
(15)
4. Адиабатический процесс. Для него dQ = 0, тогда Q = 0. В этом случае из первого закона термодинамики получаем:
dА = – dU;  ; A = –DU = U1 – U2 (16)
; A = –DU = U1 – U2 (16)
В адиабатическом процессе работа совершается системой за счет убыли ее внутренней энергии.
(Здесь –DU = U1 – U2 – убыль внутренней энергии, DU = U2 – U1 – изменение внутренней энергии).Для n молей идеального газа работа А будет в n раз больше (если n > 1).
1.5 Теплота процессов при постоянном объеме (QV)
и постоянном давлении (Qp).
Рассмотрим химическую реакцию νАА+νВВ→νсС
Для нее dА¢ = 0, dА = рdV, тогда первый закон термодинамики в дифференциальной форме можно записать следующим образом:
dQ = dU + рdV. (17)
1). Рассмотрим изохорный процесс (V = const).
В этом случае dV = 0. Отсюда получим: dQV = dU или, интегрируя:
QV = DU.
То есть, если реакция протекает при постоянном объеме, то ее тепловой эффект QV равен изменению внутренней энергии системы в результате реакции. Однако, поскольку внутренняя энергия есть функция состояния системы, то QV приобретает свойства является функции состояния системы.
2). Рассмотрим изобарный процесс (р = const).
Тогда рdV = d(pV);
dQр = dU + d(pV) = d(U+ pV) (18)
Под знаком дифференциала стоит некоторая функция состояния. Обозначим ее через Н = U + pV (19)
и назовем энтальпией.
Тогда получим:
dQр = dН, Qр = DН.
Таким образом, тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии DН и обладает свойствами функции состояния.
Закон Гесса.
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = D Н) или при постоянном объеме (QV = D U) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QV = ∆U, V= const,
QP = ∆H, p= const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями - в одну, две или три стадии:
 |
По закону Гесса DН1 = DН2 + DН3 = DН4 + DН5+ DН6.
Следствия из закона Гесса.
Первое следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ ( Df H) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
 (21)
(21)
Теплота образования ∆fН - это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·105Па .
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (D f H 0 298 ) – это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества-это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH0298 = 0.
Второе следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот сгорания ( D c H) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
 (22)
(22)
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как D c H 0 298 ) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
а) 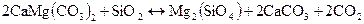 ;
;
б)  ,
,
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 250С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
а)  ;
;
б)  .
.
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
1. 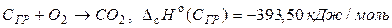 ;
;
2. 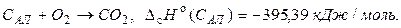
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
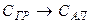 .
.
Расчет показывает, что

Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
1.7 Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
DH = DU + pDV
Qp = QV + pDV
Qp – QV = pDV (23)
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона
pDV = DnгазRT, (24)
можно получить выражения:
DH = DU + DnгазRT или
Qp = QV + DnгазRT или
Qp – QV = DnгазRT,
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
т.е. 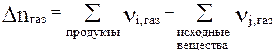 (25)
(25)
Иногда пишут вместо Dnгаз символы Dnгаз.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
Теплоемкость вещества
Теплоемкость – это количество теплоты, необходимое для нагревания единицы массы вещества на 1 К.
 (26)
(26)
Теплоёмкость,рассчитанная на 1 моль вещества, называется молярной, а на единицу массы – удельной.
Размерность удельной теплоемкости  .
.
Размерность молярной теплоемкости  .
.
Различают также понятия истинной и средней теплоемкостей.
Средней молярной теплоемкостью  в интервале температур Т1 ¸ Т2 называется отношение конечного количества теплоты Q, которое необходимо подвести к 1 моль вещества, чтобы изменить его температуру от Т1 до Т2, к разности температур Т2 – Т1:
в интервале температур Т1 ¸ Т2 называется отношение конечного количества теплоты Q, которое необходимо подвести к 1 моль вещества, чтобы изменить его температуру от Т1 до Т2, к разности температур Т2 – Т1:
 . (27)
. (27)
Истинная молярная теплоемкость С – это отношение бесконечно малого количества теплоты dQ, которое нужно подвести к 1 моль вещества, чтобы повысить его температуру на бесконечно малую величину dT, к этому бесконечно малому приращению температуры:
 (28)
(28)
Существуют также теплоемкости при постоянном объеме (изохорная теплоемкость, СV) и постоянном давлении (изобарная теплоемкость, СР).
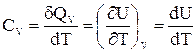 ,
,
 . (29)
. (29)
Следует знать, что теплоёмкость при постоянном давлении Ср больше, чем теплоёмкость при постоянном объёме СV, так как нагревание вещества при постоянном давлении сопровождается работой расширения, т.е.
 (30)
(30)
Для идеальных газов справедливо уравнение Майера:
 (31)
(31)
Величина R (универсальная газовая постоянная) равна работе расширения 1 моль идеального газа (при р = const) при увеличении его температуры на 1 градус. (R=8,314 Дж/(моль∙К)
В справочниках приведены значения стандартной молярной изобарной истинной теплоемкости С0р, 298, а также средней молярной изобарной теплоемкости (  ).
).
Теплоемкость любого вещества - это свойство, зависящее от температуры. Эту зависимость нельзя предсказать теоретически, она определяется экспериментально с помощью специальных устройств – калориметров.
 |
Обычно для температур выше комнатной температурную зависимость теплоемкости записывают в виде следующих полиномов:
С0р = а + bТ + сТ2
или С0р = а+ bТ + 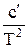 . (32)
. (32)
Дата добавления: 2022-01-22; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
