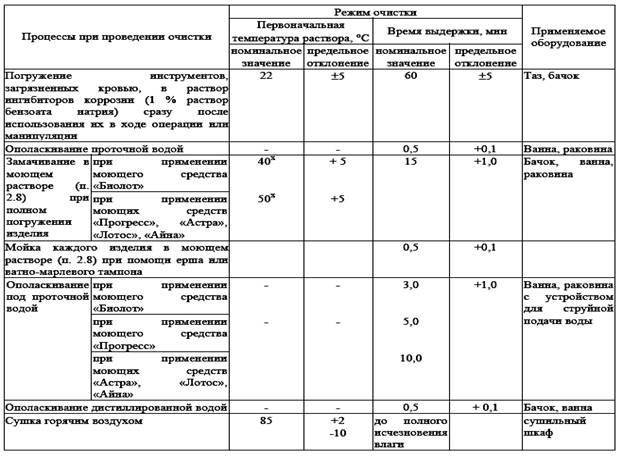
Предстерилизационная очистка ИМН (таб № 2 )
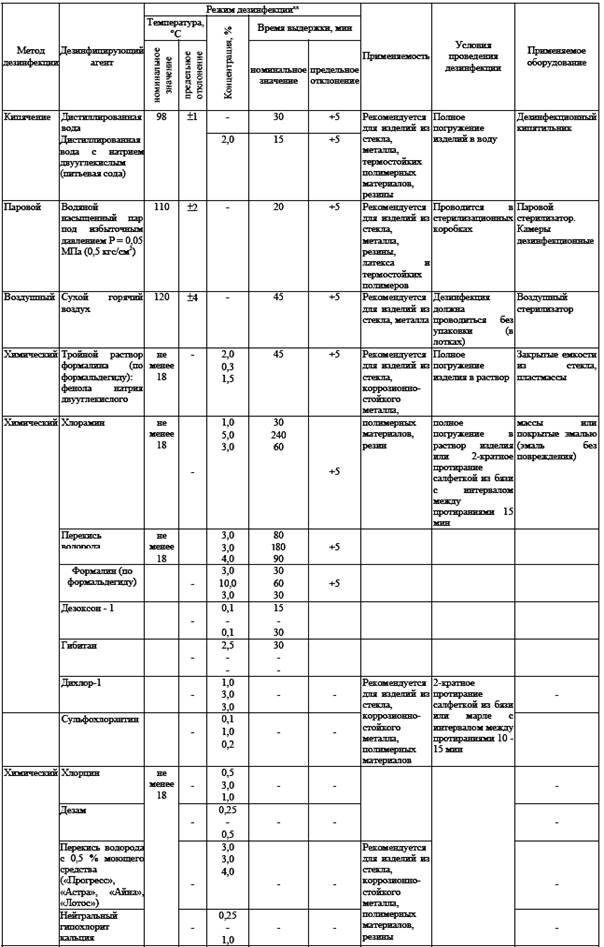
Дезинфекция ИМН (таб №1)
Приготовление моющего (комплексного) раствора (таб.№3)

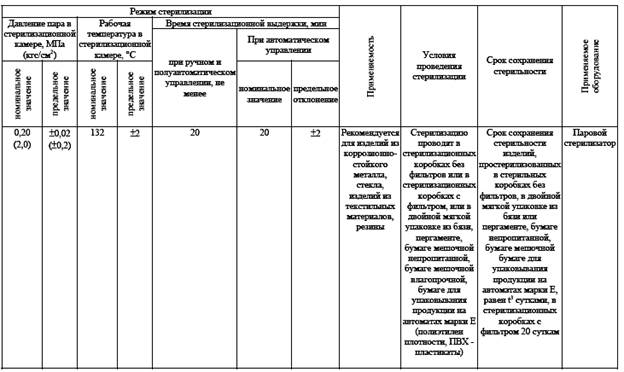
Паровой метод стерилизации (таб.№ 4 )
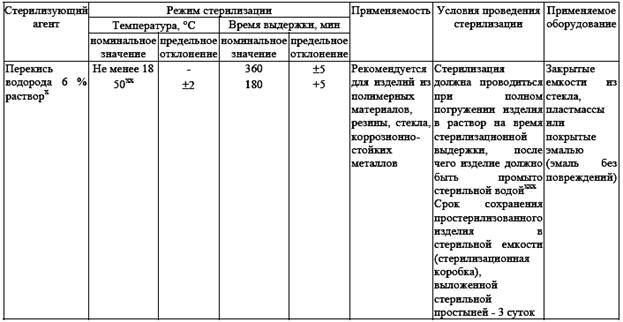
Воздушный метод стерилизации (таб. .№5)
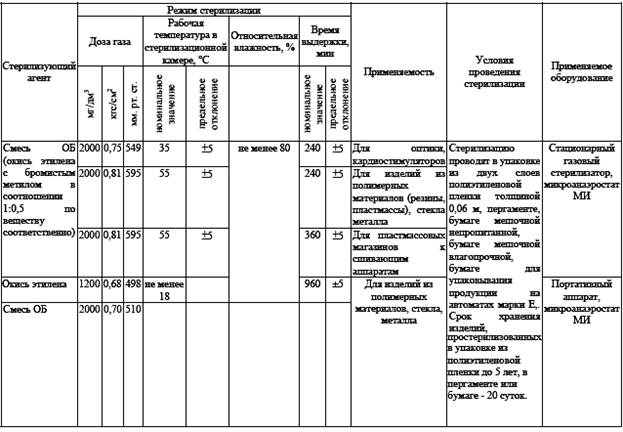
Химический метод стерилизации (газовый) стерилизация смесью ОБ и окисью этилена (таб.№6)
Предстерилизационная очистка.
Цель – удаление балластных веществ с инструментария (крови, жира, белков, остатков лекарственных препаратов и моющих средств, ржавчины).
Контроль качества предстерилизационной очистки
Качество предстерилизационной очистки оценивается по отсутствию положительных проб:
1. На кровь – азопирамовая проба
2. На моющие средства – фенолфталеиновая проба
3. На масляные препараты – проба с суданом. Эта проба ставится с изделиями, загрязненными масляными препаратами.
Условия проведения контроля
1. Контролю подлежит 1% от обработанной партии, но не менее 3-5 шт.
2. Реакция читается в течение 1-ой мин.
3. Инструмент должен быть холодным и сухим
4. Рабочий раствор готовится перед применением.
При несоблюдении этих условий может быть ложноположительная реакция.
Азопирамовая проба
Маточным раствором является азопирам, которой который в холодильнике хранится 2 мес. И вне холодильника 1 мес. с момента изготовления азопирама.
Рабочий раствор азопирама готовится из равных объёмов азопирама и 3% р-ра перекиси водорода перед применением.
|
|
|
Рабочий раствор азопирама проверяется на пригодность не реже одного раза в неделю: на предметное стекло с мазком крови капается 2-3 капли рабочего раствора азопирама, если в течение 1-ой минуты появилось сине-фиолетовое окрашивание, раствор годен к применению; бурое – на хлор и ржавчину, розовое – на моющие средства. В случае положительной реакции на кровь, обработку повторяют, начиная с этапа «дезинфекция»
Результаты азипирамовой пробы заносятся в журнал.
Фенолфталеиновая проба
Рабочий раствор – 1% спиртовой раствор фенолфталеина. В холодильнике хранится один месяц, вне холодильника – 15 дней.
Техника постановки пробы, как и азопирамовая.
Если появилось в течение одной минуты розовое окрашивание, реакция на моющие средства положительная. В случае положительной реакции обработку повторяют, начиная с этапа промывания проточной водой…
Стерилизация - метод обеспечивающий гибель в стерилизуемом материале вегетативных и споровых форм патогенных и не патогенных микроорганизмов. Осуществляется физическими или химическими методами. Контроль качества стерилизации.
Методы контроля.
1. Физические методы - контроля осуществляются с помощью средств измерения температуры (термометры, термопары), давления (манометры, мановакуумметры) и времени (таймеры). Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации.
|
|
|
2. Химические методы - В течение десятков лет для проведения химического контроля применялись химические вещества, изменяющие свое агрегатное состояние или цвет при температуре, близкой к температуре стерилизации (бензойная кислота для контроля паровой стерилизации, сахароза, гидрохинон и ряд других веществ - для контроля воздушной стерилизации).
6. Соблюдении на рабочем месте правил техники безопасности, охраны труда.
Работы в диагностических лабораториях сопряжены с неизбежным контактом персонала с различными видами биологических материалов, что приводит к риску заражения возбудителями инфекционных заболеваний, прежде всего вирусами ВИЧ и вирусных гепатитов В и С.
В этой связи во всех клинико-диагностических лабораториях должен выполняться комплекс противоэпидемических мероприятий, регламентируемый Приказами и Положениями Минздрава России.
Вне зависимости от вида лаборатории и ее подчиненности непосредственная ответственность за организацию и соблюдение противоэпидемического режима возлагаются на заведующего лабораторией и главного врача ЛПУ.
|
|
|
Все мероприятия, направленные на предупреждение биологической опасности в условиях лаборатории, можно подразделить на 3 группы:
• организационные меры;
• применение индивидуальных и коллективных защитных средств;
• соблюдение дезинфекционного режима.
Организационные мероприятия
В каждой лаборатории выделяется ответственный за технику безопасности, который обязан проводить соответствующий инструктаж среднего и младшего медицинского персонала при приеме на работу, а в последующем — не реже одного раза в квартал. О прохождении инструктажа делается отметка в специальном журнале. Для облегчения обучения младшего персонала в лабораториях с учетом местных условий составляются памятки по мерам безопасности, которые используются при периодическом инструктаже, а также размещаются непосредственно на рабочих местах.
Помещения КДЛ можно использовать только по их прямому назначению, проведение в них каких-либо других работ не разрешается.
Клинико-диагностическая лаборатория должна быть обеспечена водопроводом, горячим водоснабжением, канализацией, центральным отоплением.
|
|
|
Помещения лаборатории должны быть оборудованы приточно-вытяжной вентиляцией с механическим побуждением. Вентиляция во всех помещениях должна включаться до начала работы.
Независимо от наличия приточно-вытяжной вентиляции в лабораториях должны быть легко открывающиеся форточки, кроме специальных боксов бактериологической лаборатории.
В помещениях для проведения исследований мочи и кала, биохимических, серологических и гормональных исследований следует устанавливать вытяжные шкафы.
При размещении оборудования особое внимание уделяют аппаратам — потенциальным источникам биологического аэрозоля. По этой причине рекомендуется размещать центрифуги в отдельных помещениях, в которых не предусматривается постоянное пребывание персонала.
Ядовитые средства должны храниться в отдельной комнате в сейфах под замком. Ключи должны храниться у лица, ответственного за их хранение, — у заведующего КДЛ.
Индивидуальные и коллективные защитные средства
Минимальный набор средств индивидуальной защиты при работе с биологическим материалом включает медицинский халат, шапочку и резиновые перчатки. При угрозе разбрызгивания биологического материала дополнительно используют маски, очки, клеенчатый фартук. Набор спецодежды, используемый при работе с материалом, подозрительным на инфицированность возбудителями I—II групп патогенности, регламентирован санитарными правилами «Безопасность работы с микроорганизмами I—II групп патогенности», СП 1.2.011—94. Работа в лабораториях диагностики СПИДа осуществляется в соответствии с режимом работы с возбудителями III группы патогенности.
Смена спецодежды в обычных КДЛ осуществляется не реже 2 раз в неделю, а при возникновении аварийных ситуаций — немедленно. В случае попадания на одежду биологического материала, перед тем как снять ее, загрязненное место обрабатывают дезинфицирующим раствором. Стирка одежды на дому категорически запрещена.
Резиновые перчатки обязательны для использования при работе не только с кровью, но и с любым биологическим материалом. Необходимо избегать уколов и порезов. Все повреждения кожи на руках должны быть закрыты лейкопластырем.
В случае загрязнения кожных покровов кровью или другими биологическими жидкостями следует немедленно обработать их в течение 2 минут тампоном, обильно смоченным 70%-ным спиртом, вымыть под проточной водой с мылом и вытереть индивидуальным тампоном.
При загрязнении перчаток кровью их протирают тампоном, смоченным 6%-ным раствором перекиси водорода.
При подозрении на попадание крови на слизистые оболочки их немедленно обрабатывают струей воды, 1%-ным раствором борной кислоты или вводят несколько капель нитрата серебра;
нос обрабатывают 1 % раствором протаргола;
рот и горло прополаскивают 70%-ным спиртом или 1%-ным раствором перманганата калия.
Запрещается пипетирование крови ртом; следует использовать автоматические пипетки, а при их отсутствии — резиновые груши.
Важный этап в предупреждении внутрилабораторного заражения — грамотная транспортировка биологического материала в лабораторию. Материал должен быть помещен в надежно закрывающуюся посуду, сопроводительная документация должна прикладываться в отдельном целлофановом пакете. Для доставки материала в центральную диагностическую лабораторию из отделений больницы используют специальные металлические или пластмассовые закрывающиеся ящики. После разгрузки они обязательно обрабатываются дезинфицирующими растворами.
Распаковка материала, доставленного в лабораторию, проводится в специально отведенном для этого месте. Персонал работает в перчатках, а емкости с материалом помещают на эмалированные или металлические подносы.
Лабораторные инструменты, иглы, капилляры, предметные стекла, пробирки, меланжеры, счетные камеры, кюветы фотоэлектрокалориметра, пипетки, наконечники, резиновые груши и другая посуда после каждого использования должны подвергаться дезинфекции.
Использованные изделия промывают в емкости с водой. Промывные воды обеззараживают кипячением в течение 30 мин или засыпают сухой хлорной известью в соотношении 200 г на 1 л, перемешивают и обеззараживают в течение 60 мин. Промытые изделия кипятят в закрытой емкости в воде 30 мин или в 2%-ном растворе соды в течение 15 мин. (В случае кипячения изделий в 2%-ном растворе соды дальнейшая предстерилизационная очистка не проводится).
Лабораторные инструменты могут быть обеззаражены погружением в дезинфицирующий раствор на 60 мин. В качестве дезинфицирующих используются следующие растворы: 3%-ный раствор хлорамина; 6%-ный раствор перекиси водорода 6%-ный раствор перекиси водорода с 0,5%-м моющим средством; 4%-ный раствор формалина; 0,5%-ный раствор нейтрального гипохлорита кальция; 0,5%-ный сульфохлорантин. Изделия должны быть полностью погружены в раствор. При дезинфекции изделий, имеющих внутренние каналы, раствор дезинфектанта сначала прокачивают через них с помощью груши для удаления остатков биологического материала, а затем погружают в новую емкость, заполненную дезраствором.
Емкости для дезрастворов должны быть четко промаркированы и иметь крышки. В маркировке емкости указывают: название дез-раствора, его концентрацию, назначение и дату приготовления. Растворы дезинфектантов используются однократно.
Каждая партия сухих хлорсодержащих дезинфектантов перед использованием должна подвергаться контролю на содержание активного хлора.
Растворы перекиси водорода готовят ежедневно, хлорамина — на две недели, хлорной извести, НГК — на шесть дней. Замена дезраствора в рабочих емкостях проводится ежедневно.
Кварцевые, стеклянные, пластмассовые кюветы измерительной аппаратуры, пластиковые пробирки аппаратуры обеззараживают погружением в 6%-ный раствор перекиси водорода и промывают проточной водой.
С предметных стекол с фиксированным и окрашенным мазком крови после проведения микроскопии удаляют остатки иммерсионного масла, стекла кипятят в мыльном растворе не менее 15 мин до полного отхождения краски, затем промывают проточной водой, подсушивают на воздухе и протирают.
Остатки крови, мочи, спинномозговой жидкости и т. д., пробы, содержащие разведенную сыворотку без добавления кислот, щелочей, сливают в специальную тару и обеззараживают сухой хлорной известью в соотношении 1:5 в течение 1 ч. Посуду из-под мочи, кала обрабатывают дезраствором, но не стерилизуют.
Для обеззараживания поверхностей рабочих столов, емкостей для транспортировки материала и т. п. проводят их двукратное обтирание ветошью, смоченной 6%-ным раствором НГК, 0,5%-ным раствором сульфохлорантина. Использованную ветошь сбрасывают в специально выделенную емкость с дезинфицирующим раствором, маркированную «Для дезинфекции использованной ветоши».
Перчатки после окончания работы обеззараживают погружением в 3%-ный раствор хлорамина или 6%-ный раствор перекиси водорода на 1 ч.
Одноразовый инструментарий и посуду утилизируют в паровом стерилизаторе (режим: температура 132 °С; давление — 2 кгс/см2 , время — 30 мин), после чего выбрасывают. Эффективность обеззараживания при этом контролируют по расплавлению химического теста.
Мероприятия при локализации и ликвидации последствий аварий
При авариях работу с ПБА немедленно прекращают, ставят в известность руководителя лаборатории или лицо, его замещающее, и принимают следующие меры:
• все открытые части тела обрабатывают дезинфицирующим раствором или 70 %-ным спиртом;
• при попадании инфекционного материала на слизистые оболочки их немедленно обрабатывают: глаза — 1 %-ным раствором борной кислоты, несколькими каплями 1 %-ного раствора азотнокислого серебра или струей волы; в нос закапывают, а рот и горло прополаскивают 0,05 %-ным раствором марганцовокислого калия или 1 %-ным раствором борной кислоты.
При аварии, связанной с ранением или другим повреждением кожных покровов, перчатки (если работа проводилась в них) обрабатываются дезраствором, снимаются, из ранки выдавливается кровь, руки обрабатываются 70%-ным спиртом, затем моются водой с мылом, ранка смазывается раствором йода.
Проводится обеззараживание места аварии. По окончании работ защитная одежда замачивается в дезинфицирующем растворе. Все сотрудники, находившиеся в зоне аварии, должны принять душ.
При аварии во время работы на центрифуге крышку медленно открывают только через 30—40 мин (после оседания аэрозоля) и после отключения ее от электросети. Затем неповрежденные объекты (центрифужные пробирки и т.п.) изъять, обработать дез. Раствором и передать для продолжения необходимых технологических операций. Гнездо ротора, вместе с осколками залить дез. раствором на 1 час, а после этого осколки утилизировать, а все гнезда ротора поместить в дез. раствор на 1 час. Внутреннюю поверхность центрифуги, в т.ч. крышку и ротор тщательно обработать дез. раствором и выдержать экспозицию. После полного исчезновения следов влаги работа на центрифуге м.б. продолжена.
При аварии с разбрызгиванием ПБА, лица, находящиеся в помещении, где произошла авария, покидают помещение, обрабатывают открытые части тела и слизистые, замачивают СИЗ в дезинфицирующем растворе, принимают душ.
Мероприятия по ликвидации последствий аварии осуществляют сотрудники лаборатории, одетые в противочумный (хирургический) халат, косынку, сапоги (галоши, пластиковые бахилы), резиновые перчатки, очки и респиратор.
0 происшедшей аварии и проведенных мероприятиях руководитель лаборатории направляет докладную записку на имя руководителя организации и председателя комиссии по контролю за соблюдением требований биологической безопасности, в которой указывает час и дату происшедшей аварии, ее характер, перечисляет сотрудников, находившихся на месте аварии, в том числе лиц, проводивших дезинфекционные мероприятия, а также принятые меры.
В лабораториях для ликвидации последствий аварии, а также профилактики возможного поражения персонала, необходимо иметь: аптечку для оказания экстренной медицинской помощи, запас дезинфицирующих средств, СИЗ, емкости для замачивания СИЗ.
В аптечке экстренной помощи должны находиться: 70%-ный этиловый спирт, раствор йода, сухие_навески марганцовокислого калия, азотнокислого серебра и борной кислоты, которые в случае аварии можно растворить в мерном объеме дистиллированной воды, стерильная дистиллированная вода, глазные пипетки (5 шт), ножницы, перевязочные средства, бактерицидный пластырь, ножницы, напальчники (5 шт).
Ответственным за комплектование аптечки экстренной медицинской помощи является руководитель подразделения.
За лицами, находившимися в помещении, где произошла авария, устанавливается медицинское наблюдение на срок инкубационного периода.
В лаборатории должен быть журнал регистрации аварий, где отмечается: дата, время, место, характер аварии, фамилия, имя и отчество лиц, находившихся непосредственно в зоне ее воздействия, а также проведенные мероприятия.
Дата добавления: 2022-01-22; просмотров: 59; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
