Критерїї стійкості стану т.-д. системи.
Колоквіум 16 та 17-го квітня 2013, 200 ауд., о 14:15
16.04.2013 – 4-та та 6-та групи
17.04.2013 – 5-та група
Лекції 9 - 10. (25 - 26.03.2013)
2.29. Зміна ентропії в ізольованій т.-д. системі.
Припустимо, що цикл складається з необоротного з стану 1 до стану 2 адіабатного ( 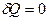 ) та оборотного з стану 2 до стану 1 процесів, тоді
) та оборотного з стану 2 до стану 1 процесів, тоді 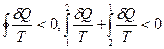
Далі
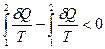
Перша частина циклу – адіабатний процес 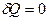 , тому
, тому 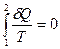 .
.
Тоді
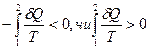 .
.
Для оборотного процесу з стану 2 в стан1 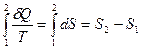 .
.
Таким чином, 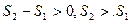 . Тобто внаслідок необоротного процесу в ізольованій т.-д. системі її ентропія збільшується.
. Тобто внаслідок необоротного процесу в ізольованій т.-д. системі її ентропія збільшується.
Це твердження можна розглядати як ще одне формулювання 2-го принципу термодинаміки.
2.30. 2-й принцип термодинаміки та перетворення теплоти в роботу. Вільна енергія т.-д. системи (потенціал Гельмгольца).
За оборотних процесів
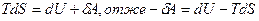 .
.
В цьому виразі маємо від’ємну роботу, тобто роботу оточення над т.-д. системою. Для ізотермічного процесу
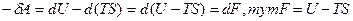 .
.
Для функції F існує повний диференціал. Тому це функція стану т.-д. системи. ЇЇ називають функцією, чи потенціалом Гельмгольца. Зміна потенціалу Гельмгольца в ізотермічному процесі визначає роботу т.-д. системи над оточенням. Добуток TS – зв’язана енергія т.-д. системи. Вона визначає долю внутрішньої енергії U, яку неможна використати для виконання системою роботи. Ця доля тим більша, чи більша ентропія , тобто невпорядкованість т.-д. системи.
2.31. Термодинамічні характеристичні функції та потенціали.
Характеристична функція – функція стану т.-д. системи відповідних незалежних змінних (т.-д. параметрів), яка характеризується тим, що за допомогою цих функцій та їх похідних по цих параметрах можна передати в явному вигляді усі т.-д. властивості системи.
|
|
|
Термодинамічний потенціал – характеристична функція, зменшення якої в оборотному процесі за незмінності відповідних незалежних т.-д. параметрів дорівнює корисній роботі т.-д. системи над оточенням.
Ентропія – характеристична функція стану т.-д. системи.
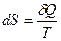
Потенціали т.-д. системи
Внутрішня енергія 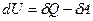
Ентальпія 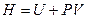
Функція (потенціал Гельмгольца) 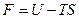
Потенціал Гіббса 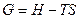
2.32. Основна термодинамічна тотожність.
Для оборотних процесів
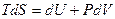
Цей вираз – основна термодинамічна тотожність. Звідси
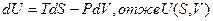 .
.
Оскільки, в цьому рівнянні 4 змінні (T,S,P,V) зв’язані рівнянням стану та термодинамічною тотожністю, незалежними можуть бути лише 2 з них.
Таким чином, U=U(V,S).
Для ентальпії
dH=dU+PdV+VdP=TdS-PdV+PdV+VdP=TdS+VdP,
H=H(P,S).
Для потенціалу Гельмгольца
dF=dU-TdS-SdT=TdS-PdV-TdS-SdT=-PdV-SdT,
|
|
|
F=F(V,T).
Для потенціалу Гіббса
dG=dH-TdS-SdT=TdS+VdP-TdS-SdT=VdP-SdT,
G=G(P,T).
Введемо ще один потенціал – хімічний. Припустимо, що система складається з
ni частинок i –го сорту,
nJ частинок j - го сорту.
Тоді природно записати

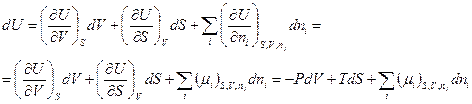
В цьому виразі - 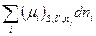 називається хімічним потенціалом т.-д. системи.
називається хімічним потенціалом т.-д. системи.
Для внутрішньої енергії хімічний потенціал 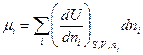 .
.
Для ентальпії 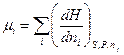 .
.
Для вільної енергії 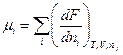 .
.
Для потенціалу Гіббса 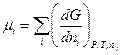 .
.
2.33. Співвідношення Максвелла.
Наведені вище вирази для термодинамічних потенціалів дозволяють встановити деякі корисні співвідношення між т.-д. параметрами.
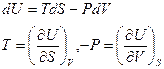
Оскільки 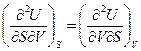 , отримуємо
, отримуємо 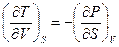 .
.
Це 1-ше співвідношення Максвелла.
2-ге співвідношення:
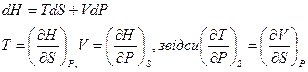 .
.
3-тє співвідношення:
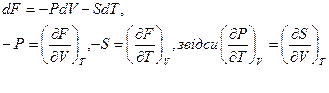 .
.
4-те співвідношення:
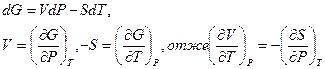 .
.
Критерїї стійкості стану т.-д. системи.
Рівноважний стан ізольованої т.-д. системи стійкий, якщо її ентропія набуває максимального з усіх можливих значення.
· За будь-яких можливих станів т.-д. системи, які не впливають на її енергію, варіація ентропії зникає, або від’ємна.
· За будь-яких можливих станів т.-д. системи, які не впливають на її ентропію, варіація її енергії зникає, або додатна.
(Гіббс 1875 -1878 рр.)
Для необоротних процесів
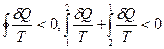 .
.
Якщо процес переходу з стану 2 в стан 1 оборотний, то
|
|
|
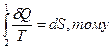
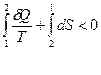 .
.
Припустимо, що стан 2 близький до стану 1. Тоді
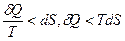
Оскільки
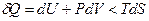 ,
,
маємо 
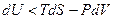 .
.
Таким чином, за необоротних процесів та сталих S та V внутрішня енергія т.-д. системи зменшується (мінімізується).
Так само мінімізуються ентальпія, вільна енергія, потенціал Гіббса. Дійсно,
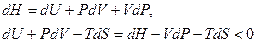
Ентальпія мінімізується за сталих P та S.
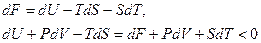 .
.
Вільна енергія мінімізується за сталих T та V.
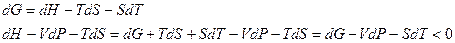
Потенціал Гіббса мінімізується за сталих T та P.
2.35. Принцип Ле-Шательє-Брауна (1884 р.).
Якщо на т.-д. систему в стійкому рівноважному стані діють фактори, що намагаються вивести її з цього стану, то в системі виникають процеси, які нівелюють дію цих факторів. (Приклад – самоіндукція).
Дата добавления: 2022-01-22; просмотров: 17; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
