Макросостояния и микросостояния системы
План семинара:
1. Интерпретация нулевого начала термодинамики термодинамическим и статистическим методами.
2. Интерпретация первого начала термодинамики термодинамическим и статистическим методами.
3. Интерпретация второго начала термодинамики термодинамическим и статистическим методами.
4. Интерпретация третьего начала термодинамики термодинамическим и статистическим методами.
5. Выводы.
Ниже представлен примерный конспект семинара, составленный на основе обобщающей схемы изучения термодинамики как фундаментальной физической теории студентами технического вуза.
Независимые эксперты.Методы статистической физики (в частности, методы молекулярно-кинетической теории) позволяют раскрыть молекулярно-кинетический механизм и смысл основных (исходных) термодинамических функций состояния – температуры T, внутренней энергии U, энтропии S и функций процесса – теплоты Q и работы A. Термодинамика оперирует макроскопическими параметрами при описании состояния изучаемой системы, в статистической физике раскрывается молекулярно-кинетический механизм и смысл состояния термодинамической системы. Фундаментальным объектом, которым оперирует термодинамика, является физическая система как неструктурированный макроскопический объект без указания материальной природы объекта. Фундаментальным объектом статистической физики является совокупность N неструктурированных частиц (обычно N порядка числа Авогадро), хаотически движущихся и взаимодействующих между собой. Собственно, само различие объектов равновесной термодинамики и статистической физики следует из различия термодинамического и статистического методов исследования состояния физической системы.
|
|
|
Преподаватель.Первый вопрос, который мы обсудим, - содержание нулевого начала термодинамики.
Равновесная термодинамика оперирует фундаментальным понятием – равновесным состоянием термодинамической системы. Из эксперимента следует, что при заданных неизменных внешних условиях рассматриваемая термодинамическая система приходит в конечное состояние, называемое равновесным. Это состояние характеризуется макропараметром, относящимся ко всей системе, – температурой Т системы. Утверждение о существовании термодинамического равновесия и функции состояния системы при равновесии – температуры T – составляет содержание нулевого начала термодинамики.
Эксперты в области термодинамики. В рамках термодинамики понятие температуры довольно абстрактное понятие. Можно сформулировать операционное определение температуры. Например, температура тела – это физическая величина, измеряемая термометром (далее студенты кратко описывают сам прибор - газовый или жидкостный термометры - и все манипуляции процесса измерения температуры). При измерении температуры оперируют понятием равновесного состояния, т.к. термометр измеряет собственную температуру. Снятие показания термометра осуществляется после достижения термодинамического равновесия между термометром и измеряемой системой. Приведенное определение конструктивно, чем бессодержательное выражение типа: температура – это мера нагретости. Операционное определение температуры фактически является своего рода переформулировкой нулевого начала термодинамики.
|
|
|
Эксперты в области статфизики: Операционное определение не раскрывает молекулярно-кинетического содержания понятия температуры. Молекулярно-кинетический смысл температуры раскрывается методами МКТ, при этом понятие температуры приобретает многогранный смысл.
Итак, во-первых, температура является мерой кинетической энергии молекул: <e> = 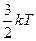 .
.
Соотношение получено из анализа основного уравнения молекулярно-кинетической теории при приближении к состоянию термодинамического равновесия двух тел. В равновесном состоянии средняя кинетическая энергия молекул пропорциональна температуре: 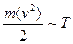 .
.
|
|
|
Во-вторых, температура является мерой разброса молекул по скоростям (кинетическим энергиям) около среднего значения, например, около среднеквадратичного значения скорости молекул. Действительно, из распределения Максвелла, представленного на слайде (рис. 8)

Рис. 8 . Распределение молекул по скоростям.
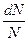 =
= 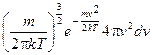 = f ( v ) dv
= f ( v ) dv
получаем средние скорости: vвер. = 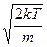 , <v> =
, <v> = 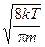 , vср.кв. =
, vср.кв. = 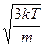 .
.
Если подставит наиболее вероятную скорость в распределение Максвелла, то получим, что значение функции распределения для этой скорости имеет вид: f ( v ) ~ 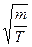 . Из этого следует, что в пределе при Т ® 0 функция распределения стремится перейти в дельта-функцию, а при увеличении температуры разброс средних скоростей возрастает, причем в пределе Т ® ¥ наблюдается стремление к равнораспределению молекул по скоростям.
. Из этого следует, что в пределе при Т ® 0 функция распределения стремится перейти в дельта-функцию, а при увеличении температуры разброс средних скоростей возрастает, причем в пределе Т ® ¥ наблюдается стремление к равнораспределению молекул по скоростям.
В-третьих, из распределения Больцмана
n = n0 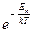
|
|
|
следует, что температура T является мерой распределения статистических объектов по энергиям в потенциальном силовом поле. Например, распределения молекул в поле силы тяжести или взвешенных частичек суспензии в опыте Перрена (Eп = mgh).
Независимые эксперты: При всей кажущейся самоочевидности нулевого начала, оно обладает нетривиальным содержанием. В частности, понятие о термодинамическом равновесии детализируется методами термодинамики при рассмотрении первого и второго начала термодинамики. Раскрытие сущностного содержания фундаментального понятия термодинамики - термодинамического равновесия и соответствующей функции состояния - температуры T - требует предварительного рассмотрения феноменологии газовых законов, принципа работы газового термометра, основных положений молекулярно-кинетической теории и их опытных оснований. Температура – это физическая величина, имеющая определенное значение для конкретного равновесного состояния, то есть она является функциейсостояния системы. К функциям состояния относится не только температура, но и давление, внутренняя энергия, энтропия, свободная энергия и др. Функции состояния термодинамической системы являются своего рода языком термодинамики.
Нулевое начало констатирует факт эволюции термодинамической системы из неравновесного в равновесное состояние.
Преподаватель. Второй вопрос - первое начало термодинамики. Независимые эксперты: В первом начале содержатся следующие утверждения:
- термодинамическая система характеризуется функцией состояния – внутренней энергией системы U;
- энергия системы изменяется только при взаимодействии с внешними телами. В изолированной термодинамической системе выполняется закон сохранения энергии (независимо от того, находится термодинамическая система в равновесии или нет);
- внутренняя энергия замкнутой термодинамической системы – системы с постоянным числом частиц – может быть изменена двумя способами: 1) подводом в систему тепла Q (или отводом Q) и 2) совершением системой работы A (или совершением внешними телами работы A над системой).
Первое начало в дифференциальной форме имеет вид:
dQ = dU + dA,
где dQ – элементарная порция тепла, сообщенная термодинамической системе или отведенная из системы; dA – элементарная работа, совершенная системой или над системой, dU – приращение внутренней энергии системы. Теплота и работа – функции процесса, вследствие чего понятие приращения для этих величин бессодержательно – теплота и работа совершаются, но не содержатся. Данное обстоятельство на языке математики выражается тем, что теплота и работа в общем случае не являются полными дифференциалами. В этой связи для указания бесконечно малой порции подведенного тепла и бесконечно малой (элементарной) совершенной работы здесь использован не оператор дифференцирования «d» , а «d» (как бесконечно малая порция). Внутренняя энергия U содержится в термодинамической системе и как функция состояния является полным дифференциалом. В интегральной форме первое начало термодинамики запишется в виде:
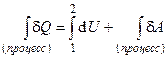 или Q = DU + A,
или Q = DU + A,
где, соответственно, Q и A - конечная подведенная (отведенная) теплота и конечная совершенная работа системой (над системой) в некотором термодинамическом процессе.
Подчеркнем содержательное различие как с позиции термодинамики, так и молекулярно-кинетических представлений: 1) между внутренней энергией U и способов переноса энергии Q и A; 2) между двух способов переноса энергии – различие между dQ и dA.
Преподаватель.Обсудим представление понятия внутренней энергии с позиции термодинамики.
Эксперты в области термодинамики.Под внутренней энергией в термодинамике понимается энергия системы, зависящей от внутреннего состояния этой системы. Молекулярно-кинетический механизм внутреннего состояния в термодинамике не рассматривается, ибо моделью термодинамики является неструктурированное тело. Возвращение системы в исходное термодинамическое состояние означает, что внутренняя энергия системы принимает исходное значение.
Эксперты в области статфизики. С позиции молекулярно-кинетических представлений внутренняя энергия термодинамической системы определяется суммарной кинетической энергией хаотического движения молекул, атомов, ионов системы и потенциальной энергией их взаимодействия. Кинетическая энергия системы как целого и потенциальная энергия системы во внешнем потенциальном силовом поле (например, гравитационном) не входят во внутреннюю энергию системы.
Преподаватель.Рассмотрим различие между dQ и dA , которое выявляется при термодинамическом и статистическом анализе этих видов переноса энергии.
Эксперты в области термодинамики. Термодинамическая система совершает работу (положительную или отрицательную) при перемещении внешних тел, с которыми взаимодействует система. Положение внешних тел относится к внешним параметрам термодинамической системы. Например, стенки сосуда, в котором находится газ, ограничивают объем газа и объем сосуда V является внешним параметром, а давление газа p, обусловленное хаотическим движением молекул, является внутренним параметром системы. Объем самого газа относится к внутренним параметрам. Объем сосуда равен объему газа. Это пример того, что внешние параметры определяют внутренние параметры термодинамической системы. Другой пример. В случае подвижного поршня под действием внешнего давления объем газа изменяется и устанавливается в соответствии с внешним давлением (внешнее давление является внешним параметром, а объем газа – внутренним).
Работа совершается только при перемещении внешних тел. Например, при расширении газа в вакуум работа не совершается, т.к. в этом случае в выражении dA = pdV давление p на границе газа равна нулю, следовательно, равна нулю работа. Работа, совершаемая над термодинамической системой, имеет обратный знак в сравнении с работой системы. Данное обстоятельство объясняется третьим законом Ньютона и предположением, что перемещение границы термодинамической системы равно перемещению внешних тел.
При совершении термодинамической системой работы движение внешних тел носит упорядоченныйхарактер, внешние тела движутся как единое целое, а работа совершается за счет убыли внутренней энергии системы.
Эксперты в области статфизики. Рассмотрим пример работы идеального газа по перемещению поршня в цилиндре. Давление газа на поршень обусловлено ударами большого числа молекул, вследствие чего поршень получает суммарный импульс. Положение поршня является внешним параметром термодинамической системы. Энергия хаотического движения молекул переходит в механическую энергию упорядоченного движение макроскопического тела – поршня, который является внешним по отношению к газу телом. Внутренняя энергия газа уменьшается на величину совершенной работы. Молекулярно-кинетический механизм убыли внутренней энергии заключается в том, что при расширении газа молекула, отраженная от удаляющегося поршня, будет иметь меньший по модулю импульс, чем до удара о поршень. Это приводит к уменьшению средней кинетической энергии молекул, следовательно, уменьшение температуры газа. При сжатии (работа над газом) средняя кинетическая энергия увеличивается, т.к. в этом случае молекула, отраженная от набегающего поршня, будет иметь больший по модулю импульс, чем до удара о поршень. Если лекционное время позволяет, то можно привести соответствующие расчеты или же предложить эту работу на дом с указанием, что в расчетах следует рассматривать скорость молекул по отношению к относительно медленно движущемуся массивному поршню.
Преподаватель. Обсудим понятие теплоты.
Эксперты в области термодинамики: Обмен теплом осуществляется при контакте двух тел с разной температурой. При контакте двух тел с разной температурой с течением времени устанавливается термодинамическое равновесие. Это равновесие осуществляется передачей тепла от горячего к холодному телу, при этом внутренняя энергия одной физической системы переходит во внутреннюю энергию другой системы. Важное обстоятельство в понимании процесса теплопередачи заключается в том, что при передаче тепла положение внешних тел как внешних параметров термодинамической системы не изменяются.
Эксперты в области статфизики. При контакте двух тел с разной температурой с течением времени устанавливается термодинамическое равновесие. Микроскопический механизм установления равновесия выражается во взаимодействии молекул холодной и горячей систем. При взаимодействии систем с разной температурой средняя кинетическая энергия молекул этих систем <e> = 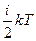 изменяется: у более холодного тела возрастает, у нагретого – понижается. В этом проявляется механизм переноса внутренней энергии из одной системы в другую. В силу распределения молекул по скоростям на границе контакта двух систем на микроуровне имеют место процессы переноса энергии как в ту, так и в другую систему и под dQ понимается «результирующая» переносимая энергия в сторону менее нагретого тела. Подчеркнем, что закон сохранения энергии не накладывает ограничения на направление переноса энергии. Например, согласно первому началу термодинамики можно вскипятить воду в чайнике, поставив его на холодный лед. При этом закон сохранения энергии не будет нарушен, если предположить, что вода нагревается за счет внутренней энергии льда.
изменяется: у более холодного тела возрастает, у нагретого – понижается. В этом проявляется механизм переноса внутренней энергии из одной системы в другую. В силу распределения молекул по скоростям на границе контакта двух систем на микроуровне имеют место процессы переноса энергии как в ту, так и в другую систему и под dQ понимается «результирующая» переносимая энергия в сторону менее нагретого тела. Подчеркнем, что закон сохранения энергии не накладывает ограничения на направление переноса энергии. Например, согласно первому началу термодинамики можно вскипятить воду в чайнике, поставив его на холодный лед. При этом закон сохранения энергии не будет нарушен, если предположить, что вода нагревается за счет внутренней энергии льда.
Независимые эксперты. Внутренняя энергия является функцией состояния термодинамической системы. Возвращаясь в исходное состояние, независимо от пути перехода, внутренняя энергия системы не изменяется. Внутренняя энергия содержится в системе. Работа и теплота являются функциями процесса – теплота и работа совершаются. Значения этих величин зависят от пути перехода системы из одного состояния в другое.
Преподаватель.Обсудим содержание второго начала термодинамики.
Независимые эксперты: Исходный эмпирический факт, лежащий в основании второго начала термодинамики, - направленность самопроизвольных процессов в природе. Идея о направленности процессов в природе и их необратимости в неявной форме содержится уже в нулевом начале термодинамики.
Идея о направленности процессов в природе выражена в формулировке второго начала, которую предложил Клаузиус: теплота не может самопроизвольно переходить от менее нагретого тела к телу более нагретому.
Ключевым понятием в формулировке Клаузиуса является понятие самопроизвольного процесса. Под самопроизвольнымпроцессом в системе двух тел, находящихся в тепловом контакте, понимается процесс, когда в окружающих телах никаких изменений не происходит. В формулировке Клаузиуса вовсе не содержится утверждение, что переход от холодного тела к горячему запрещен. Такой переход возможен при условии, если в окружающих телах происходят соответствующие изменения - так называемые компенсирующие процессы. Например, такие процессы во внешних телах происходят при работе холодильной машины, где переход тепла от холодного к горячему происходит не самопроизвольно, а за счет работы компрессора как части внешней системы. Работа компрессора над рабочим телом холодильника осуществляется за счет электрической энергии, поступающей в компрессор.
Любая тепловая машина состоит из нагревателя с температурой Т1, холодильника с температурой Т2. Между нагревателем и холодильником находится рабочее тело тепловой машины. В соответствии с формулировкой Клаузиуса поток тепла направлен от нагревателя к холодильнику. КПД тепловой машины, работающей по циклу Карно, определяется выражением:
h = 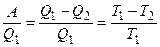 .
.
Приведем формулировку второго начала Томсона-Планка: невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара. Обе формулировки эквивалентны.
Второе начало термодинамики вводит функцию состояния – энтропию.
Энтропия S – это самостоятельная характеристика состояния термодинамической системы. Термин «энтропия» ввел Р. Клаузиус из анализа работы С. Карно «Размышление о движущей силе огня». [26 c. 73-175, 179].
Второе начало термодинамики содержит два утверждения: 1) существование функции состояния термодинамической системы – энтропии и постоянство энтропии системы в обратимых циклических процессах; 2) возрастание энтропии в адиабатически изолированной системе, в которой происходит необратимый процесс. Уменьшение энтропии в изолированной системе в принципе невозможно при любых преобразованиях энергии.
Эксперты в области термодинамики: Обычно понятие термодинамической энтропии вводится из обобщения выражения для к.п.д. идеального цикла Карно. За цикл для рабочего тела теплового двигателя верно соотношение (с учетом знака Q2):
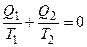 .
.
Это соотношение похоже на закон сохранения. В обратимом цикле в рабочем теле сохраняется некоторая величина S0. Из обобщения на произвольный обратимый цикл получаем равенство Клаузиуса:
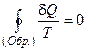 .
.
Клаузиус постулировал, что в термодинамической системе существует функция состояния S, называемая термодинамической энтропией, которая характеризует состояние этой системы подобно температуре, внутренней энергии, давлении. Эта характеристика системы будет изменяться, если в систему подвести порцию тепла dQ при данной температуре системы T, на величину: dS = 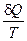 .
.
Энтропия S – это самостоятельная характеристика состояния термодинамической системы, а вышеуказанное выражение определяет приращение энтропии. В частности, если состояние системы не изменяется (термодинамическая система находится в равновесии), то система обладает определенной энтропией. Энтропия как функция состояния является характеристикой любой термодинамической системы и вовсе не ограничивается сферой рабочих тел тепловых двигателей, а метод циклов является наглядным и содержательным способом обнаружения этой функции состояния у термодинамических систем.
Эксперты в области статфизики: Возрастание энтропии при необратимых процессах соответствует переходу системы из менее в более вероятное состояние. В частности, из этого следует, что состояние равновесия (нулевое начало) является наиболее вероятным состоянием. Макросостояние в каждом равновесном состоянии остается неизменным и реализуется соответствующим набором микросостояний молекул. Понятия микро- и макросостояния, а также статистическую интерпретацию понятия энтропии удобно моделировать известным примером с десятью монетами на подносе.
Вначале десять монет уложены на поднос максимально упорядоченно: все монеты лежат, например, орлами вверх. После двух-трех встряхиваний подноса монеты будут лежать разными сторонами. Причем на подносе в основном реализуются случаи 4-6, 5-5, 6-4, реже 3-7, очень редко 2-8, практически не будут наблюдаться ситуации 1-9 и 0-10 (нами проделано более пятидесяти таких экспериментов).
Назовем ситуацию с конкретным расположением сторон всех монет на подносе макросостоянием этой системы, а число способов реализации данного макросостояния – числом микросостояний системы w (таб. 2, показывает на слайде). Например, макросостояние (8-2) (макроситуация на подносе) может быть реализовано 45-ю «микросостояниями», т.е. ориентациями сторон конкретных монет. Макросостояние (8-2) реализуется, например, следующим образом: монета № 2 – решка, монета № 7 – решка, остальные монеты лежат орлами вверх. Это же макросостояние может быть реализовано другим «микросостоянием» монет: монета № 5 – решка, монета № 9 – решка, остальные монеты лежат орлами вверх, и таких возможностей – 45. Общее число микросостояний 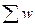 = 210 = 1024. Вероятность реализации, например, состояния (10-0) составляет ~ 1/1000, состояния (9-1) ~ 1/100, а состояния (5-5) ~ 1/4.
= 210 = 1024. Вероятность реализации, например, состояния (10-0) составляет ~ 1/1000, состояния (9-1) ~ 1/100, а состояния (5-5) ~ 1/4.
Таблица 2
Макросостояния и микросостояния системы
| Макросостояние (- орел; ¯- решка) | 10 0¯ | 9 1¯ | 8 2¯ | 7 3¯ | 6 4¯ | 5 5¯ | 4 6¯ | 3 7¯ | 8 2¯ | 9 1¯ | 10 0¯ |
| Микросостояние (число способов реализации w) | 1 | 10 | 45 | 120 | 210 | 252 | 210 | 120 | 45 | 10 | 1 |
Таким образом, на подносе в основном будет наблюдаться макросостояния, вероятность реализации которых максимальна.
Система, находящаяся в максимально упорядоченном состоянии (10-0), переходит в состояние менее упорядоченное (4-6), (5-5), (6-4). Величину w называют термодинамической вероятностью или статистическим весом. Статистический вес равен числу микросостояний, которыми реализуется данное макросостояние.
Если число монет на подносе n = 50, то 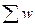 = 250 » 1015, а при n = 100 общее число микросостояний
= 250 » 1015, а при n = 100 общее число микросостояний 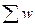 = 2100 » 1030, т.е. с увеличением числа объектов вероятность реализации упорядоченного состояния резко уменьшается. В одном моле вещества содержится число Авогадро частиц – NA = 6,02×1023. В системе при самопроизвольных процессах реализуется наиболее вероятное разупорядоченное состояние. Анализ этого модельного примера с монетами дает нам представление о молекулярно-кинетическом механизме направленности самопроизвольных процессов в изолированных системах к равновесному состоянию с максимумом энтропии: выравнивание температуры, давления, концентрации и т.п.
= 2100 » 1030, т.е. с увеличением числа объектов вероятность реализации упорядоченного состояния резко уменьшается. В одном моле вещества содержится число Авогадро частиц – NA = 6,02×1023. В системе при самопроизвольных процессах реализуется наиболее вероятное разупорядоченное состояние. Анализ этого модельного примера с монетами дает нам представление о молекулярно-кинетическом механизме направленности самопроизвольных процессов в изолированных системах к равновесному состоянию с максимумом энтропии: выравнивание температуры, давления, концентрации и т.п.
Проведя параллель между ростом термодинамической энтропии при приближении к равновесию и ростом при этом термодинамической вероятности, можно записать, что S ~ w (аналогичный подход осуществлялся при введении молекулярно-кинетической трактовки температуры). Для обоснования формулы Больцмана исходим из следующих предпосылок:
1) энтропия максимально упорядоченной системы примем равной нулю (к этому возвращаемся при рассмотрении третьего начала), с ростом энтропии упорядоченность снижается, т.е. энтропию можно рассматривать как меру неупорядоченности, меру хаоса в системе;
2) физическая величина является мерой какого-то свойства объекта или взаимодействия, если: а) обращается в нуль в отсутствии этого свойства или взаимодействия; б) изменяется в соответствии с этим свойством (взаимодействием). Например, сила является одной из мер взаимодействия тел, масса является мерой инертных свойств тела;
3) из примера с монетами следует, что при максимальной упорядоченности термодинамическая вероятность w = 1 (система реализуется единственным способом и в этом смысле хаос в системе отсутствует). Следовательно (предыдущий пункт), сама по себе термодинамическая вероятность w не может служить мерой энтропии, за меру энтропии принимаем логарифм термодинамической вероятности S ~ lnw. При полной упорядоченности (отсутствии хаоса) статистическая энтропия системы равна нулю (ln 1 = 0).
Больцман, а затем Планк, установили статистическую трактовку энтропии в форме S = k lnw,
где k = 1,38 ×10-23 Дж/К – постоянная Больцмана, введенная Планком.
Независимые эксперты. Из этого обсуждения следует, что хотя между термодинамической энтропией и энтропией Больцмана имеется корреляция, но эти представления не тождественны. Термодинамическая энтропия оперирует макроскопическими характеристиками системы, которые являются функциями координат и скоростей большого числа молекул. В состоянии термодинамического равновесия остаются постоянными не сами эти функции, а средние их значения за достаточно большой промежуток времени. Этими средними значениями оперирует термодинамическая энтропия. Энтропия же Больцмана оперирует понятием микросостояния. Макросостояние выражается усреднением микросостояний.
Преподаватель. Последний вопрос для обсуждения– третье начало термодинамики.
Эксперты в области статфизики. Согласно формуле Больцмана возрастание упорядоченности системы соответствует уменьшению статистического веса (в пределе w = 1) и, соответственно, уменьшению энтропии системы. Если принять, что при T = 0 K статистический вес термодинамической системы минимальный, то энтропия системы при T® 0K стремится к своему минимальному значению: 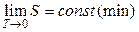 . Смысл теоремы Нернста заключается в утверждении, что при T = 0 K энтропия системы имеет минимальное фиксированное значение и вблизи абсолютного нуля процессы происходят без изменения энтропии. Это утверждение и составляет содержание теоремы Нернста. Значение при T = 0 K удобно принять равным нулю (w = 1):
. Смысл теоремы Нернста заключается в утверждении, что при T = 0 K энтропия системы имеет минимальное фиксированное значение и вблизи абсолютного нуля процессы происходят без изменения энтропии. Это утверждение и составляет содержание теоремы Нернста. Значение при T = 0 K удобно принять равным нулю (w = 1): 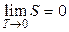 .
.
Эксперты в области термодинамики. Из понятия термодинамической энтропии (точнее, приращения энтропии) 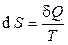 следует, что при понижении температуры системы (охлаждения системы) ее энтропия уменьшается. Третье начало постулирует, что уменьшение энтропии при приближении к нулевой абсолютной температуре имеет предел, который стремится к определенному конечному пределу. Этот предел считается равным нулю:
следует, что при понижении температуры системы (охлаждения системы) ее энтропия уменьшается. Третье начало постулирует, что уменьшение энтропии при приближении к нулевой абсолютной температуре имеет предел, который стремится к определенному конечному пределу. Этот предел считается равным нулю: 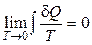 . При T = 0 K энтропия системы не зависит от всевозможных характеристик вещества (агрегатного состояния, давления, химического состава и т. д.) и принимается равной нулю S0 = 0. Данный постулат имеет опосредованное экспериментальное основание: теплоемкость твердых тел не является постоянной величиной и становится исчезающее малой при приближении к Т = 0 К. Теорема Нернста фактически постулирует, что при абсолютном нуле температуры все процессы происходили бы без изменения энтропии. Из теоремы Нернста получаем важное следствие: температура 0 К не может быть достигнута конечным числом процессов в термодинамической системе.
. При T = 0 K энтропия системы не зависит от всевозможных характеристик вещества (агрегатного состояния, давления, химического состава и т. д.) и принимается равной нулю S0 = 0. Данный постулат имеет опосредованное экспериментальное основание: теплоемкость твердых тел не является постоянной величиной и становится исчезающее малой при приближении к Т = 0 К. Теорема Нернста фактически постулирует, что при абсолютном нуле температуры все процессы происходили бы без изменения энтропии. Из теоремы Нернста получаем важное следствие: температура 0 К не может быть достигнута конечным числом процессов в термодинамической системе.
Преподаватель.Обратим внимание на обобщающую схему, на которой пока не указаны логические связи между структурными элементами термодинамики и укажем эти связи. Методология учебного познания по термодинамике соответствует гносеологической цепочке познания - от единичного к общему, а от него - к предельно общему. Термодинамика как фундаментальная физическая теория содержит эмпирическое основание, теоретическое ядро и дедуктивные следствия. Начала термодинамики вместе с теоретической моделью тел образуют теоретическое ядро термодинамики и образующими постулативную базу этой физической теории. Нулевое, первое и второе начала вводят в структуру термодинамики функции состояния: температуру T, внутреннюю энергию U, энтропию S. Третье начало не вводит в термодинамику какую-то новую функцию состояния, однако это начало реализует численную определенность других функций состояния (термодинамических потенциалов), которые вводятся в термодинамику для описания конкретных термодинамических систем. Экспериментальная проверка выводных (дедуктивных) законов, описывающих свойства конкретных термодинамических систем, опосредованно подтверждают верность начал термодинамики.
Дата добавления: 2022-01-22; просмотров: 58; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
