Норма Аспартатаминотрансферазы (АСТ / АсАТ)
План лекции
1. Клинико-диагностическое значение исследования активности трансаминаз (АлТ, АсТ).
2. Клинико-диагностическое значение исследования активности трансаминаз - ЛДГ в сыворотке крови.
3. Изоферменты АлТ, АсТ, ЛДГ, катализируемая реакция, локализация в органах и тканях, диагностическое значение определения активности в крови.

Клинико-диагностическое значение исследования активности трансаминаз (АлТ, АсТ).
Трансаминазы – (аминотрансферазы) АлАТ и АсАТ катализируют процессы переаминирования, т.е. обратимого переноса аминогруппы (– NH2) от АК на кетокислоту, с образованием новой АК.
АсАТ катализирует реакцию:
АсАТ

 Аспарагиновая кислота + Глютаминовая кислота + ЩУК
Аспарагиновая кислота + Глютаминовая кислота + ЩУК
+ L- кетоглутаровая кислота
АлАТ катализирует реакцию:
АлАТ
 L-аланин +L-кетоглутаровая Глютаминовая кислота + ПК
L-аланин +L-кетоглутаровая Глютаминовая кислота + ПК
Кислота
Процесс переаминирования был открыт русскими учёными Крицман и Браунштейн (муж и жена) в 1937 году. Впервые в 1954 году Врублевский и Карман обнаружили подъем АсАТ в сыворотке крови у больного с острым инфарктом миокарда. Причем повышение активности фермента наблюдалось через 4 – 6 часов, держалось весь острый период и спадало при начале рубцевания; Было замечено, что чем больше очаг поражения, тем выше активность АсАТ.
Эти ферменты широко распространены в организме: в печени, в почках, мышце сердца, скелетной мускулатуры. Но количество ферментов в разных органах различно. Так в сердце АсАТ больше чем АлАТ, в печени АлАТ больше чем АсАТ. Коэффициент де - Ритиса - это отношение АсАт/АлАТ, который в сердце здорового человека равен 1,33. При инфаркте миокарда коэффициент выше, при гепатите ниже. Поэтому определение активности данных ферментов используется для ранней диагностики заболеваний (определение активности АлАТ в дожелтушный период при паренхиматозной желтухе назначается всем контактным), а также для дифференциальной диагностики: (при паренхима-тозной желтухе активность АлАТ, АсАТ выше нормы, при механической – в норме).
Аланинаминотрансфераза (АЛТ, АлАТ)
Аланинаминотрансфераза (АЛТ, АлАТ) – фермент, относящийся к аминотрансферазам (трансаминазам), то есть осуществляющим перенос аминокислот с одной биологической молекулы на другую. Поскольку в названии фермента присутствует аминокислота аланин, это означает, что данный фермент переносит именно аминокислоту аланин. АЛТ синтезируется в клетках, поэтому в норме его активность в крови невысока. Преимущественно синтезируется в клетках печени, но также имеется в клетках почек, сердца, мышцах и поджелудочной железе.
Повышение активности АЛТ у здоровых людей (физиологическое) может быть вызвано приемом некоторых лекарственных препаратов (антибиотиков, барбитуратов,наркотиков, противоопухолевых препаратов, оральных контрацептивов, нестероидных противовоспалительных препаратов, дикумаринов, эхинацеи, валерианы), сильными физическими нагрузками,травмами. Также высокая активность АЛТ наблюдается у подростков в период интенсивного роста.
Норма Аланинаминотрансферазы
| · для мужчин | до 40 | Ед/л |
| · для женщин | до 32 | Ед/л |
АЛТ в диагностике заболеваний печени
При диагностике патологических состояний организма повышение активности АЛТ является специфическим признаком острого заболевания печени. Повышение активности АЛТ в крови выявляется за 1-4 недели до проявления симптомов болезни и за 7-10 дней до появления максимального уровня билирубина в крови. Увеличение активности АЛТ при остром заболевании печени составляет 5-10 раз. Повышенная активность АЛТ в течение длительного времени или повышение ее в поздние сроки заболевания свидетельствует о начале массивного некроза печени.
Причины высокого АлАТ (АлАТ)
Высокая активность АЛТ в крови выявляется при наличии таких патологий :
· острый гепатит
· цирроз
· механическая желтуха
· введение гепатотоксических препаратов (например, некоторые антибиотики, отравление солями свинца)
· распад большой опухоли
· рак печени или метастазы в печени
· ожоговая болезнь
· обширный инфаркт миокарда
· травматические повреждения мышечной ткани
Снижение активности АЛТ.
· При тяжелых заболеваниях печени (цирроз тяжелой формы, некроз печени), когда сокращается количество активных клеток печени
· при дефиците витамина В6
Аспартатаминотрансфераза (АСТ, АсАТ)
Аспартатаминотрансфераза (АСТ, АсАТ) – фермент из группы трансаминаз, который осуществляет перенос аминокислоты аспартата с одной биологической молекулы на другую. Коферментом АСТ является витамин В6. АСТ является внутриклеточным ферментом, то есть в норме находиться в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях. Наибольшая активность АСТ выявлена в сердце, печени, мышцах и почках.
Норма Аспартатаминотрансферазы (АСТ / АсАТ)
Возможны более высокие значения активности АСТ у здоровых людей(физиологические) при чрезмерных мышечных нагрузках, приеме некоторых лекарств, например, эхинацеи,валерианы,алкоголя, больших доз витамина А,
парацетамола, барбитуратов, антибиотиков и т.д
.
| · для мужчин | 15-31 | Ед/л |
| · для женщин | 20-40 | Ед/л |
| Норма АСТ/АсАт | ||
Активность АСТ в сыворотке крови повышается в 4-5 раз при инфаркте миокарда и сохраняется таковой в течение 5 дней. Если активность АСТ держится на высоком уровне и не снижается в течение 5 дней после приступа, то это говорит о неблагоприятном прогнозе для больного с инфарктом миокарда. Если наблюдаются ещё повышения активности фермента в крови, то данный факт свидетельствует о расширении зоны инфаркта.
При некрозе или повреждении печеночных клеток также повышается активность АСТ. Причем чем выше активность фермента, тем больше степень повреждения.
Повышение активности АСТ крови присутствует в следующих случаях:
· гепатиты
· некроз печени
· цирроз
· алкоголизм
· рак печени и метастазы в печени
· инфаркт миокарда
· наследственные и аутоиммунные заболевания мышечной системы (миодистрофия Дюшена)
· мононуклеоз
· гепатоз
· холестаз
Существует еще целый ряд патологических состояний, при которых также происходит увеличение активности АСТ. К таким состояниям относят – ожоги, травмы, тепловой удар, отравление ядовитыми грибами.
Низкая активность АСТ наблюдается при дефиците витамина В6 и наличии обширных повреждений печени (некроз, цирроз).
Однако в клинике используют определение активности АСТ в основном для диагностики повреждений сердца и печени. При других патологических состояниях активность фермента также изменяется, однако ее изменение не является специфичным, следовательно, не представляет высокой диагностической ценности.
Коэффициент де Ритиса. Как отличить инфаркт от повреждения печени?
Для дифференциальной диагностики повреждений печени или сердца используют коэффициент де Ритиса. Коэффициент де Ритиса – это соотношение активности АСТ/АЛТ, который в норме составляет 1,3. Увеличение коэффициента де Ритиса выше 1,3 характерно для инфаркта миокарда, и снижение его ниже 1,3 – выявляется при заболеваниях печени.
2. Клинико-диагностическое значение исследования активности трансаминаз - ЛДГ в сыворотке крови.
Лактатдегидрогеназа (ЛДГ)
Лактатдегидрогеназа (ЛДГ) – это фермент, который содержится в цитоплазме клеток почек, сердца, печени, мышц, селезенки, поджелудочной железы. Коферментом ЛДГ являются ионы цинка и никотинамидадениндинуклеотид (НАД). ЛДГ участвует в обмене глюкозы, катализируя превращение лактата (молочной кислоты) в пируват (пировиноградную кислоту). В сыворотке крови имеется пять изоформ данного фермента.ЛДГ1 и ЛДГ2 изоформы сердечного происхождения, то есть содержатся преимущественно в сердце. ЛДГ3, ЛДГ4 и ЛДГ5 – печеночного происхождения.
Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
- Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ .
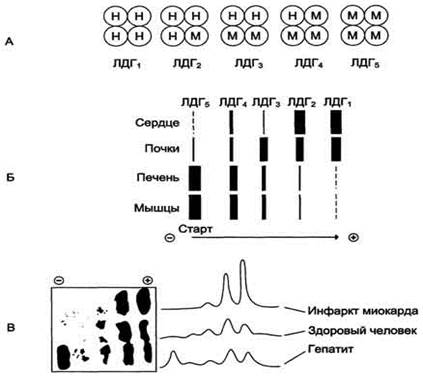
Повышение наблюдается при
- остром инфаркте миокарда (через 6-8 часов от начала заболевания,
держится весь острый период, снижается при стихании процесса, т.е. имеет не только диагностическое, но и прогностическое значение, особенно ЛДГ1 и 2 (max ч/з 36-48 ч);
- вирусном гепатите, опухолях в печени (ЛДГ4 и 5);
- повреждении и атрофии мышц (ЛДГ3, 4 и 5);
- гемолитических анемиях.
ЛДГ может иметь сниженную активность на фоне уремии (увеличения концентрации мочевины).
Увеличение активности ЛДГ –1 или ЛДГ –1/ ЛДГ –2 наблюдается при: остром инфаркте миокарда; анемиях; опухолях половых желёз.
Повышение активности ЛДГ – 5 происходит при: заболеваниях печени; повреждениях скелетных мышц; раке.
Повышение активности ЛДГ – 3 (и отчасти ЛДГ – 4 и ЛДГ –5) отмечается при: тромбозе, эмболии легочной артерии, легочной эмболии; почечных заболеваниях.
Повышение активности ЛДГ – 4 и ЛДГ –5 выявлено при: поражениях паренхимы печени; повреждениях скелетных мышц.
Норма лактатдегидрогеназы (ЛДГ) крови
| · взрослые | 0,8-4 мкмоль/ч*л | 140-350 Ед/л |
| · новорожденные | 2,0-8 мкмоль/ч*л | 400-700 Ед/л |
| Нормы ЛДГ крови | ||
Диагностическое значение изоформ ЛДГ
Для диагностики различных заболеваний большей информативностью обладает определение активности именно изоформ ЛДГ. Например, при инфаркте миокарда наблюдается значительное повышение ЛДГ1. Для лабораторного подтверждения инфаркта миокарда определяют соотношение ЛДГ1/ЛДГ2, и, если данное соотношение больше 1, значит у человека был инфаркт миокарда. Однако такие тесты широко не используютсяввиду их дороговизны и сложности. Обычно проводят определение общей активности ЛДГ, которая складывается из суммарной активности всех изоформ ЛДГ.
Норма ЛДГ у здоровых людей:
Возможно повышение активности ЛДГ у здоровых людей (физиологическое) после физических нагрузок, во время беременности и после принятия алкоголя. Кофеин, инсулин, аспирин, ацебутолол, цефалоспорины, гепарин, интерферон, пенициллин, сульфаниламиды также вызывает увеличение активности ЛДГ.
Дата добавления: 2022-01-22; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
