Галогенирование присоединительное
Тема 1 «Закономерности изменения физических свойств. Химические свойства (на примере метана и этана): реакции замещения (галогенирование), дегидрирования как способы получения важнейших соединений в органическом синтезе. Горение метана как один из основных источников тепла в промышленности и быту. Нахождение в природе и применение алканов. Способы получения алканов.».
Тема 2 «Алкены. Строение молекулы этилена. Гомологический ряд алкенов. Номенклатура. Изомерия углеродного скелета и положения кратной связи в молекуле. Физические и химические свойства: реакции присоединения (галогенирование, гидрирование, гидратация, гидрогалогенирование) как способ получения функциональных производных углеводородов, горения. Правило Марковникова.».
Материал к теме 1:
Температуры плавления и кипения алканов увеличиваются с увеличением длины цепи. Низкомолекулярные алканы (до C4 включительно) – бесцветные газы без запаха, средние алканы (C5 включительно – С17) – бесцветные жидкости, более высокомолекулярные алканы – твердые вещества.
Все алканы легче воды, все они нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Жидкие алканы и сами используются как неполярные растворители.
Нахождение в природе
Природный газw почти полностью состоит из низших алканов (С1 – С4), главным образом из метана (75 – 98 %, состав сильно зависит от месторождения).
|
|
|
Главным источником более высокомолекулярных алканов является нефтьw. Нефть – это сложная смесь из тысяч индивидуальных веществ, но в основном она состоит из углеводородов, в частности алканов, аренов и некоторых других.
При перегонкеw нефть разделяют на несколько фракций. Легкие фракции (в частности, бензинw) содержат небольшие алканы, в основном С7 – С8. Керосинw – более тяжелая фракция, содержит смесь алканов С8 – С15. Еще тяжелее дизельw. Самая тяжелая фракция нефти, которая уже не поддается перегонке – гудронw – это вязкая черная жидкость или асфальтоподобный твердый остаток, состоящий из очень высокомолекулярных углеводородов сложного строения.
Химические свойства алканов
Алканы – весьма инертные соединения, для них характерно ограниченное число реакций. Благодаря своей инертности алканы часто используются как неполярные растворители. Еще пример использования пассивности алканов: щелочные металлы невозможно хранить на воздухе, так как они мгновенно реагируют с кислородом, водяными парами, углекислым газом, даже с азотом. Зато их хранят под слоем керосина, и ок.
Алканы не окисляются даже такими сильными окислителями, как перманганат калия или дихромат калия, они не реагируют с кислотами (исключение – нитрование) и щелочами.
|
|
|
Галогенирование
Реакция проходит при УФ-облучении, происходит замещение водрода на галоген (бром или хлор).
Хлорирование идет бурно и легко продолжается до полихлоралканов:
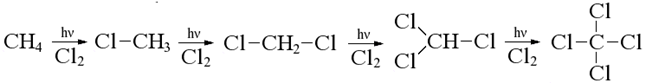
Дегидрирование
Реакция идет при нагревании в присутствии катализатора, в зависимости от длины цепи алкана могут получиться разные продукты:
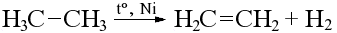
Этан и пропан дают при дегидрировании этилен и пропилен соответственно.
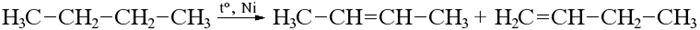
Бутан дает смесь изомеров, но преобладает бутен-2.
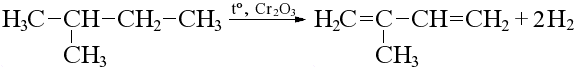
Горение
Важнейшие виды топлива – это алканы (топливный газ, бензин, керосин, дизель), на воздухе они подвергаются полному окислению (горению) до углекислого газа и воды:
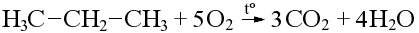
Особые случаи (реакции, характерные для отдельных представителей класса)
Термическое разложение метана:
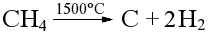
Медленное ражложение, образование сажи.

Быстрое (доли секунды) разложение, получение ацетилена.
Паровая конверсия метана:
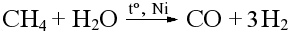
Каталитическое окисление метана:
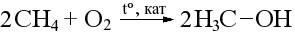
Изомеризация
Проходит при нагревании в присутствии катализатора, образуются замещенные алканы:
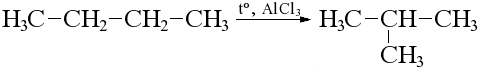
н-бутан изобутан
|
|
|
Получение алканов
Химические способы получения алканов редко используются, т.к. основной источник алканов – полезные ископаемые (природный газ, нефть, см. выше). Индивидуальные соединения выделяют из нефти перегонкойw.
Некоторые алканы получают из других алканов (чье содержание в нефти больше) нефтехимическими методами: крекинг тяжелых фракций нефти, изомеризация.
Реакция Вюрца
Получение симметричных алканов из галогеналканов:
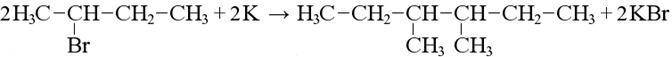
Реакция Дюма
Декарбоксилирование солей карбоновых кислот:

Материал к теме 2:
Определение, номенклатура
Алкены – это углеводороды, содержащие одну двойную связь. Например:
| C2H4 | этилен (этен) | 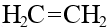
| 
|
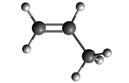
| C3H6 | пропилен (пропен) | 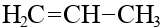
| 
|
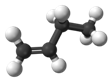
| C4H8 | бутен-1 | 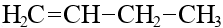
| 
|
Систематическое название простейшего алкена строится из:
- корня, указывающего на число атомов в цепи,
- суффикса «ен», указыващего на класс «алкены»
- номера, указывающего на положение двойной связи в цепи.
Например, см. разбор названия «гексен-2» на картинке справа.
Положение (локант) двойной связи – это номер первого углерода из тех двух, между которыми расположена двойная связь (на картинке подчеркнут красным)
Нумерация цепи начинается с того конца, к которому ближе двойная связь, например:
|
|
|
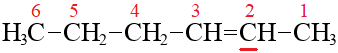
Здесь молекула нарисована «перевернуто», двойная связь ближе к правому концу, нумеруем справа-налево: гексен-2.
Если у алкена есть углеводородные радикалы, перечисляем их перед названием родоначальной цепи, так, как это делалось и с алканами:
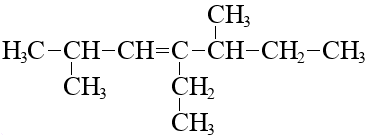
2,5-диметил-4-этилгептен-3
Однако есть нюансы:
Двойная связь приоритетнее заместителя при выборе нумерации цепи. Нумерация ведется от того конца, к которому ближе двойная связь, независимо от положений заместителей. Например:
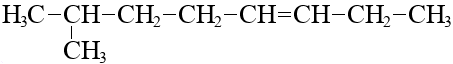
Заместитель ближе к левому концу, но двойная связь – к правому, нумеруем справа-налево: 7-метилоктен-3.
Участок с двойной связью должен оказаться внутри родоначальной цепи, независимо от его длины:
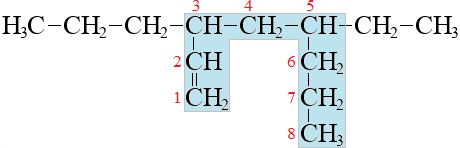
3-пропил-5-этилоктен-1
Если возможен лишь один вариант молекулы с данным названием, нумеровать связи и заместители бессмысленно:
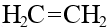 этен
этен
|  метилпропен
метилпропен
| 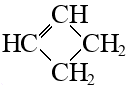 циклобутен
циклобутен
|
Тривиальные названия
Некоторые алкены и алкадиены имеют не только систематические, но и исторически устоявшиеся традиционные (тривиальные) названия:
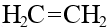 этилен
этилен
| 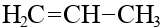 пропилен
пропилен
| 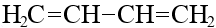 дивинил
дивинил
|
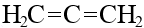 аллен
аллен
|  изобутилен
изобутилен
| 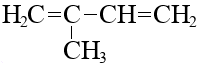 изопрен
изопрен
|
Также полезно помнить тривиальные названия двух важнейших непредельных радикалов:
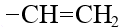 винил
винил
|  аллил
аллил
|
Общая формула
Общая формула алкенов:
CnH2n
То есть на каждый углерод (n) приходится по два водорода (2n). Напомню, что общая формула алканов CnH2n+2, то есть алкен имеет на два водорода меньше, чем алкан: за счет своей двойной связи.
Общая формула алкадиенов CnH2n-2 – еще на два водорода меньше, чем у алкенов, и т. д.
Изомерия
Как и для алканов, для алкенов характерна структурная изомерия, она бывает двух видов:
Изомерия углеродного скелета, вот эти две молекулы отличаются только скелетом:
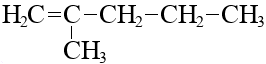 2-метилпентен-1
2-метилпентен-1
| 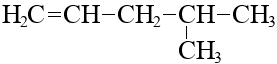 4-метилпентен-1
4-метилпентен-1
|
Изомерия положения кратной связи:
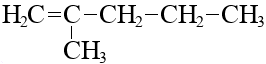 2-метилпентен-1
2-метилпентен-1
|  2-метилпентен-2
2-метилпентен-2
|
Кроме структурной изомерии для алкенов характерна геометрическая изомерия или цис-транс-изомерия.
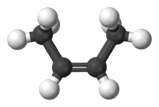
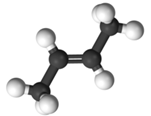
Разница между цис-изомером и транс-изомером не видна в обычных структурных формулах, чтобы ее продемонстрировать, следует воспользоваться более точным изображением структуры молекулы, лучше всего это видно на 3D-моделях, например, так выглядят два изомера бутена-2:
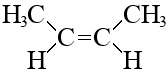 цис-бутен-2
цис-бутен-2
| 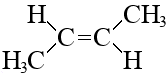 транс-бутен-2
транс-бутен-2
|
| 
|
Суть в том, как располагаются «кончики» углеродной цепи относительно плоскости двойной связи. Если кончики по одну сторону от этой плоскости – это цис-изомер, по разные стороны – транс-изомер.
Геометрических изомеров не может быть у терминального алкена, т.к. у него нет одного из кончиков.
Цис- и транс-изомеры одного и того же (структурно) вещества могут отличаться по физическим свойствам и биологическому действию. Например, цис-пентен-2 кипит при 37 °C, а транс-изомер при при 36 °C.
Физические свойства
Как и у алканов, у алкенов температуры плавления и кипения возрастают в гомологическом ряду.
Низшие алкены (до С4 включительно) – бесцветные газы без запаха. Средние алкены (до С17) – бесцветные жидкости. Высшие алкены – твердые вещества.
Алкены, как и алканы: неполярные вещества, они не растворяются в воде, легче воды.
Химические свойства
Реакции присоединения
Гидрирование
Реакция протекает в присутствии катализатора Ni или Pd. Водород присоединяется по месту разрыва двойной связи, образуются алканы:

Галогенирование присоединительное
В отличие от алканов, для которых характерно заместительное галогенирование, алкены присоединяют атомы галогена по месту разрыва двойной связи, образуются дигалогеналканы:

Обесцвечивание бромной воды – качественная реакция на непредельные УВ.
Реакция не требует облучения или нагревания.
Гидрогалогенирование
Реакция идет по Правилу Марковникова, образуются галогеналканы:
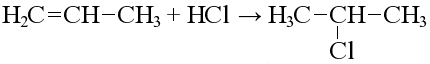
Гидратация
Реакцию проводят в присутствии серной кислоты, образуются спирты. Результат реакции также подчиняется Правилу Марковникова:
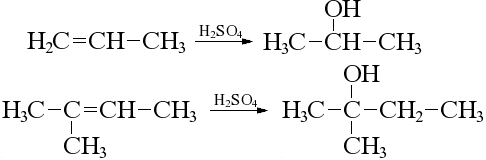
Реакции окисления
Дата добавления: 2022-01-22; просмотров: 35; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
