Обобщение и систематизация знаний
Закон Авогадро. Молярный объем газов. Относительная плотность газов. Объемные отношения газов при химических реакциях
Цель урока. Сформировать понятие о молярном объеме газов. Научить производить расчеты, используя закон Авогадро и следствие из него.
Научить вычислять по химическим уравнениям объем газа (по известной массе или количеству вещества), массу или количество вещества (по известному объему газа) одного из вступивших в реакцию или получившихся в результате реакции веществ. Сформировать понятие об относительной плотности газов. Научить производить расчеты, используя понятие «относительная плотность газов». Сформировать умение вычислять объемы газов, участвующих в химических реакциях.
Изучение нового материала
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.):
| V m = 22,4 л/моль н.у. – это p = 1амт (101325 Па) t = 0 ˚C (273 К) |
|
|
|
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
υ = V / V m = N / N a = m / M
M = ρ V m
На основании закона Авогадро и следствия из него производите расчеты.
Задача 1. Рассчитайте, какой объем занимают 5 моль аммиака (н. у.).
Задача 2. Рассчитайте, какой объем при нормальных условиях займет оксид углерода(IV) массой 5,6 г.
Задача 3. Определите массу 5 л аммиака (н. у.). Какое количество вещества аммиака заключено в этом объеме?
Задача 4. Определите, какой объем занимают 1,204 · 1023 молекул кислорода (н. у.).
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
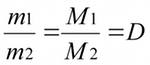
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N 2 по воздуху?
|
|
|
| Дано: N 2 М(воздуха) = 29 | Решение: Dвоздуха (N 2)= Mr(N 2)/Mr(воздуха)=Mr(N 2)/29. Mr(N 2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N 2)= Mr(N 2)/Mr(воздуха)=Mr(N 2)/29=28/29= 0,97 Ответ: Газ азот легче воздуха в 0,97 раз Dвоздуха (N 2)= 0,97 |
| Найти: Dвоздух - ? |
Закон объемных отношений
Гей-Люссак, 1808 г.
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V 1 :V 2 :V 3 = ν 1 :ν 2 :ν 3.
Коэффициенты, стоящие перед химическими знаками и формулами, показывают не только число молекул или формульных единиц, но и число молей, участвующих в реакции. Поэтому уравнения реакций между газами можно записать и так:
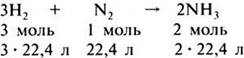
Если разделить указанные численные значения объемов реагирующих и образующихся газов на 22,4, то получатся простые целые числа, показывающие объемные отношения газов: 3 : 1 : 2. Следовательно, реакции между газообразными веществами подчиняются определенным закономерностям: при неизменном давлении объемы реагирующих и образующихся газов относятся между собой как небольшие целые числа.
Коэффициенты в уравнениях реакций показывают число объемов реагирующих и образующихся веществ:
|
|
|
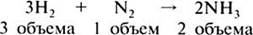
Далее на конкретном примере дается алгоритм решения типовой задачи.
Задача. Вычислите объем углекислого газа (оксида углерода(IV)), который выделится при сгорании 2 л метана (н. у.).

Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м 3 пропана С 3 Н 8 (н.у.)?
| Дано: V(С3Н8) = 10 м3 | Решение: 1. Запишем УХР С 3 Н 8 +5О 2 → 3СО2+ 4Н2О 1моль 5моль 2. Согласно закону объёмных отношений для газов: V(С3Н8):V(О2) = ν(С3Н8):ν(О2) = 1 : 5 10 м3 :V(О2) = 1 : 5 V(О2) = (10 · 5) /1= 50 м3 Ответ: Для сжигания 10 м3 пропана потребуется 50 м3 кислорода.
|
Обобщение и систематизация знаний
1. Какой объем занимают 5 моль О2 при н.у.?
2. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
3. Какой объем займут 8 г. газа О2 при н.у.?
4. В каком объеме содержится 12,04 ·1023 молекул водорода СО2 при н.у.?
5. Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
6.Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
|
|
|
7.Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
8. Вычислите объём кислорода, который потребуется для сжигания 5 м 3 метана СН 4 н.у.?
Домашнее задание.
§ 38, упр. 2, 4(с. 128).
§ 39, упр. тестовые, задачи 2, 4 (с. 130).
Дата добавления: 2022-01-22; просмотров: 10; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
