Задачи на «5». Выберите по одной задаче из каждой группы.
Тема. Решение задач на тему «Определение концентрации растворов»
Цель занятия: решение задач на вычисление массовой доли и массы вещества в растворе, показать возможность решения химической задачи алгебраическим способом;
научить делать осознанный выбор способа и метода решения задач на уроке химии;
показать наличие межпредметных связей в области химии и математики.
Оборудование: Таблица элементов Д.И.Менделеева
Обучающийся должен знать важнейшие химические понятия: моль, молярная масса, молярный объем газообразных веществ, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, основные теории химии электролитической диссоциации;
Обучающийся должен уметь определять характер среды в водных растворах неорганических соединений, окислитель и восстановитель; связывать изученный материал со своей профессиональной деятельностью; решать расчетные задачи по химическим формулам и уравнениям; использовать приобретенные знания и умения в практической деятельности и повседневной жизни: для объяснения химических явлений, происходящих в природе, быту и на производстве.
! Внимательно изучите теоретическую часть работы. Это поможет вам правильно выполнить практическую часть работы и сделать выводы.
Теоретические основы
1. Предварительно просмотрите видео по теме.
|
|
|
2. Запишите формулы.
3. Решите задачи
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
 ,
,
где:
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя.
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
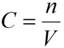 ,
,
где:
C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
3.Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
4. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:
|
|
|
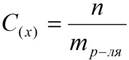 ,
,
где:
С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
mр-ля – масса растворителя, кг.
Количественный состав раствора выражается его концентрацией, которая имеет разные формы выражения. Чаще всего используют массовую концентрацию или массовую долю растворённого вещества. Вспомним математическую формулу для выражения массовой доли растворённого вещества и рассмотрим, как ее можно использовать.
1. Массовая доля растворённого вещества обозначается – W р.в.
2. Массовая доля растворённого вещества – это отношение массы растворённого вещества к массе раствора: W (р.в.) = m (р.в.)/m (р-ра) x 100%.
3. Масса раствора складывается из массы растворённого вещества и массы растворителя: m (р-ра) = m (р.в.) + m (р-ля)
4. Формула для массовой доли растворённого вещества будет выглядеть следующим образом: W (р.в.) = m (р.в.)/ m (р.в.) + m (р-ля) x 100%
5. Преобразуем данную формулу и выразим массу растворённого вещества и массу раствора: m (р.в.) = w (р.в.) x m (р-ра)/100%, m (р-ра) =m (р.в.)/w (р.в.) x 100%.
Практическая часть урока
Определите уровень выполнения задания.
Если вы выбрали задание на «4» - вы решаете все задачи.
Если выбрали задания на «5» - вы выбираете одну задачу из каждой группы – всего- 4 задачи. Задачи на «4» не решаете.
|
|
|
Контрольные задания
Задачи на «4».
1. Какую массу фосфата натрия и воды надо взять для приготовления 250 г 20%-ного раствора?
2. Сколько граммов воды содержится в 200 г 40%-ного раствора поваренной соли?
3. В 400 г воды растворили 5,6 л сероводорода. Определите процентное содержание сероводорода в полученном растворе.
4. Определить массу 20%-ного раствора, полученного при растворении 50 г карбоната натрия?
5. В 40 г воды растворили 3,5 г семиводного сульфата железа (II). Определите массовую долю безводной соли в растворе?
Задачи на «5». Выберите по одной задаче из каждой группы.
Задачи на расчет молярной концентрации растворов:
1. Какое количество вещества содержится в 1 л раствора с массовой долей нитрата натрия 40%, если его плотность равна 1,32 г/мл?
2. Какая масса соли потребуется для приготовления раствора хлорида калия объемом 300 мл с концентрацией 0,15 моль/л?
3. В воде массой 128 г растворили метанол (СН3ОН) объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл.
4. Определите молярную концентрацию раствора с массовой долей гидроксида натрия 20% с плотностью 1,22 г/мл.
|
|
|
5. Какой объем раствора с массовой долей серной кислоты 9,3% и плотностью 1,05 г/мл необходим для приготовления 0,35М H2SO4 объемом 40 мл?
Задачи на определение растворимости веществ:
1. Определите массовую долю нитрата натрия в растворе, приготовленном при 400С.
2. Массовая доля карбоната натрия в растворе равна 25%. Определите растворимость вещества.
3. Определите растворимость вещества, если приготовлено 400 г 25%-ного раствора.
4. Сколько граммов сульфата натрия потребуется для приготовления 200 г насыщенного при 500С раствора?
Задачи на смешивание растворов:
1. Сколько граммов 10% и 20%-ного растворов поваренной соли надо взять для приготовления 300 г 12%-ного раствора?
2. Сколько граммов воды необходимо взять для приготовления 200 г 25%-ного раствора из 60%-ного раствора серной кислоты?
3. Сколько граммов воды и 10%-ного сульфата меди (II) потребуется для приготовления 500 г 2%-ного раствора?
4. Какой объем 60%-ной серной кислоты (плотность 1,5 г/мл) и 30%-ного раствора (плотность 1,2 г/мл) серной кислоты надо взять для приготовления 240 г 50%-ного раствора?
Задачи на изменение концентрации растворов:
1. К 250 г 30%-ного раствора соляной кислоты прилили 150 г воды. Чему стала равной массовая доля вещества в растворе?
2. При выпаривании 150 г 10%-ного раствора нитрата калия осталось 100 г раствора. Чему стала равной процентная концентрация раствора?
3. Какую массу раствора с массовой долей хлорида натрия 20% надо добавить к 40 мл воды для приготовления 6%-ного раствора?
4. Сколько граммов воды испаряется из 400 г 40%-ного раствора, если массовая доля вещества уменьшается до 10%?
Дата добавления: 2021-12-10; просмотров: 30; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
