Решение расчётных задач по химии на вычисление произведения растворимости соли
Произведение растворимости.
Произведение растворимости.
Правило произведения растворимости.
Алгоритм решения задач на правило растворимости.
Примеры решения задач.
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми подчиняются закону действия масс и характеризуются константой равновесия – так называемым произведением растворимости (ПР).
Произведение растворимости – постоянная величина, равная произведению активностей ионов в насыщенном растворе малорастворимого вещества.
Например, при образовании осадка имеет место равновесие, которое описывается следующим ионным уравнением:
Ag+ + Cl- ↔ Ag Cl↓
При этом произведение растворимости записывается следующим образом
ПРAgCl = aAg+ ∙ aCl- = [Ag+] ∙ [Cl-] ∙ fAg+ ∙ f Cl- ,
где aAg+ и aCl- - активности соответствующих ионов,
[Ag+] и [Cl-] -равновесные концентрации этих же ионов . моль/дм3;
fAg+ и f Cl- - коэффициенты активности ионов.
В растворах малорастворимых соединений концентрации ионов, как правило, очень низки. Если в растворе отсутствуют другие ионы, то концентрации мало отличаются от активностей ионов, например:
aAg+ ≈≈ [Ag+] и aCl - ≈ [Cl-] ,
так как в отсутствие посторонних электролитов ионная сила раствора очень мала и коэффициенты активности близки к единице.
На это основании для приближенных расчетов вместо активностей ионов можно использовать их молярные концентрации, так что произведение растворимости можно записать в виде следующего выражения:
|
|
|
ПРAgCl = [Ag+] ∙ [Cl-] .
К равновесным системам следует отнести также и систему труднорастворимый электролит – его насыщенный раствор. В этом случае мы имеем дело с динамическим гетерогенным равновесием
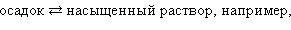
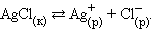
|
В этом растворе концентрация ионов очень мала и вследствие этого взаимодействие их друг с другом практически отсутствует.
Константу равновесия для гетерогенной системы можно записать так:
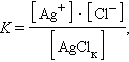
|
концентрацию твердой фазы AgClk можно считать постоянной, тогда
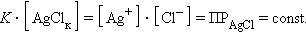
|
С другой стороны,

|
Так как 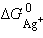 ,
, 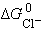 и
и 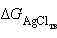 – постоянные величины, то
– постоянные величины, то
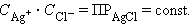
|
В общем виде для уравнения
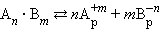
|
|
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
|
|
|
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов.
Все вычисления, связанные с образованием и растворением осадков, выполняют по следующей схеме:
1. Составляют уравнения диссоциации электролитов, которые образуют ионы, участвующие в реакции осаждения.
2. Составляют ионные уравнения образования осадков.
3. Записывают выражение произведения растворимости в соответствии с ионным уравнением, описывающим образование осадка, и находят значение ПР по таблицам.
4. Вычисляют значения равновесных концентраций ионов или по заданным концентрациям сильных электролитов, или с учетом Кдисс.
|
|
|
5.Сопоставляя заданные концентрации и условия задачи, составляют алгебраическое уравнение, по которому определяют искомую величину..
Решение расчётных задач по химии на вычисление произведения растворимости соли
Задача 1.
Растворимость СаСО3 при 35 °С равна 6,9 . 10-5 моль/л. Вычислить произведение растворимости этой соли.
Решение:
Уравнение диссоциации СаСО3 имеет вид:
СаСО3 ⇔ Са2+ + СО32-
При растворении каждого моля СаСО3 в раствор переходит 1 моль ионов Са2+ и 1 моль ионов СО32-. Следовательно, в насыщенном растворе СаСО3 содержится по 6,9 . 10-5 моль/л ионов Са2+ и СО32- (Са2+ = СО32-).
Отсюда находим произведение растворимости СаСО3:
ПР(СаСО3) = [Са2+] . [СО32-] = 6,9 . 10-5 . 6,9 . 10-5 = 4,76 . 10-9.
Ответ: 4,76 . 10-9.
Задача 2.
Вычислить произведение растворимости RbВг2 при 25 °С, если растворимость соли при этой температуре равна 1,32 . 10-2 молы/л.
Решение:
Уравнение диссоциации RbВг2 имеет вид:
RbBr2 ⇔ Rb2+ + 2Br-.
При растворении каждого моля RbВг2 в раствор переходит 1 моль ионов Rb2+ и 2 моль ионов Br-. Следовательно, в насыщенном растворе RbВг2 содержится по 1,32 . 10-2 моль/л ионов Rb2+ и (2 . 1,32 . 10-2) моль/л ионов Br-. Отсюда находим произведение растворимости RbВг2:
|
|
|
ПР(RbBr2) = [Rb2+] . [Br-]2 = 1,32 . 10-2 . (2 . 1,32 . 10-2)2 = 9,2 . 10-6.
Ответ: 9,2 . 10-6.
Дата добавления: 2021-12-10; просмотров: 87; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

