Таким образом, если все обобщить имеем
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется атомной орбиталью (АО) или электронным облаком.
Электроны в атомах располагаются определенными слоями — оболочками и в определенном порядке. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома.
Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями.
Энергетические уровни обозначаются n и принимает целочисленные значения 1, 2, 3, 4…Чем больше значение n, тем больше энергия электрона в атоме.
n=1 - 1 уровень
n=2 – 2 уровень и т.д.
Число уровней определяется по номеру периода, в котором находится элемент
Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2 n 2
Где N- максимальное число электронов на уровне;
|
|
|
n – номер энергетического уровня.
Каждый уровень в свою очередь состоит из подуровней. Подуровни обозначаются буквами: s , p , d , f
Орбитали, или подуровни, как их еще называют, могут иметь разную форму.
Число подуровней на уровне равно номеру уровня
Первый энергетический уровень имеет один подуровень (s),
второй- два (s , p),
третий – три (s , p , d) и т.д.
Электроны разных подуровней одного и того же уровня имеют разную форму
электронного облака:
сферическую ( s ),
гантелеобразную ( p ) и более сложную конфигурацию.
Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
|
|
| S- орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и наконец, превращается в гантелеобразную
p-орбиталь:

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x , y и z .
Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
|
| ||
| Три p – орбитали
|
теперь мы можем составить схему строения электронных оболочек атомов:
- Определяем общее число электронов на оболочке по порядковому номеру элемента.
- Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
- Определяем число электронов на каждом энергетическом уровне.
- Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой - квадратиком на энергетической диаграмме:
На s - подуровне может находиться одна атомная орбиталь 

p-подуровне их может быть уже три -
(в соответствии с тремя осями координат):
Орбиталей d- подуровня в атоме может быть уже пять 
f -подуровня семь соответственно: 
электроны обозначают стрелочками, тот факт, что электроны вращаются еще и вокруг собственной оси отражается направлением стрелки:

 по часовой оси острием вверх, против - острием вниз
по часовой оси острием вверх, против - острием вниз
электроны с противоположными спинами (спин-вращение электрона вокруг собственной оси)
|
|
|
 электроны с параллельными спинами
электроны с параллельными спинами
таким образом, если все обобщить имеем
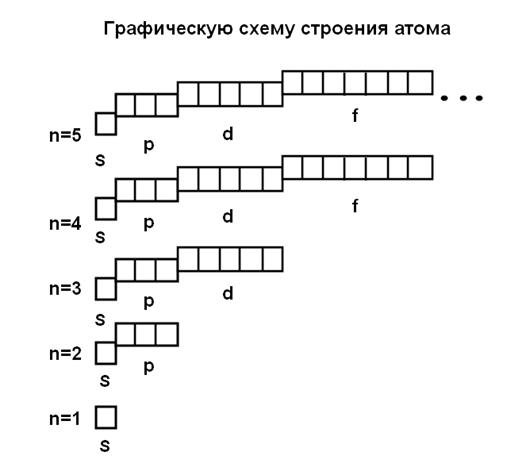
Прежде чем рассматривать строение электронных оболочек атома на конкретных примерах нужно познакомиться с правилами
Дата добавления: 2021-12-10; просмотров: 15; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


