Задание выполнить до 15.11. 2021 г. Прислать личным сообщением в ВК.
Группа 3ПК 2-й курс
Г
Предмет ХИМИЯ
Тема 8: Строение атома. Строение вещества.
Урок № 33 ОДП.02 Химия (1 урок)
Тема урока «Основные сведения о строении атома. Ядро. Электроны. Электронная оболочка. Энергетический уровень.».
Цель: актуализировать знания учащихся об электронном строении атомов, сформировать представление о квантовых числах, правилах и принципах заполнения электронных оболочек, о семействах элементов; умение составлять электронные и электронно - графические формулы элементов.
Тип урока: Усвоение новых знаний.
Форма урока: дистанционная.
Лекция.
Итак: уровни делятся на подуровни, подуровни – на орбитали, на каждой орбитали – максимально 2 электрона.
Распределение электронов в атоме можно описать квантовыми числами.
Главное квантовое число n- показывает общий запас энергии электрона, а значит, его удаленность от ядра: чем выше энергия электрона, тем он дальше от ядра; n принимает целые значения от 1 до 7, соответствует номеру энергетического уровня, на котором находится электрон.
Побочное (орбитальное) квантовое число l – отражает разное энергетическое состояние электрона в пределах уровня, определяет форму орбитали, соответствует подуровню (s,p,d,f).
Принимает значения от 0 до n-1. Число значений L- равно числу подуровней в уровне. Например, при n=3, L принимает значения 0;1;2. Всего 3 значения, значит в 3-м уровне три подуровня. Каждому подуровню соответствует свое численное значение:
|
|
|
s-0
p-1
d-2
f-3
Магнитное квантовое число m1 – характеризует ориентацию орбитали в пространстве, принимает значение от –L через 0 до +L.
Спин электрона s – собственный момент импульса электрона, не связанный с движение в пространстве. Это квантовое свойство электрона, не имеющего аналогов в микромире. Проекция спина на ось Z называется спиновое число m2 и принимает два значения : +1/2 и -1/2.
Для объяснения порядка заполнения электронами оболочек нужно знать следующие правила:
- Принцип Паули (1925 г.) – в атоме не может быть двух электронов, у которых все четыре квантовые числа одинаковы.
Пример : у гелия всего 2 электрона. Как правильно их изобразить.
- Правило Хунда — правило квантовой химии, которое определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
|
|
|
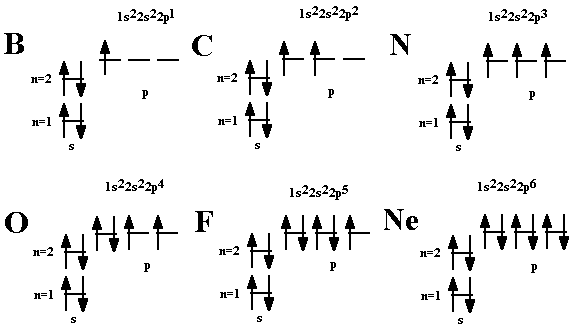
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома. Электронная конфигурация - формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы. С точки зрения квантовой механики электронная конфигурация - это полный перечень одноэлектронных волновых функций, из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля). Т.к. все состояния являются вырожденными по квантовому числу m и по спину, то принято указывать только полное количество электронов, находящихся в состоянии с данными n, l. Слева от числа l пишут число n, а сверху от числа l - число электронов в состоянии с данным n, l. Например 2s 2 соответствует двум электронам в состоянии с n = 2, l = 0. Из-за практического удобства в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n, а затем квантового числа l, например 1s 2 2s 2 2p 6 3s 2 3p 2 . (Иногда формулу сокращают до 1s 2 2s 2 p 6 3s 2 p 2 , т.е. опускают число n там, где его можно угадать из правила упорядочения термов). Пример
|
|
|
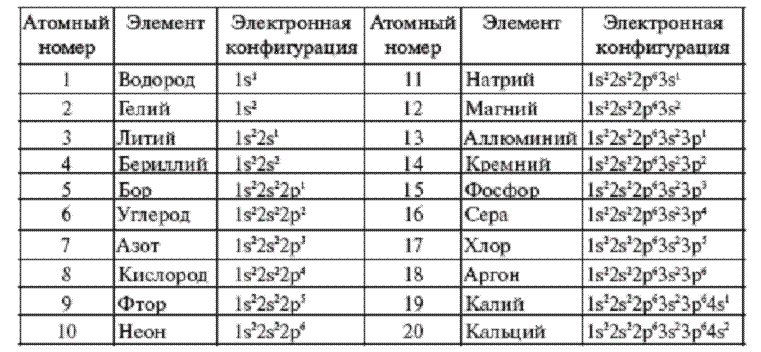
Валентная оболочка - самая внешняя оболочка атома. Электроны этой оболочки часто называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. Хотя это и не совсем верно. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек не всегда имеют меньшую энергию, чем электроны внешних подуровней. Например, электроны подуровня оболочки 3d могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены)
|
|
|
Закрепление
Составим электронную формулу азота. В периодической таблице азот находится под №7.
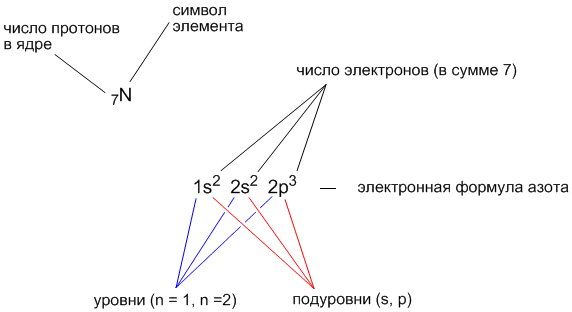

Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s22s22p63s23p6.
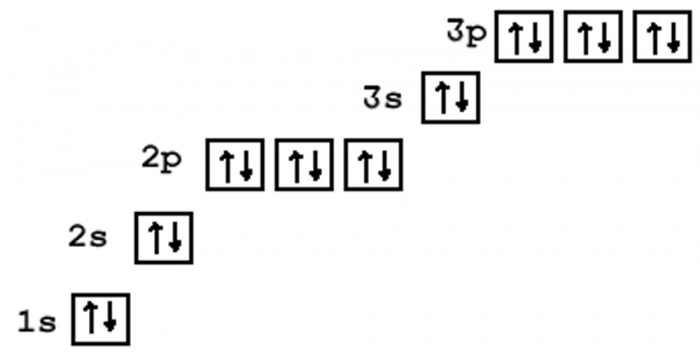
Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
1s22s22p63s23p64s13d5

6. Домашнее задание. Просмотрите презентацию, проработать §1-3 (выполнить упр.6,7 с.22)
Задание выполнить до 15.11. 2021 г. Прислать личным сообщением в ВК.
Дата добавления: 2021-12-10; просмотров: 25; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
