Задание А (выбрать только один ответ из предложенных)
ФИО ________________________________________________ Вариант _______
Задание А (выбрать только один ответ из предложенных)
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | А11 | А12 | А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 | |
| 1 | ||||||||||||||||||||
| 2 | ||||||||||||||||||||
| 3 | ||||||||||||||||||||
| 4 |
Задание В (записать ответ: число, формулу, уравнение …)
| В1 | |
| В2 | |
| В3 | |
| В4 | |
| В5 | |
| В6 | |
| В7 | |
| В8 | |
| В9 | |
| В10 |
Задание С (дать ответ на вопрос)
1.
2.
3.
4.
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Какая из данных термодинамических величин является параметром процесса, а не параметром состояния?
|
|
|
| 1) температура | 2) энтальпия | 3) теплота | 4) энтропия |
А2. Какая из данных термодинамических величин не является функцией состояния системы?
| 1) теплота | 2) внутренняя энергия | 3) энтропия | 4) энергия Гиббса |
А3. Работа какого из процессов с участием идеального газа равна нулю?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А4. Зависимость теплоты процесса (химической реакции) от температуры дается уравнениями
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А5. Процесс, проходящий в прямом, а затем в обратном направлении через одни и те же промежуточные состояния, называется:
| 1) положительным | 2) отрицательным | 3) равновесным | 4) неравновесным |
А6. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в изолированной системе?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энтропия |
А7. Изохорно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
|
|
|
А8. Какая из данных термодинамических величин является интенсивным параметром состояния системы?
| 1) внутренняя энергия | 2) энтропия | 3) давление | 4) объем |
А9. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS | 2) G = H – TS | 3) G = F + PV | 4) G = U – TS + PV |
А10. Произведение PV называется:
| 1) свободная энергия | 2) связанная энергия | 3) внутренняя энергия | 4) внешняя энергия |
А11. Функцией каких переменных является внутренняя энергия?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
А12. Выражение для химического потенциала компонента реального жидкого раствора имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А13. Повышение температуры кипения разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А14. Массу каждого компонента, вступившую к данному моменту в реакцию и измеренную в эквивалентных единицах, отвечающих уравнению реакции, показывает
|
|
|
| 1) криоскопическая постоянная | 2) эбуллиоскопическая постоянная | 3) химическая переменная | 4) изотонический коэффициент |
А15. Связь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции, выражается законом
| 1) Коновалова | 2) Рауля | 3) действующих масс | 4) правилом рычага |
А16. Уравнения изохоры и изобары химической реакции носят имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А17. Отрицательный наклон на диаграмме состояния однокомпонентной системы (в координатах Р-Т) может иметь кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А18. Точка, которой заканчивается кривая кипения на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А19. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А20. Число степеней свободы в эвтектической точке равно:
|
|
|
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение …)
В1. Чему равна теплоемкость Ср одноатомного идеального газа?
В2. Запишите уравнение Майера.
В3. Запишите выражение для работы изотермического процесса в идеальном газе.
В4. Какая работа в термодинамике считается положительной: работа расширения или сжатия?
В5. Какие условия в термодинамике считаются стандартными?
В6. Напишите выражение для расчета изменения энтропии в процессе нагревания при постоянном давлении (или объеме).
В7. Напишите выражение для полного дифференциала функции Н (энтальпии).
В8. Запишите уравнение Клапейрона-Клаузиуса (две формы записи).
В9. Напишите выражение, определяющее понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе.
В10. Запишите уравнение изотермы химической реакции для изобарного потенциала реакции.
Задание С (дать ответ на вопрос)
С1. Сформулировать первый закон термодинамики, написать его математическое выражение в интегральной и дифференциальной форме.
С2. Сформулировать закон Гесса. При каких условиях выполняется закон Гесса, почему?
С3. Сформулировать закон Рауля, написать его математическое выражение.
С4. Сформулировать правило фаз Гиббса, написать его математическое выражение. Что такое число степеней свободы?
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какая из данных термодинамических величин является параметром процесса, а не параметром состояния?
| 1) работа | 2) энтальпия | 3) объем | 4) энтропия |
А2. Какая из данных термодинамических величин не является функцией состояния системы?
| 1) энтропия | 2) работа | 3) энтальпия | 4) энергия Гельмгольца |
А3. В каком из процессов с участием идеального газа внутренняя энергия не изменяется?
| 1) изобарном | 2) изохорном | 3) изотермическом | 4) адиабатическом |
А4. Уравнениями адиабаты являются уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А5. Процесс, проходящий в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние, называется
| 1) положительным | 2) отрицательным | 3) равновесным | 4) обратимым |
А6. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства давления и температуры?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энтропия |
А7. Изохорно-изэнтропным потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А8. Какая из данных термодинамических величин является интенсивным параметром состояния системы?
| 1) температура | 2) энтропия | 3) масса | 4) объем |
А9. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS + PV | 2) G = H – TS | 3) G = F + PV | 4) G = U – TS |
А10. Произведение TS называется:
| 1) свободная энергия | 2) связанная энергия | 3) внутренняя энергия | 4) внешняя энергия |
А11. Функцией каких переменных является энтальпия?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
А12. Выражение для химического потенциала компонента идеального жидкого раствора имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А13. Понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А14. Молекулярным повышением температуры кипения раствора называют
| 1) криоскопическую постоянную | 2) эбуллиоскопическую постоянную | 3) химическую переменную | 4) изотонический коэффициент |
А15. Для нахождения (графическим способом) масс сосуществующих в равновесии фаз пользуются
| 1) законами Коновалова | 2) законом Рауля | 3) законом действующих масс | 4) правилом рычага |
А16. Правило фаз носит имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А17. Метастабильной кривой на диаграмме состояния однокомпонентной системы (в координатах Р-Т) является кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А18. Точка, в которой сходятся все пограничные линии на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А19. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А20. Число степеней свободы в тройной точке равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение …)
В1. Чему равна теплоемкость Сv одноатомного идеального газа?
В2. Запишите выражение, передающее связь между Qp и Qv для процессов в идеальном газе.
В3. Запишите выражение для работы изобарного процесса в идеальном газе.
В4. Какая работа в термодинамике считается отрицательной: работа расширения или сжатия?
В5. Как в термодинамике обозначается стандартная теплота образования вещества?
В6. Напишите выражение для расчета изменения энтропии в процессе фазового перехода первого рода.
В7. Напишите выражение для полного дифференциала функции F.
В8. Запишите уравнения Кирхгофа в интегральной форме.
В9. Напишите выражение, определяющее осмотическое давление разбавленного раствора нелетучего вещества в летучем растворителе.
В10. Запишите уравнение изотермы химической реакции для изохорного потенциала реакции.
Задание С (дать ответ на вопрос)
С1. Сформулировать второй закон термодинамики (одну из формулировок), написать его математическое выражение в интегральной и дифференциальной форме.
С2. Сформулировать закон Гей-Люссака – Джоуля.
С3. Сформулировать постулат Планка. Какую возможность дает этот постулат?
С4. Сформулировать первый закон Коновалова. Можно ли методами термодинамики доказать этот закон?
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Какая из данных термодинамических величин является параметром процесса, а не параметром состояния?
| 1) энергия Гиббса | 2) работа | 3) температура | 4) энтропия |
А2. Какая из данных термодинамических величин не является функцией состояния системы?
| 1) энтропия | 2) энтальпия | 3) энергия Гельмгольца | 4) теплота |
А3. Теплота какого из процессов с участием идеального газа равна работе этого процесса?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А4. Уравнениями, применимыми ко всем агрегатным превращениям чистых веществ, являются уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А5. Процессы, протекающие сами собой и приближающие систему к равновесию, называются
| 1) положительными | 2) отрицательными | 3) равновесными | 4) обратимыми |
А6. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства объема и температуры?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энергия Гельмгольца | 4) энтропия |
А7. Изобарно-изэнтропным потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А8. Какая из данных термодинамических величин является интенсивным параметром состояния системы?
| 1) внутренняя энергия | 2) энтропия | 3) химический потенциал | 4) объем |
А9. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = F + PV | 2) G = H – TS | 3) G = U – TS + PV | 4) G = U – TS |
А10. Сумме внутренней и внешней энергий равна термодинамическая функция, которая называется:
| 1) энтропия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А11. Функцией каких переменных является энергия Гиббса?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
А12. Выражение для химического потенциала компонента смеси реальных газов имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А13. Осмотическое давление разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А14. Молекулярным понижением точки затвердевания раствора называют
| 1) криоскопическую постоянную | 2) эбуллиоскопическую постоянную | 3) химическую переменную | 4) изотонический коэффициент |
А15. Относительное понижение давления пара растворителя над раствором определяется
| 1) законами Коновалова | 2) законом Рауля | 3) законом действующих масс | 4) правилом рычага |
А16. Тепловой закон носит имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А17. Двумя точками на диаграмме состояния однокомпонентной системы (в координатах Р-Т) ограничена кривая
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А18. Любая точка на плоскости диаграммы состояния гетерогенной системы называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А19. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А20. Число степеней свободы в точке, лежащей на кривой плавления диаграммы однокомпонентной системы (в координатах Р-Т), равно
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение …)
В1. Чему равна теплоемкость Сv двухатомного идеального газа?
В2. Напишите уравнения адиабаты.
В3. Запишите выражения, определяющие теплоемкость среднюю и истинную.
В4. Какая теплота в термодинамике считается положительной: та, которую система поглощает, или та, которую система выделяет?
В5. Как в термодинамике обозначается стандартная теплота сгорания вещества?
В6. Напишите выражение для расчета изменения энтропии в изотермическом процессе с участием идеального газа.
В7. Напишите выражение для полного дифференциала функции U.
В8. Запишите уравнения Кирхгофа в дифференциальной форме.
В9. Запишите объединенный закон Рауля-Генри.
В10. Запишите уравнение изобары химической реакции Вант-Гоффа.
Задание С (дать ответ на вопрос)
С1. Сформулировать закон сохранения и превращения энергии. Чем с этой точки зрения являются теплота и работа?
С2. Сформулировать постулат Клаузиуса.
С3. Сформулировать термодинамическое условие равновесия системы.
С4. Сформулировать второй закон Коновалова. Можно ли методами термодинамики доказать этот закон?
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. Какая из данных термодинамических величин является параметром процесса, а не параметром состояния?
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) теплота | 4) давление |
А2. Какая из данных термодинамических величин не является функцией состояния системы?
| 1) энтропия | 2) внутренняя энергия | 3) энтальпия | 4) работа |
А3. Какой из процессов с участием идеального газа протекает без теплообмена с окружающей средой?
| 1) изобарный | 2) изохорный | 3) изотермический | 4) адиабатический |
А4. Зависимость константы равновесия химической реакции от Т дается уравнениями
| 1) Вант-Гоффа | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А5. Процессы, которые не могут протекать сами собой, без воздействия извне, удаляющие систему от равновесия, называются:
| 1) положительными | 2) отрицательными | 3) равновесными | 4) обратимыми |
А6. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства объема и энтропии?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А7. Изобарно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А8. Какая из данных термодинамических величин является экстенсивным параметром состояния системы?
| 1) температура | 2) давление | 3) плотность вещества | 4) энтропия |
А9. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS + PV | 2) G = U – TS | 3) G = F + PV | 4) G = Н– TS |
А10. Какую термодинамическую функцию можно представить как сумму свободной и связанной энергии?
| 1) энтропию | 2) энтальпию | 3) внутреннюю энергию | 4) энергию Гиббса |
А11. Функцией каких переменных является энергия Гельмгольца?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
А12. Выражение для химического потенциала компонента идеальной газовой смеси имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А13. Понижение давления пара растворителя над раствором пропорционально концентрации растворенного вещества, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А14. Мерой влияния диссоциации (ассоциации) растворенного вещества на коллигативные свойства растворов является:
| 1) криоскопическая постоянная | 2) эбуллиоскопическая постоянная | 3) химическая переменная | 4) изотонический коэффициент |
А15. Равновесие жидкость – пар в бинарных системах подчиняется:
| 1) законам Коновалова | 2) закону Рауля | 3) закону действующих масс | 4) правилу рычага |
А16. Возможность вычислить абсолютное значение энтропии индивидуального вещества дает:
| 1) тепловой закон Нернста | 2) уравнение изобары (изохоры) Вант-Гоффа | 3) постулат Планка | 4) правило фаз Гиббса |
А17. Двойному равновесию твердая фаза – пар (газ) на диаграмме состояния однокомпонентной системы (в координатах Р-Т) отвечает кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А18. Точка на диаграмме состояния двухкомпонентной системы (в координатах температура – состав), в которой могут находиться в равновесии три фазы (расплав и два вида кристаллов), называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А19. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А20. Число степеней свободы в точке, лежащей на кривой возгонки диаграммы однокомпонентной системы (в координатах Р-Т), равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение …)
В1. Чему равна теплоемкость Ср двухатомного идеального газа?
В2. Напишите выражение, передающее связь между Qp и Qv для химической реакции.
В3. Напишите выражения, определяющие изменение энтальпии в изобарном и изобарно-изотермическом процессах с участием идеального газа.
В4. Какая теплота в термохимии считается положительной: та, которую система поглощает, или та, которую система выделяет?
В5. В каких единицах измеряется теплоемкость?
В6. Напишите выражение для расчета DS в процессе, связанном с изменением T, P, V (общий случай).
В7. Напишите выражение, определяющее изохорно-изотермический потенциал.
В8. Запишите выражение для КПД цикла Карно.
В9. Напишите закон Рауля.
В10. Запишите уравнение изохоры Вант-Гоффа.
Задание С (дать ответ на вопрос)
С1. Что называется стандартной теплотой образования вещества? Как рассчитать тепловой эффект химической реакции с помощью стандартных теплот образования?
С2. Сформулировать постулат Томсона.
С3. Записать уравнения Гиббса-Гельмгольца. Какую связь дают эти уравнения?
С4. Какие переходы называются фазовыми переходами первого рода? Приведите примеры, запишите уравнение, приложимое ко всем фазовым переходам первого рода.
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. Какая из данных термодинамических величин является параметром процесса, а не параметром состояния?
| 1) энтропия | 2) внутренняя энергия | 3) давление | 4) теплота |
А2. Какая из данных термодинамических величин не является функцией состояния системы?
| 1) энтропия | 2) работа | 3) энергия Гельмгольца | 4) энергия Гиббса |
А3. Работа какого из процессов в идеальном газе совершается за счет уменьшения внутренней энергии?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А4. Уравнения максимальной работы – это уравнения
| 1) Вант-Гоффа | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А5. Процессы, протекающие сами собой и приближающие систему к равновесию, называются:
| 1) равновесными | 2) отрицательными | 3) самопроизвольными | 4) обратимыми |
А6. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства давления и энтропии?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А7. Изохорно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А8. Какая из данных термодинамических величин является экстенсивным параметром состояния системы?
| 1) химический потенциал | 2) температура | 3) энтропия | 4) давление |
А9. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = F + PV | 2) G = H – TS | 3) G = H – TS + PV | 4) G = U– TS + PV |
А10. Какую термодинамическую функцию можно представить как сумму свободной и внешней энергии?
| 1) энергию Гельмгольца | 2) энтальпию | 3) внутреннюю энергию | 4) энергию Гиббса |
А11. Функцией каких переменных является энтропия?
| 1) P и T | 2) U и V | 3) P и S | 4) V и S |
А12. Выражение для химического потенциала компонента идеальной газовой смеси имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢ (T) + RT ln Pi | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А13. Понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А14. Изобарный потенциал системы, приходящийся на 1 моль компонента, это:
| 1) криоскопическая постоянная | 2) химический потенциал | 3) химическая переменная | 4) изотонический коэффициент |
А15. Зависимость растворимости газа в жидкости от его давления (при невысоких Р) подчиняется закону
| 1) Генри | 2) Рауля | 3) Коновалова | 4) Менделеева-Клапейрона |
А16. Уравнение, описывающее закономерности осмотического давления разбавленных растворов, носит имя:
| 1) Нернста | 2) Вант-Гоффа | 3) Рауля | 4) Генри |
А17. Двойному равновесию жидкость – пар на диаграмме состояния однокомпонентной системы (в координатах Р-Т) отвечает кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А18. Точка, которой заканчивается кривая кипения на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А19. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А20. Число степеней свободы в точке, находящейся на линии солидуса на диаграмме состояния двухкомпонентной системы (в координатах температура – состав), равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение …)
В1. Чему равна теплоемкость Сv многоатомного идеального газа (нелинейная молекула)?
В2. Напишите выражение, определяющее энтальпию.
В3. Напишите выражения для работы адиабатического процесса в идеальном газе.
В4. Какая теплота в термодинамике считается отрицательной: та, которую система поглощает, или та, которую система выделяет?
В5. В каких единицах измеряется энтропия?
В6. Напишите выражение для расчета абсолютного значения энтропии вещества в газообразном состоянии.
В7. Перечислите известные вам функции состояния системы.
В8. Запишите уравнения Гиббса-Гельмгольца для DF и DG.
В9. Напишите выражение, определяющее повышение температуры кипения разбавленного раствора нелетучего вещества в летучем растворителе.
В10. Напишите наиболее общее выражение ЗДМ для химических реакций, протекающих между веществами, находящимися в разных фазах.
Задание С (дать ответ на вопрос)
С1. Что называется стандартной теплотой сгорания вещества? Как рассчитать тепловой эффект химической реакции с помощью стандартных теплот сгорания?
С2. Напишите три уравнения, охватывающие I и II законы термодинамики, для равновесных процессов.
С3. Сформулируйте принцип Ле-Шателье-Брауна. К каким процессам применим этот принцип?
С4. Какие растворы называются идеальными? Какому закону они подчиняются?
Факультет _____________________ Курс ________ Группа _________
ФИО ________________________________________________ Вариант _______
Задание А (выбрать только один ответ из предложенных)
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | А11 | А12 | А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 | А21 | А22 | А23 | |
| 1 | |||||||||||||||||||||||
| 2 | |||||||||||||||||||||||
| 3 | |||||||||||||||||||||||
| 4 |
Задание В (записать ответ: число, формулу, уравнение …)
| В1 | |
| В2 | |
| В3 | |
| В4 | |
| В5 | |
| В6 | |
| В7 | |
| В8 | |
| В9 | |
| В10 |
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Наиболее редким типом химической реакции являются реакции:
| 1) мономолекулярные | 2) бимолекулярные | 3) тримолекулярные |
А2. Реакции с участием атомов или свободных радикалов называются:
| 1) молекулярными | 2) ионными | 3) цепными | 4) гетерогенными |
А3. Время, к которому прореагирует половина исходного вещества, называется:
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А4. Уравнение для константы скорости обратимой реакции первого порядка имеет вид:
1) k = 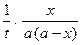
| 2) k = 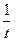 ln ln 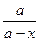
| 3) k =  ln ln 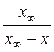
| 4) k1 + k2 =  ln ln 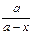
|
А5. Уравнение для времени полураспада в необратимой реакции первого порядка имеет вид:
1) t = 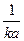
| 2) t = 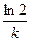
| 3) t = 
| 4) t = 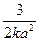
|
А6. Дифференциальное уравнение скорости необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  = k (а - х)(b - х) = k (а - х)(b - х)
| 3)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 4)  = k (a – x)2 = k (a – x)2
|
А7. Графический метод нахождения порядка реакции: для необратимой реакции третьего порядка прямолинейная зависимость наблюдается в координатах:
1) 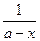 – t – t
| 2) 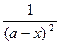 – t – t
| 3) ln(a – x) – t | 4) 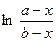 – t – t
|
А8. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) температуры | 2) концентрации реагирующих веществ | 3) величины поверхности реакционного сосуда | 4) катализатора |
А9. Основным законом фотохимии является закон:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
А10. Какое свойство растворителя является определяющим в его способности ионизировать растворённое вещество (помимо его способности к химическому взаимодействию с этим веществом)?
| 1) вязкость | 2) диэлектрическая проницаемость | 3) температура кипения | 4) плотность |
А11. Эффект торможения, связанный с возникновением дополнительной силы трения при движении противоположно заряженных ионов в разные стороны, называется:
| 1) эффектом асимметрии | 2) эффектом релаксации | 3) электрофоретическим эффектом | 4) эффектом Вина |
А12. Какова область применимости эмпирического закона ионной силы Льюиса-Рендалла?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А13. От какого из этих параметров не зависит стандартная ЭДС обратимого гальванического элемента:
| 1) природа электродов | 2) концентрация электролита | 3) температура | 4) давление |
А14. Металлоксидные электроды относятся к электродам:
| 1) первого рода | 2) второго рода | 3) амальгамным | 4) простым редокси |
А15. Потенциал каких электродов зависит от активности частиц только одного сорта?
| 1) газовых | 2) первого рода | 3) второго рода | 4) редокси-электродов |
А16. Какой из этих электродов может быть обратим по отношению к катионам щелочного металла?
| 1) первого рода | 2) второго рода | 3) водородный | 4) амальгамный |
А17. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) физические | 2) концентрационные первого рода | 3) концентрационные второго рода | 4) простые химические |
А18. Электрохимические цепи, в которых электроды отличаются лишь активностями участников электродной реакции, называются
| 1) физическими | 2) концентрационными | 3) химическими | 4) сдвоенными |
А19. Элемент Якоби-Даниэля относится к цепям:
| 1) концентрационным первого рода | 2) концентрационным второго рода | 3) простым химическим | 4) сложным химическим |
А20. Замедленность стадии построения (разрушения) кристаллической решетки является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А21. При электролизе водных растворов солей щелочных металлов (электроды – платина) на катоде происходит:
| 1) выделение щелочного металла | 2) одновременное выделение металла и водорода | 3) выделение водорода из воды | 4) выделение водорода из ионов гидроксония |
А22. Металлы с высоким значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А23. Какая из этих стадий процесса катодного выделения водорода из кислых растворов протекает без торможения (не является лимитирующей):
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В (записать ответ: число, формулу, уравнение …)
В1. В каких единицах измеряется константа скорости реакции первого порядка?
В2. Напишите выражение для константы скорости необратимой реакции второго порядка (при разных исходных количествах реагирующих веществ).
В3. Запишите уравнение Аррениуса в интегральной форме (неопределенный интеграл).
В4. Приведите математическую запись 1-го закона Фарадея.
В5. В каких единицах измеряется эквивалентная электропроводность?
В6. Напишите выражения, определяющие числа переноса.
В7. Напишите выражение, связывающее среднюю ионную активность электролита и его концентрацию (моляльность).
В8. Приведите схематическую запись простого редокси-электрода и напишите выражение для его потенциала.
В9. Приведите схематическую запись свинцового кислотного аккумулятора.
В10. Запишите уравнение электрохимической реакции выделения кислорода на аноде из щелочных растворов.
Задание С (дать ответ на вопрос)
С1. Что называется скоростью химической реакции? Дайте определение, напишите выражение для средней и истинной скорости реакции.
С2. Зависимость подвижности ионов и электропроводности от температуры.
С3. По какому принципу классифицируют электроды? Электроды второго рода.
С4. По каким принципам классифицируют электрохимические системы? Физические цепи.
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какой тип химических реакций (если рассматривать их с точки зрения молекулярности) практически не встречается:
| 1) одномолекулярные | 2) двухмолекулярные | 3) трехмолекулярные | 4) четырехмолекулярные |
А2. Реакции какого типа могут быть простыми (протекающими в одну стадию)?
| 1) цепные | 2) ионные | 3) последовательные | 4) параллельные |
А3. Промежуток времени после начала реакции (в последовательных мономолекулярных реакциях), в течение которого конечное вещество нельзя обнаружить аналитически, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А4. Уравнение для константы скорости необратимой реакции первого порядка имеет вид:
1) k = 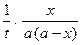
| 2) k = 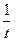 ln ln 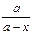
| 3) k =  ln ln 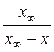
| 4) k1 + k2 =  ln ln 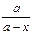
|
А5. Уравнение для времени полураспада в необратимой реакции третьего порядка имеет вид:
1) t = 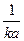
| 2) t = 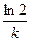
| 3) t = 
| 4) t = 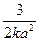
|
А6. Дифференциальное уравнение скорости двух параллельных реакций первого порядка имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  =
k1 (a – x) – k2 (b + x) =
k1 (a – x) – k2 (b + x)
| 3)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 4)  = k (a - x)2 = k (a - x)2
|
А7. Графический метод нахождения порядка реакции: для необратимой реакции второго порядка (разные исходные концентрации реагирующих веществ) прямолинейная зависимость наблюдается в координатах:
1) 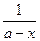 – t – t
| 2) 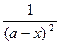 – t – t
| 3) ln(a – x) – t | 4) 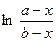 – t – t
|
А8. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) присутствия инертных веществ | 2) концентрации реагирующих веществ | 3) температуры | 4) катализатора |
А9. Наиболее общее выражение для скорости фотохимической реакции, объединяющее все законы фотохимии, имеет вид:
1) - 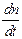 = g = g 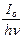 (1 - е–knl) (1 - е–knl)
| 2) g = 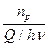
| 3) - 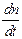 = KIo (1 - e–knl) = KIo (1 - e–knl)
| 4) I = Ioe–knl |
А10. Свойством растворителя, обусловливающим увеличение подвижности ионов с ростом температуры, является:
| 1) вязкость | 2) диэлектрическая проницаемость | 3) температура кипения | 4) плотность |
А11. Какое из этих четырех словосочетаний не является синонимом трем остальным?
| 1) частотный эффект | 2) эффект Вина | 3) дисперсия электропроводности | 4) эффект Дебая-Фалькенгагена |
А12. Какова область применимости первого приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А13. От какого из этих параметров не зависит стандартный электродный потенциал:
| 1) природа электрода | 2) концентрация электролита | 3) температура | 4) давление |
А14. Какой из этих электродов нельзя реализовать как электрод первого рода:
| 1) цинковый | 2) серебряный | 3) никелевый | 4) калиевый |
А15. Какие электроды обратимы и по отношению к катионам электродного металла, и по отношению к анионам раствора?
| 1) первого рода | 2) второго рода | 3) газовые | 4) редокси-электроды |
А16. Какой электрод нельзя использовать как индикаторный при определении рН раствора?
| 1) первого рода | 2) стеклянный | 3) металлоксидный | 4) водородный |
А17. Какие их данных электрохимических цепей являются цепями без переноса:
| 1) простые химические | 2) сложные химические | 3) концентрационные второго рода |
А18. ЭДС каких цепей имеет максимальное значение:
| 1) физических | 2) концентрационных | 3) химических |
А19. Простые газовые цепи являются:
| 1) физическими | 2) концентрационными первого рода | 3) концентрационными второго рода | 4) химическими |
А20. Замедленное протекание стадии разряда-ионизации (стадии перехода электрона через границу раздела электрод-электролит) является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А21. При электролизе водных растворов щелочей (электроды – платина) на катоде происходит:
| 1) выделение щелочного металла | 2) одновременное выделение металла и водорода | 3) выделение водорода из воды | 4) выделение водорода из ионов гидроксония |
А22. Металлы со средним значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А23. Какая из этих стадий процесса катодного выделения водорода из кислых растворов может протекать по нескольким параллельным путям:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В (записать ответ: число, формулу, уравнение …)
В1. В каких единицах измеряется константа скорости реакции второго порядка?
В2. Запишите выражение для константы скорости необратимой реакции n-го порядка.
В3. Запишите уравнение Аррениуса в интегральной форме (определенный интеграл).
В4. Приведите математическую запись второго закона Фарадея.
В5. В каких единицах измеряется удельная электропроводность?
В6. Напишите выражение, связывающее мольную активность электролита и среднюю ионную активность электролита.
В7. Напишите выражение третьего приближения теории сильных электролитов Дебая и Гюккеля. Какие величины в нем являются эмпирическими?
В8. Приведите схематическую запись газового водородного электрода, напишите выражение для его потенциала.
В9. Приведите схематическую запись каломельного электрода.
В10. Запишите уравнение электрохимической реакции выделения кислорода на аноде из кислых растворов.
Задание С (дать ответ на вопрос)
С1. Сформулируйте основной постулат химической кинетики, напишите его математическое выражение, дайте характеристику входящим в него величинам.
С2. Подвижность ионов (абсолютная подвижность ионов, ионная электропроводность или просто подвижность, предельная подвижность): обозначение, единицы измерения, физический смысл. Зависимость подвижности от природы иона (размеров и заряда). Какие ионы обладают в водных растворах аномально высокой подвижностью и почему?
С3. По какому принципу классифицируют электроды? Амальгамные электроды.
С4. По каким принципам классифицируют электрохимические системы? Простые химические цепи.
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Реакции изомеризации и диссоциации являются:
| 1) мономолекулярными | 2) бимолекулярными | 3) тримолекулярными |
А2. Большинство химических реакций относится к
| 1) цепным | 2) последовательным | 3) параллельным | 4) необратимым |
А3. Состояние последовательной мономолекулярной реакции, когда количества веществ А (исходное вещество) и В (промежуточное вещество) убывают в одинаковой степени, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А4. Уравнение для константы скорости необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) имеет вид:
1) k = 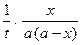
| 2) k = 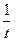 ln ln 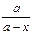
| 3) k =  ln ln 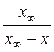
| 4) k1 + k2 =  ln ln 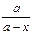
|
А5. Уравнение для времени полураспада в необратимой реакции нулевого порядка имеет вид:
1) t = 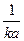
| 2) t = 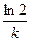
| 3) t = 
| 4) t = 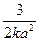
|
А6. Дифференциальное уравнение скорости необратимой реакции второго порядка (при разных исходных концентрациях реагирующих веществ) имеет вид:
1)  = k (a - x)2 = k (a - x)2
| 2)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 3)  = k (а - х)(b - х) = k (а - х)(b - х)
| 4)  =
k1 (a – x) – k2 (b + x) =
k1 (a – x) – k2 (b + x)
|
А7. Графический метод нахождения порядка реакции: для необратимой реакции первого порядка прямолинейная зависимость наблюдается в координатах:
1) 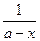 – t – t
| 2) 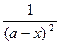 – t – t
| 3) ln(a – x) – t | 4) 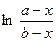 – t – t
|
А8. Для фотохимических реакций, протекающих в растворах или газах при очень малых давлениях, характерен квантовый выход:
| 1) g < 1 | 2) g = 1 | 3) g > 1 | 4) g >> 1 |
А9. Объединенный закон Ламберта-Бера (математическая запись) имеет вид:
1) - 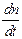 = g = g 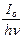 (1 - е–knl) (1 - е–knl)
| 2) g = 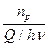
| 3) - 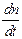 = KIo (1 - e–knl) = KIo (1 - e–knl)
| 4) I = Ioe–knl |
А10. Самым подвижным ионом в водных растворах является ион:
| 1) ОН– | 2) Li+ | 3) Cs+ | 4) Н3О+ |
А11. Какой из этих параметров не влияет на число переноса иона:
| 1) концентрация | 2) температура | 3) напряженность поля | 4) растворитель |
А12. Какова область применимости второго приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А13. Гальванический элемент, у которого к конечным электродам присоединены проводники первого рода из одного и того же материала, называется:
| 1) обратимым | 2) необратимым | 3) правильно разомкнутым | 4) электролизером |
А14. При повышении давления соответствующего газа в отрицательную сторону сдвигается потенциал электрода:
| 1) водородного | 2) кислородного | 3) хлорного | 4) фторного |
А15. Правило Лютера связывает между собой потенциалы электродов:
| 1) первого и второго рода | 2) первого рода и простых редокси | 3) простых и сложных редокси-электродов | 4) первого рода и амальгамных |
А16. Какие электроды используются в лабораторной практике в качестве электродов сравнения?
| 1) первого рода | 2) второго рода | 3) амальгамные | 4) редокси-электроды |
А17. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) сдвоенные химические | 2) простые химические | 3) сложные химические | 4) физические |
А18. Электрохимические цепи, в которых источником электрической энергии служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние, называются
| 1) физическими | 2) концентрационными | 3) химическими | 4) сдвоенными |
А19. Амальгамные цепи являются:
| 1) физическими | 2) концентрационными первого рода | 3) концентрационными второго рода | 4) химическими |
А20. Замедленное протекание химической реакции, предшествующей акту разряда (или следующей за ним), является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А21. При электролизе водных растворов кислородсодержащих солей щелочных металлов (электроды – платина) на аноде происходит:
| 1) выделение щелочного металла | 2) окисление анионов соли | 3) выделение кислорода из воды | 4) выделение кислорода из ионов гидроксила |
А22. Металлы с низким значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А23. Какой из этих факторов способствует снижению перенапряжения выделения водорода из кислых растворов:
| 1) повышение плотности тока | 2) повышение рН раствора | 3) добавление в раствор индифферентной соли | 4) повышение температуры |
Задание В (записать ответ: число, формулу, уравнение …)
В1. В каких единицах измеряется энергия активации химической реакции?
В2. Запишите выражение для константы скорости необратимой реакции первого порядка.
В3. Напишите уравнение, связывающее константу скорости реакции, энергию активации реакции и предэкспоненциальный множитель.
В4. Напишите закон разведения Оствальда.
В5. В каких единицах измеряется предельная подвижность ионов?
В6. Напишите выражение, связывающее удельную и эквивалентную электропроводность.
В7. Приведите математическую запись эмпирического закона ионной силы Льюиса-Рендалла.
В8. Приведите схематическую запись амальгамного электрода, напишите выражение для его потенциала.
В9. Приведите схематическую запись элемента Якоби-Даниэля.
В10. Запишите уравнение электрохимической реакции выделения водорода на катоде из кислых растворов.
Задание С (дать ответ на вопрос)
С1. Кинетическая классификация реакций (по каким признакам классифицируют реакции, на какие типы).
С2. Законы Фарадея: первый, второй, объединенный (формулировка, математическое выражение). Число Фарадея. Всегда ли выполняются законы Фарадея? Выход по току. Кулонометры.
С3. По какому принципу классифицируют электроды? Электроды первого рода.
С4. По каким принципам классифицируют электрохимические системы? Сложные химические цепи. Сдвоенные химические цепи.
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. В процессе синтеза хлороводорода на свету (по цепному механизму) реакция зарождения цепи является
| 1) мономолекулярной | 2) бимолекулярной | 3) тримолекулярной |
А2. Реакции, в которых исходные вещества реагируют одновременно в нескольких направлениях, называются:
| 1) односторонними | 2) последовательными | 3) параллельными | 4) изолированными |
А3. Состояние последовательной мономолекулярной реакции, которому отвечает уравнение
 =
= 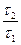 , называется
, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А4. Уравнение для константы скорости необратимой реакции второго порядка (при разных исходных концентрациях реагирующих веществ) имеет вид:
1) k = 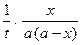
| 2) k =
 ln ln 
| 3) k =
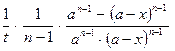
| 4) k1 + k2 =
 ln ln 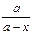
|
А5. Уравнение для времени полураспада в необратимой реакции третьего порядка имеет вид:
1) t = 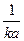
| 2) t = 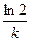
| 3) t = 
| 4) t = 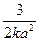
|
А6. Дифференциальное уравнение скорости необратимой реакции первого порядка имеет вид:
1)  = k (a - x)2 = k (a - x)2
| 2)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 3)  = k = k
| 4)  = k (a – x) = k (a – x)
|
А7. Графический метод нахождения порядка реакции: для необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) прямолинейная зависимость наблюдается в координатах:
1) 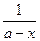 – t – t
| 2) 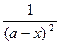 – t – t
| 3) ln(a – x) – t | 4) 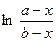 – t – t
|
А8. Для фотохимической реакции соединения хлора с водородом характерен квантовый выход:
| 1) g < 1 | 2) g = 1 | 3) g > 1 | 4) g >> 1 |
А9. Закон фотохимии, согласно которому химически активны лишь те лучи, которые поглощаются реакционной смесью, носит имя:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
А10. Какой из этих параметров не влияет на подвижность иона в растворе:
| 1) напряженность поля | 2) концентрация | 3) число переноса иона | 4) температура |
А11. Зависимость какой из этих величин от температуры не проходит через максимум?
| 1) удельная электропроводность k | 2) степень диссоциации a | 3) константа диссоциации слабого электролита КС | 4) электропроводность при конечной концентрации l |
А12. Какова область применимости третьего приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 – 2,0 | 4) m £ 10 |
А13. Гальванический элемент, в котором при прохождении тока в разных направлениях на поверхности электродов протекает одна и та же реакция, но в разных направлениях, называется:
| 1) обратимым | 2) необратимым | 3) правильно разомкнутым | 4) электролизером |
А14. Кадмиевый амальгамный электрод используется для изготовления:
| 1) элемента Даниэля-Якоби | 2) элемента Вестона | 3) элемента Вольта | 4) свинцового кислотного аккумулятора |
А15. Какие электроды обратимы по отношению к частицам трех сортов: анионам раствора, катионам гидроксония и анионам гидроксила?
| 1) металлоксидные второго рода | 2) первого рода | 3) амальгамные | 4) простые редокси-электроды |
А16. Какой электрод можно использовать и как электрод сравнения, и как индикаторный электрод при определении рН раствора?
| 1) хлорсеребряный | 2) хингидронный | 3) водородный | 4) амальгамный |
А17. Какие их данных электрохимических цепей являются цепями без переноса:
| 1) физические | 2) сложные химические | 3) концентрационные второго рода |
А18. ЭДС каких цепей имеет минимальное значение:
| 1) физических | 2) концентрационных | 3) химических |
А19. Измерение ЭДС каких цепей позволяет находить стандартные потенциалы электродов и коэффициенты активности электролитов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А20. Замедленность стадии доставки (или отвода) участников электрохимической реакции к электроду является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А21. При электролизе водных растворов солей таких металлов, как Fe, Co, Ni, Cr, Zn, Pb, Sn, на катоде происходит:
| 1) выделение водорода | 2) выделение металла | 3) одновременное выделение водорода и металла | 4) разряд анионов соли |
А22. Наибольшее значение постоянной а уравнения Тафеля для процесса катодного выделения водорода из кислых растворов имеют металлы:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А23. Какая из этих стадий процесса катодного выделения водорода на платине из растворов кислот является лимитирующей:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В (записать ответ: число, формулу, уравнение …)
В1. В каких единицах измеряется предэкспоненциальный множитель уравнения Аррениуса?
В2. Напишите выражение для константы скорости обратимой реакции первого порядка (если ее формально рассматривать как необратимую).
В3. Запишите уравнение Аррениуса в дифференциальной форме.
В4. Чему равно число Фарадея, в каких единицах измеряется?
В5. В каких единицах измеряется абсолютная подвижность ионов?
В6. Напишите выражение, определяющее ионную силу раствора.
В7. Напишите выражение первого приближения теории сильных электролитов Дебая и Гюккеля.
В8. Приведите схематическую запись металлического электрода первого рода и напишите выражение для его потенциала.
В9. Приведите схематическую запись водородно-кислородного топливного элемента.
В10. Запишите уравнение Тафеля.
Задание С (дать ответ на вопрос)
С1. Что такое порядок химической реакции, что он характеризует, чем отличается от молекулярности реакции? В каком случае совпадают порядок реакции, ее молекулярность и сумма стехиометрических коэффициентов в химическом уравнении реакции?
С2. Эквивалентная электропроводность электролита: определение, единицы измерения, связь с удельной электропроводностью; зависимость от концентрации и разведения (для сильных и слабых электролитов).
С3. По какому принципу классифицируют электроды? Окислительно-восстановительные электроды.
С4. По каким принципам классифицируют электрохимические системы? Концентрационные цепи первого рода.
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. В процессе синтеза хлороводорода на свету (по цепному механизму) реакции развития цепи являются
| 1) мономолекулярными | 2) бимолекулярными | 3) тримолекулярными |
А2. Ионные реакции в растворах, в ходе которых хотя бы один продукт удаляется из сферы реакции, являются
| 1) цепными | 2) обратимыми | 3) необратимыми | 4) молекулярными |
А3. Какой из этих методов определения частных порядков реакции является дифференциальным:
| 1) метод подбора уравнений | 2) метод Оствальда-Нойеса | 3) метод Вант-Гоффа | 4) графический метод (поиск линейной функции концентрации от времени) |
А4. Уравнение для константы скорости обратимой реакции первого порядка имеет вид:
1) k = 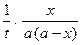
| 2) k = 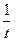 ln ln 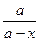
| 3) k =  ln ln 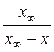
| 4) k1 + k2 =  ln ln 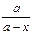
|
А5. Уравнение для времени полураспада в необратимой реакции второго порядка имеет вид:
1) t = 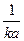
| 2) t = 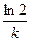
| 3) t = 
| 4) t = 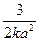
|
А6. Дифференциальное уравнение скорости необратимой реакции нулевого порядка имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  = k (а - х)2 = k (а - х)2
| 3)  = k = k
| 4)  = k (a – x)n = k (a – x)n
|
А7. Графический метод нахождения порядка реакции: для необратимой реакции первого порядка прямолинейная зависимость наблюдается в координатах:
1) 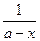 – t – t
| 2) 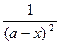 – t – t
| 3) ln(a – x) – t | 4) 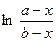 – t – t
|
А8. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) давления | 2) концентрации реагирующих веществ | 3) температуры | 4) присутствия инертных веществ |
А9. Закон фотохимии, согласно которому количество химически измененного вещества прямо пропорционально количеству поглощенной веществом световой энергии, носит имя:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
А10. Какой из этих электролитов (при прочих равных условиях) обладает наименьшей эквивалентной электропроводностью (растворитель – вода)?
| 1) K2SO4 | 2) Na2SO4 | 3) KOH | 4) H2SO4 |
А11. Зависимость какой из этих величин от температуры может проходить через максимум?
| 1) удельная электропроводность k | 2) предельная подвижность ионов lо+ , lо– | 3) эквивалентная электропроводность l¥ | 4) электропроводность при конечной концентрации l |
А12. Какова область применимости предельного закона Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А13. Какой из этих параметров оказывает наибольшее влияние на величину электродного потенциала:
| 1) природа электрода | 2) концентрация электролита | 3) температура | 4) давление |
А14. В каком из этих электродов металл электрода контактирует со своим труднорастворимым соединением:
| 1) первого рода | 2) второго рода | 3) газовом | 4) амальгамном |
А15. Какой из этих электродов можно использовать как индикаторный при определении рН раствора?
| 1) первого рода | 2) амальгамный | 3) каломельный | 4) хингидронный |
А16. В каком из этих электродов в качестве металла электрода не используют платину?
| 1) первого рода | 2) амальгамный | 3) газовый | 4) редокси-электрод |
А17. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) концентрационные первого рода | 2) концентрационные второго рода | 3) простые химические | 4) сдвоенные химиические |
А18. ЭДС каких цепей зависит от величин стандартных электродных потенциалов образующих ее электродов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А19. Измерение ЭДС каких цепей используют для нахождения чисел переноса ионов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А20. Какой из этих четырех терминов не является синонимом трем остальным?
| 1) электрохимическое перенапряжение | 2) перенапряжение транспортировки | 3) перенапряжение замедленного разряда | 4) перенапряжение электронного перехода |
А21. При электролизе концентрированного водного раствора соляной кислоты (электроды – платина) на аноде происходит:
| 1) выделение водорода из ионов гидроксония | 2) выделение кислорода из воды | 3) выделение газообразного хлора | 4) выделение кислорода из ионов гидроксила |
А22. Наименьшее значение постоянной а уравнения Тафеля для процесса катодного выделения водорода из кислых растворов имеют металлы:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А23. Какая из этих стадий процесса катодного выделения водорода на ртути из растворов кислот является лимитирующей:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В (записать ответ: число, формулу, уравнение …)
В1. В каких единицах измеряется скорость химической реакции?
В2. Запишите выражение для константы скорости необратимой реакции 2-го порядка (при одинаковых исходных концентрациях реагирующих веществ).
В3. Запишите выражение, определяющее температурный коэффициент скорости реакции.
В4. Приведите математическую запись объединенного закона Фарадея.
В5. В каких единицах измеряется подвижность ионов?
В6. Напишите два закона Кольрауша для эквивалентной электропроводности.
В7. Напишите выражение второго приближения теории сильных электролитов Дебая и Гюккеля. Какая величина в нем является эмпирической постоянной?
В8. Приведите схематическую запись элемента Вестона.
В9. Приведите схематическую запись хлорсеребряного электрода, напишите выражение для его потенциала.
В10. Запишите уравнение электрохимической реакции выделения водорода на катоде из нейтральных и щелочных растворов.
Задание С (дать ответ на вопрос)
С1. Что такое молекулярность химической реакции, что она характеризует, чем отличается от порядка реакции? В каком случае совпадают порядок реакции, ее молекулярность и сумма стехиометрических коэффициентов в химическом уравнении реакции?
С2. Удельная электропроводность растворов электролитов: определение, единицы измерения, физический смысл; зависимость от концентрации (изобразить графически, объяснить).
С3. По какому принципу классифицируют электроды? Газовые электроды.
С4. По каким принципам классифицируют электрохимические системы? Концентрационные цепи второго рода.
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Какое из этих определений относится к термодинамическому методу физической химии?
| 1) метод лежит в основе учения о строении и свойствах отдельных атомов и молекул и их взаимодействии между собой | 2) метод позволяет количественно связывать макроскопические свойства вещества и рассчитывать одни из этих свойств на основании величин других свойств | 3) метод экспериментального изучения законов протекания химических реакций во времени и законов химического равновесия | 4) метод дает возможность рассчитать макроскопические свойства вещества на основании сведений о свойствах отдельных молекул |
А2. Какое из этих определений относится к открытой термодинамической системе?
| 1) система не может обмениваться с окружающей средой ни веществом, ни энергией и сохраняет постоянный объем | 2) система может обмениваться с окружающей средой и веществом, и энергией и возможно изменение объема | 3) система не может обмениваться с окружающей средой веществом, но может обмениваться энергией и не сохранять объем | 4) система не может обмениваться с окружающей средой ни веществом, ни теплотой, но возможно изменение объема |
А3. Форма перехода энергии путем перемещения макроскопических масс под действием каких-либо сил – это:
| 1) работа | 2) теплота |
А4. Какая из данных термодинамических величин является функцией перехода?
| 1) температура | 2) энтальпия | 3) теплота | 4) энтропия |
А5. Какой из данных термодинамических параметров является величиной интенсивной?
| 1) температура | 2) внутренняя энергия | 3) энтропия | 4) энергия Гиббса |
А6. Какой из данных термодинамических параметров относится к обобщенным силам?
| 1) давление | 2) объем | 3) площадь поверхности | 4) количество вещества |
А7. Состояние системы, при котором независимые переменные постоянны в каждой точке, но в системе есть потоки (массы или энергии), называется
| 1) устойчивым равновесием | 2) метастабильным равновесием | 3) неравновесным состоянием | 4) стационарным состоянием |
А8. Какой из этих постулатов термодинамики называют основным постулатом?
| 1) постулат о существовании температуры | 2) постулат о термодинамическом равновесии системы | 3) постулат Планка | 4) постулат об энергии равновесной системы |
А9. Работа какого из этих процессов с участием идеального газа равна нулю?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А10. В каком из этих процессов с участием идеального газа изменение внутренней энергии не равно нулю?
| 1) изотермический процесс | 2) адиабатический процесс | 3) циклический процесс | 4) процесс в изолированной системе |
А11. Функция состояния энтальпия была введена для описания процессов:
| 1) изохорных | 2) изобарных | 3) изотермических | 4) адиабатических |
А12. Зависимость теплоты процесса (химической реакции) от температуры дается уравнениями
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А13. Процесс, проходящий в прямом, а затем в обратном направлении через одни и те же промежуточные состояния, называется:
| 1) положительным | 2) отрицательным | 3) равновесным | 4) неравновесным |
А14. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в изолированной системе?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энтропия |
А15. Изохорно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А16. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS | 2) G = H – TS | 3) G = F + PV | 4) G = U – TS + PV |
А17. Произведение PV называется:
| 1) свободная энергия | 2) связанная энергия | 3) внутренняя энергия | 4) внешняя энергия |
А18. Функцией каких переменных является внутренняя энергия?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что является предметом термодинамики?
В2. Чему равна теплоемкость Ср одноатомного идеального газа?
В3. Запишите уравнение Майера.
В4. Сформулируйте закон Джоуля – Гей-Люссака.
В5. Запишите выражение для работы изотермического процесса в идеальном газе.
В6. Какая работа в термодинамике считается положительной: работа расширения или сжатия?
В7. Какие условия в термодинамике считаются стандартными?
В8. Что называется вечным двигателем второго рода?
В9. Напишите выражение для расчета изменения энтропии в процессе нагревания при постоянном давлении (или объеме).
В10. Напишите выражение для полного дифференциала функции Н (энтальпии).
В11. Запишите уравнение Клапейрона-Клаузиуса (две формы записи).
В12. Что такое термодинамическая система?
В13. Сформулируйте закон Гесса. При каких условиях выполняется закон Гесса, почему?
В14. Какие фазовые переходы называются фазовыми переходами первого рода? Приведите примеры.
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какое из этих определений относится к методу статистической физики?
| 1) метод лежит в основе учения о строении и свойствах отдельных атомов и молекул и их взаимодействии между собой | 2) метод позволяет количественно связывать макроскопические свойства вещества и рассчитывать одни из этих свойств на основании величин других свойств | 3) метод экспериментального изучения законов протекания химических реакций во времени и законов химического равновесия | 4) метод дает возможность рассчитать макроскопические свойства вещества на основании сведений о свойствах отдельных молекул |
А2. Форма перехода энергии путем хаотического столкновения молекул двух соприкасающихся тел – это:
| 1) работа | 2) теплота |
А3. Какой из этих законов носит универсальный характер:
| 1) I закон термодинамики | 2) II закон термодинамики | 3) закон сохранения энергии | 4) закон Гесса |
А4. Какая из данных термодинамических величин является функцией перехода?
| 1) работа | 2) энтальпия | 3) объем | 4) энтропия |
А5. Какой из данных термодинамических параметров является величиной интенсивной?
| 1) свободная энергия | 2) внутренняя энергия | 3) давление | 4) объем |
А6. Какой из данных термодинамических параметров относится к обобщенным силам?
| 1) площадь поверхности | 2) объем | 3) электрический потенциал | 4) электрический заряд |
А7. Состояние системы, при котором всякое б/м воздействие вызывает только б/м изменение состояния, а некоторые малые воздействия – конечные изменения состояния системы, которые не исчезают после устранения этих воздействий, называется
| 1) устойчивым равновесием | 2) метастабильным равновесием | 3) неравновесным состоянием | 4) стационарным состоянием |
А8. Какой из этих постулатов термодинамики называют нулевым законом термодинамики?
| 1) постулат о существовании температуры | 2) постулат о термодинамическом равновесии системы | 3) постулат Планка | 4) постулат об энергии равновесной системы |
А9. Какие процессы не могут протекать в изолированной системе?
| 1) самопроизвольные | 2) несамопроизвольные | 3) равновесные |
А10. Какую из этих величин можно непосредственно измерить на опыте?
| 1) U | 2) DU | 3) H | 4) DH |
А11. В каком из процессов с участием идеального газа внутренняя энергия не изменяется?
| 1) изобарном | 2) изохорном | 3) изотермическом | 4) адиабатическом |
А12. Уравнениями адиабаты являются уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А13. Процесс, проходящий в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние, называется
| 1) положительным | 2) отрицательным | 3) равновесным | 4) обратимым |
А14. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства давления и температуры?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энтропия |
А15. Изохорно-изэнтропным потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А16. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS + PV | 2) G = H – TS | 3) G = F + PV | 4) G = U – TS |
А17. Произведение TS называется:
| 1) свободная энергия | 2) связанная энергия | 3) внутренняя энергия | 4) внешняя энергия |
А18. Функцией каких переменных является энтальпия?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что такое энергия?
В2. Что называется состоянием термодинамической системы?
В3. Какой термодинамический процесс мы называем циклом?
В4. Чему равна теплоемкость Сv одноатомного идеального газа?
В5. Запишите выражение, передающее связь между Qp и Qv для процессов в идеальном газе.
В6. Запишите выражение для работы изобарного процесса в идеальном газе.
В7. Какая работа в термодинамике считается отрицательной: работа расширения или сжатия?
В8. Как в термодинамике обозначается стандартная теплота образования вещества?
В9. Напишите выражение для расчета изменения энтропии в процессе фазового перехода первого рода.
В10. Напишите выражение для полного дифференциала функции F.
В11. Запишите уравнения Кирхгофа в интегральной форме.
В12. Дайте определение термодинамической системы закрытой, открытой, изолированной.
В13. Какая работа в термодинамике называется максимальной?
В14. Сформулируйте первый закон термодинамики
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Какое из этих определений относится к квантово-механическому методу?
| 1) метод лежит в основе учения о строении и свойствах отдельных атомов и молекул и их взаимодействии между собой | 2) метод позволяет количественно связывать макроскопические свойства вещества и рассчитывать одни из этих свойств на основании величин других свойств | 3) метод экспериментального изучения законов протекания химических реакций во времени и законов химического равновесия | 4) метод дает возможность рассчитать макроскопические свойства вещества на основании сведений о свойствах отдельных молекул |
А2. Какое из этих определений относится к закрытой термодинамической системе?
| 1) система не может обмениваться с окружающей средой ни веществом, ни энергией и сохраняет постоянный объем | 2) система может обмениваться с окружающей средой и веществом, и энергией и возможно изменение объема | 3) система не может обмениваться с окружающей средой веществом, но может обмениваться энергией и не сохранять объем | 4) система не может обмениваться с окружающей средой ни веществом, ни теплотой, но возможно изменение объема |
А3. Какой из этих законов носит статистический характер:
| 1) I закон термодинамики | 2) II закон термодинамики | 3) закон сохранения энергии | 4) закон Гесса |
А4. Какая из данных термодинамических величин является функцией перехода?
| 1) энергия Гиббса | 2) работа | 3) температура | 4) энтропия |
А5. Какой из данных термодинамических параметров является величиной интенсивной?
| 1) теплоемкость | 2) свободная энергия | 3) объем | 4) температура |
А6. Какой из данных термодинамических параметров относится к обобщенным координатам?
| 1) давление | 2) объем | 3) температура | 4) электрический потенциал |
А7. Состояние системы, при котором всякое б/м воздействие вызывает только б/м изменение состояния, а при устранении этого воздействия система возвращается в исходное состояние, называется
| 1) устойчивым равновесием | 2) метастабильным равновесием | 3) неравновесным состоянием | 4) стационарным состоянием |
А8. Какой из этих постулатов термодинамики называют третьим законом термодинамики?
| 1) постулат о существовании температуры | 2) постулат о термодинамическом равновесии системы | 3) постулат Планка | 4) постулат об энергии равновесной системы |
А9. Какой из этих видов энергии не включает в себя внутренняя энергия термодинамической системы?
| 1) кинетическая энергия всех частиц (атомов, ионов, молекул), составляющих систему | 2) кинетическая энергия системы как целого, связанная с движением системы | 3) энергия, отвечающая массе покоя всех частиц согласно уравнению Эйнштейна | 4) энергия межмолекулярных взаимодействий всех частиц |
А10. Какую из этих величин нельзя рассчитать из термодинамических данных?
| 1) U | 2) DU | 3) DS | 4) DH |
А11. Теплота какого из процессов с участием идеального газа равна работе этого процесса?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А12. Уравнениями, применимыми ко всем агрегатным превращениям чистых веществ, являются уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А13. Процессы, протекающие сами собой и приближающие систему к равновесию, называются
| 1) положительными | 2) отрицательными | 3) равновесными | 4) обратимыми |
А14. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства объема и температуры?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энергия Гельмгольца | 4) энтропия |
А15. Изобарно-изэнтропным потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А16. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = F + PV | 2) G = H – TS | 3) G = U – TS + PV | 4) G = U – TS |
А17. Сумме внутренней и внешней энергий равна термодинамическая функция, которая называется:
| 1) энтропия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А18. Функцией каких переменных является энергия Гиббса?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Чем, с точки зрения закона сохранения энергии, являются теплота и работа?
В2. Что такое термодинамический процесс?
В3. Какую зависимость в термодинамике называют уравнением состояния?
В4. Чему равна теплоемкость Сv двухатомного идеального газа?
В5. Напишите уравнения адиабаты.
В6. Запишите выражения, определяющие теплоемкость среднюю и истинную.
В7. Какая теплота в термодинамике считается положительной: та, которую система поглощает, или та, которую система выделяет?
В8. Как в термодинамике обозначается стандартная теплота сгорания вещества?
В9. Напишите выражение для расчета изменения энтропии в изотермическом процессе с участием идеального газа.
В10. Напишите выражение для полного дифференциала функции U.
В11. Запишите уравнения Кирхгофа в дифференциальной форме.
В12. Дайте определение гомогенной и гетерогенной термодинамической системы.
В13. Дайте одну или несколько формулировок второго закона термодинамики.
В14. Сформулируйте постулат Планка.
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. Какое из этих определений относится к кинетическому методу физической химии?
| 1) метод лежит в основе учения о строении и свойствах отдельных атомов и молекул и их взаимодействии между собой | 2) метод позволяет количественно связывать макроскопические свойства вещества и рассчитывать одни из этих свойств на основании величин других свойств | 3) метод экспериментального изучения законов протекания химических реакций во времени и законов химического равновесия | 4) метод дает возможность рассчитать макроскопические свойства вещества на основании сведений о свойствах отдельных молекул |
А2. Какое из этих определений относится к изолированной термодинамической системе?
| 1) система не может обмениваться с окружающей средой ни веществом, ни энергией и сохраняет постоянный объем | 2) система может обмениваться с окружающей средой и веществом, и энергией и возможно изменение объема | 3) система не может обмениваться с окружающей средой веществом, но может обмениваться энергией и не сохранять объем | 4) система не может обмениваться с окружающей средой ни веществом, ни теплотой, но возможно изменение объема |
А3. Какой из этих законов устанавливает возможность, направление и глубину протекания самопроизвольных процессов:
| 1) I закон термодинамики | 2) II закон термодинамики | 3) закон сохранения энергии | 4) закон Гесса |
А4. Какая из данных термодинамических величин является функцией перехода?
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) теплота | 4) давление |
А5. Какой из данных термодинамических параметров является величиной интенсивной?
| 1) теплоемкость | 2) температура | 3) объем | 4) энтропия |
А6. Какой из данных термодинамических параметров относится к обобщенным координатам?
| 1) давление | 2) температура | 3) объем | 4) химический потенциал |
А7. Состояние системы, при котором всякое б/м воздействие вызывает конечное изменение состояния системы, называется
| 1) устойчивым равновесием | 2) метастабильным равновесием | 3) неравновесным состоянием | 4) стационарным состоянием |
А8. Какой из этих постулатов термодинамики ограничивает размер систем, которые описывает термодинамика?
| 1) постулат о существовании температуры | 2) постулат о термодинамическом равновесии системы | 3) постулат Планка | 4) постулат об энергии равновесной системы |
А9. Какой из этих видов энергии не включает в себя внутренняя энергия термодинамической системы?
| 1) потенциальная энергия всех частиц (атомов, ионов, молекул), составляющих систему | 2) потенциальная энергия системы как целого | 3) кинетическая энергия всех частиц (атомов, ионов, молекул), составляющих систему | 4) энергия, отвечающая массе покоя всех частиц согласно уравнению Эйнштейна |
А10. Какую из этих величин нельзя рассчитать из термодинамических данных?
| 1) Н | 2) DG | 3) DS | 4) DF |
А11. Какой из процессов протекает без теплообмена с окружающей средой?
| 1) изобарный | 2) изохорный | 3) изотермический | 4) адиабатический |
А12. Связь между теплотой и работой термодинамического процесса передают уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А13. Процессы, которые не могут протекать сами собой, без воздействия извне, удаляющие систему от равновесия, называются:
| 1) положительными | 2) отрицательными | 3) равновесными | 4) обратимыми |
А14. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства объема и энтропии?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А15. Изобарно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А16. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = U – TS + PV | 2) G = U – TS | 3) G = F + PV | 4) G = Н– TS |
А17. Какую термодинамическую функцию можно представить как сумму свободной и связанной энергии?
| 1) энтропию | 2) энтальпию | 3) внутреннюю энергию | 4) энергию Гиббса |
А18. Функцией каких переменных является энергия Гельмгольца?
| 1) P и T | 2) V и T | 3) P и S | 4) V и S |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что такое фаза?
В2. Сформулируйте закон сохранения энергии.
В3. Чему равна теплоемкость Ср двухатомного идеального газа?
В4. Какими уравнениями описывается эмпирическая зависимость Ср реальных веществ от Т?
В5. Напишите выражение, передающее связь между Qp и Qv для химической реакции.
В6. Напишите выражения, определяющие изменение энтальпии в изобарном и изобарно-изотермическом процессах с участием идеального газа.
В7. Какая теплота в термохимии считается положительной: та, которую система поглощает, или та, которую система выделяет?
В8. Что такое теплоемкость? В каких единицах она измеряется?
В9. Напишите выражения для расчета DS в процессе с участием идеального газа, связанном с изменением T, P, V (общий случай).
В10. Напишите выражение, определяющее изохорно-изотермический потенциал.
В11. Запишите выражение для КПД цикла Карно.
В12. Что такое стандартная теплота образования вещества?
В13. За счет чего совершается работа адиабатического процесса?
В14. Приведите все известные вам термодинамические потенциалы. Какими свойствами они обладают?
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. Какая из этих характеристик не относится к термодинамическому методу физической химии?
| 1) метод базируется на нескольких законах, являющихся обобщением опытных данных | 2) метод применим только к системам, состоящим из очень большого числа частиц | 3) метод экспериментального изучения законов протекания химических реакций во времени и законов химического равновесия | 4) метод позволяет определить лишь возможность рассматриваемых процессов, но не их скорость |
А2. Какое из этих определений относится к адиабатически изолированной термодинамической системе?
| 1) система не может обмениваться с окружающей средой ни веществом, ни энергией и сохраняет постоянный объем | 2) система может обмениваться с окружающей средой и веществом, и энергией и возможно изменение объема | 3) система не может обмениваться с окружающей средой веществом, но может обмениваться энергией и не сохранять объем | 4) система не может обмениваться с окружающей средой ни веществом, ни теплотой, но возможно изменение объема |
А3. Какой из этих законов применим и к явлениям, протекающим в сколь угодно больших телах, и к явлениям, происходящим с участием одной или нескольких молекул?
| 1) I закон термодинамики | 2) II закон термодинамики | 3) закон сохранения энергии | 4) закон Гесса |
А4. Какая из данных термодинамических величин является функцией перехода?
| 1) энтропия | 2) внутренняя энергия | 3) давление | 4) теплота |
А5. Какой из данных термодинамических параметров является величиной интенсивной?
| 1) теплоемкость | 2) объем | 3) давление | 4) масса |
А6. Какой из данных термодинамических параметров относится к обобщенным силам?
| 1) объем | 2) температура | 3) площадь | 4) количество вещества |
А7. Состояние системы, при котором ряд ее свойств не изменяется самопроизвольно во времени и имеет одинаковое значение во всех точках объема отдельных фаз, при этом в системе нет потоков, называется
| 1) равновесным | 2) неравновесным | 3) стационарным |
А8. Какой из этих постулатов называют постулатом о существовании температуры?
| 1) нулевой закон термодинамики | 2) постулат о термодинамическом равновесии системы | 3) постулат Планка | 4) постулат об энергии равновесной системы |
А9. Внутренняя энергия идеального газа зависит только от:
| 1) давления | 2) температуры | 3) объема |
А10. Для расчета какой из этих величин нужно знать теплоту и работу термодинамического процесса?
| 1) U | 2) DU | 3) Н | 4) DH |
А11. Работа какого из процессов в идеальном газе совершается за счет уменьшения внутренней энергии?
| 1) изобарного | 2) изохорного | 3) изотермического | 4) адиабатического |
А12. Уравнения максимальной работы – это уравнения
| 1) Пуассона | 2) Кирхгофа | 3) Гиббса-Гельмгольца | 4) Клапейрона-Клаузиуса |
А13. Какое из этих определений не относится к равновесному процессу?
| 1) процесс протекает в прямом, а затем в обратном направлении через одни и те же промежуточные состояния | 2) процесс приближает систему к состоянию равновесия | 3) процесс протекает бесконечно медленно | 4) процесс протекает под действием бесконечно малых разностей обобщенных сил |
А14. Какая термодинамическая функция является критерием достижения равновесия (критерием самопроизвольного протекания процесса) в условиях постоянства давления и энтропии?
| 1) внутренняя энергия | 2) энергия Гиббса | 3) энтальпия | 4) энергия Гельмгольца |
А15. Изохорно-изотермическим потенциалом является:
| 1) энергия Гиббса | 2) энергия Гельмгольца | 3) энтальпия | 4) внутренняя энергия |
А16. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
| 1) G = F + PV | 2) G = H – TS | 3) G = H – TS + PV | 4) G = U– TS + PV |
А17. Какую термодинамическую функцию можно представить как сумму свободной и внешней энергии?
| 1) энергию Гельмгольца | 2) энтальпию | 3) внутреннюю энергию | 4) энергию Гиббса |
А18. Функцией каких переменных является энтропия?
| 1) P и T | 2) U и V | 3) P и S | 4) V и S |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Дайте определение термодинамической системы однородной и неоднородной.
В2. Что называется вечным двигателем первого рода?
В3. Чему равна теплоемкость Сv многоатомного идеального газа (нелинейная молекула)?
В4. Напишите выражение, определяющее энтальпию.
В5. Напишите выражения для работы адиабатического процесса в идеальном газе.
В6. Какая теплота в термодинамике считается отрицательной: та, которую система поглощает, или та, которую система выделяет?
В7. Сформулируйте теорему Карно – Клаузиуса.
В8. В каких единицах измеряется энтропия?
В9. Напишите выражение для расчета абсолютного значения энтропии вещества в газообразном состоянии.
В10. Перечислите все известные вам функции состояния системы.
В11. Что называется стандартной теплотой сгорания вещества?
В12. Что такое внутренняя энергия? В каких процессах изменение внутренней энергии равно нулю?
В13. Чем отличаются фазовые переходы первого рода от фазовых переходов второго рода? Приведите примеры.
В14. Сформулируйте общее термодинамическое условие равновесия системы.
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Масса компонента в единице массы раствора – это концентрация, которая называется:
| 1) молярность | 2) моляльность | 3) массовая доля | 4) мольная доля |
А2. Кто из этих ученых был сторонником химической теории растворов:
| 1) Вант-Гофф | 2) Аррениус | 3) Оствальд | 4) Менделеев |
А3. Выражение для химического потенциала компонента реального жидкого раствора имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А4. Растворимость газа в жидкости
| 1) не зависит от присутствия соли в растворе | 2) повышается с ростом концентрации соли | 3) понижается с ростом концентрации соли |
А5. Повышение температуры кипения разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А6. Какой из этих методов определения молекулярной массы растворенного вещества наиболее пригоден для определения молекулярной массы ВМС:
| 1) криоскопический | 2) эбуллиоскопический | 3) метод измерения осмотического давления | 4) метод измерения давления пара над раствором |
А7. Массу каждого компонента, вступившую к данному моменту в реакцию и измеренную в эквивалентных единицах, отвечающих уравнению реакции, показывает
| 1) криоскопическая постоянная | 2) эбуллиоскопическая постоянная | 3) химическая переменная | 4) изотонический коэффициент |
А8. Связь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции, выражается законом
| 1) Коновалова | 2) Рауля | 3) действующих масс | 4) правилом рычага |
А9. Уравнения изохоры и изобары химической реакции носят имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А10. Отрицательный наклон на диаграмме состояния однокомпонентной системы (в координатах Р-Т) может иметь кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А11. Точка, которой заканчивается кривая кипения на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А12. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А13. Число степеней свободы в эвтектической точке равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
А14. В трехкомпонентных системах, состоящих из трех жидкостей, взаимно ограниченно растворимых, состав критической точки можно определить с помощью:
| 1) треугольника Таммана | 2) правила Алексеева | 3) правила Тарасенкова | 4) правила рычага |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что такое растворы? Каковы основные параметры состояния растворов?
В2. Сформулируйте и напишите закон Генри.
В3. Какие растворы называются азеотропными, как для них выглядит диаграмма жидкость – пар?
В4. Напишите выражение, определяющее понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе.
В5. Запишите уравнение изотермы химической реакции для изобарного потенциала реакции.
В6. Какую связь передает закон действующих масс?
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Число молей компонента в 1 моле раствора – это концентрация, которая называется:
| 1) молярность | 2) моляльность | 3) массовая доля | 4) мольная доля |
А2. Выражение для химического потенциала компонента идеального жидкого раствора имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А3. Правило прямолинейного диаметра, позволяющее найти критические температуры растворения жидкостей, ограниченно смешивающихся между собой, установил
| 1) Вант-Гофф | 2) Менделеев | 3) Алексеев | 4) Аррениус |
А4. Величина, показывающая, сколько объемов газа растворяется в 1 объеме раствора при данной Т, называется
| 1) идеальной растворимостью газа | 2) коэффициентом растворимости газа | 3) коэффициентом поглощения газа | 4) активностью газа |
А5. Понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А6. Молекулярным повышением температуры кипения раствора называют
| 1) криоскопическую постоянную | 2) эбуллиоскопическую постоянную | 3) химическую переменную | 4) изотонический коэффициент |
А7. Зависимость константы равновесия химической реакции от Т дается уравнениями:
| 1) изотермы химической реакции | 2) изобары химической реакции | 3) законом действующих масс | 4) правилом фаз Гиббса |
А8. Для нахождения (графическим способом) масс сосуществующих в равновесии фаз пользуются
| 1) законами Коновалова | 2) законом Рауля | 3) законом действующих масс | 4) правилом рычага |
А9. Правило фаз носит имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А10. Метастабильной кривой на диаграмме состояния однокомпонентной системы (в координатах Р-Т) является кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А11. Точка, в которой сходятся все пограничные линии на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А12. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А13. Число степеней свободы в тройной точке равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
А14. Состав каких систем удобно изображать, пользуясь треугольником Гиббса – Розебома:
| 1) однокомпонентных | 2) двухкомпонентных | 3) трехкомпонентных |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Какие свойства растворов называют коллигативными, что для них характерно?
В2. Какие растворы называются предельно разбавленными?
В3. Напишите выражение, определяющее осмотическое давление разбавленного раствора нелетучего вещества в летучем растворителе.
В4. Для каких целей используют криоскопию и эбуллиоскопию?
В5. Запишите общее условие химического равновесия.
В6. Запишите уравнение изотермы химической реакции для изохорного потенциала реакции.
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Объем чистого компонента в 100 единицах объема раствора – это концентрация, которая называется:
| 1) весовой процент | 2) моляльность | 3) объемный процент | 4) мольная доля |
А2. Свойства растворов, зависящие только от пропорций молекул составных частей раствора и не зависящие от природы растворенного вещества, называются:
| 1) парциальными | 2) коллигативными | 3) термодинамическими |
А3. Выражение для химического потенциала компонента смеси реальных газов имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А4. Идеальная растворимость твердых веществ не зависит от:
| 1) температуры | 2) давления | 3) природы растворителя | 4) природы растворенного вещества |
А5. Осмотическое давление разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А6. Молекулярным понижением точки затвердевания раствора называют
| 1) криоскопическую постоянную | 2) эбуллиоскопическую постоянную | 3) химическую переменную | 4) изотонический коэффициент |
А7. Относительное понижение давления пара растворителя над раствором определяется
| 1) законами Коновалова | 2) законом Рауля | 3) законом действующих масс | 4) правилом рычага |
А8. Тепловой закон носит имя
| 1) Нернста | 2) Вант-Гоффа | 3) Планка | 4) Гиббса |
А9. Двумя точками на диаграмме состояния однокомпонентной системы (в координатах Р-Т) ограничена кривая
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А10. Любая точка на плоскости диаграммы состояния гетерогенной системы называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А11. Сколько тройных точек, отвечающих стабильному равновесию, находится на диаграмме состояния серы?
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А12. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А13. Число степеней свободы в точке, лежащей на кривой плавления диаграммы однокомпонентной системы (в координатах Р-Т), равно
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
А14. Перитектическая точка может находиться на диаграмме состояния:
| 1) системы с простой эвтектикой | 2) системы, образующей устойчивое химическое соединение, плавящееся без разложения | 3 системы, образующей неустойчивое химическое соединение, плавящееся с разложением | 4) системы, компоненты которой образуют твердые растворы в любых соотношениях |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что такое химический потенциал?
В2. Что такое компоненты раствора?
В3. Запишите объединенный закон Рауля-Генри.
В4. Что такое термодинамическая активность, для какой цели вводится эта величина?
В5. Запишите уравнение изобары химической реакции Вант-Гоффа.
В6. Сформулируйте и напишите правило фаз Гиббса.
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. Число молей компонента в 1 л раствора – это концентрация, которая называется:
| 1) молярность | 2) моляльность | 3) массовая доля | 4) мольная доля |
А2. Выражение для химического потенциала компонента идеальной газовой смеси имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢¢(T,P) + RT ln Ni | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А3. Растворимость газа в жидкости, как правило,
| 1) не зависит от Т | 2) повышается с ростом Т | 3) понижается с ростом Т |
А4. Температурой замерзания раствора нелетучего вещества в летучем растворителе называется температура, при которой:
| 1) начинается образование первых кристаллов | 2) раствор полностью закристаллизовывается |
А5. Понижение давления пара растворителя над раствором пропорционально концентрации растворенного вещества, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А6. Мерой влияния диссоциации (ассоциации) растворенного вещества на коллигативные свойства растворов является:
| 1) криоскопическая постоянная | 2) эбуллиоскопическая постоянная | 3) химическая переменная | 4) изотонический коэффициент |
А7. Равновесие жидкость – пар в бинарных системах подчиняется:
| 1) законам Коновалова | 2) закону Рауля | 3) закону действующих масс | 4) правилу рычага |
А8. Возможность вычислить абсолютное значение энтропии индивидуального вещества дает:
| 1) тепловой закон Нернста | 2) уравнение изобары (изохоры) Вант-Гоффа | 3) постулат Планка | 4) правило фаз Гиббса |
А9. В каком случае для расчета изобарного потенциала реакции применяют метод Темкина – Шварцмана:
| 1) зависимость теплоемкости от Т известна для всех участников реакции в исследуемом интервале температур | 2) известна теплоемкость всех участников реакции при стандартной (либо комнатной) температуре | 3) теплоемкости некоторых участников реакции совершенно неизвестны |
А10. Двойному равновесию твердая фаза – пар (газ) на диаграмме состояния однокомпонентной системы (в координатах Р-Т) отвечает кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А11. Точка на диаграмме состояния двухкомпонентной системы (в координатах температура – состав), в которой могут находиться в равновесии три фазы (расплав и два вида кристаллов), называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А12. В каком из этих типов двухкомпонентных систем затвердевший расплав может представлять собой одну фазу:
| 1) системы с простой эвтектикой | 2) системы, образующие устойчивое химическое соединение, плавящееся без разложения | 3 системы, образующие неустойчивое химическое соединение, плавящееся с разложением | 4) системы, компоненты которых образуют твердые растворы в любых соотношениях |
А13. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А14. Число степеней свободы в точке, лежащей на кривой возгонки диаграммы однокомпонентной системы (в координатах Р-Т), равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Сформулируйте и напишите закон Рауля.
В2. Сформулируйте законы Коновалова.
В3. Какой раствор называют насыщенным?
В4. Запишите уравнение изохоры Вант-Гоффа.
В5. Какие точки на диаграмме состояния называют сопряженными? Что такое нода?
В6. Для какой цели используют термический анализ, в чем состоит его сущность?
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. Число молей компонента в расчете на 1 кг растворителя – это концентрация, которая называется:
| 1) молярность | 2) моляльность | 3) массовая доля | 4) мольная доля |
А2. Выражение для химического потенциала компонента идеальной газовой смеси имеет вид:
| 1) mi = mio (T) + RT ln а i | 2) mi = Gi¢ (T) + RT ln Pi | 3) mi = mi (T) + RT ln fi | 4) mi = mio (T) + RT ln Ni |
А3. Растворимость газа в жидкости
| 1) не зависит от парциального давления газа | 2) повышается с ростом р | 3) понижается с ростом р |
А4. Понижение температуры замерзания разбавленного раствора нелетучего вещества в летучем растворителе пропорционально концентрации раствора, выраженной как
| 1) молярность | 2) моляльность | 3) нормальность | 4) мольная доля |
А5. В каком из этих случаев раствор всегда кипит при более высокой температуре, чем чистый растворитель:
| 1) раствор одного летучего компонента в другом | 2) раствора газа в летучем растворителе | 3) раствор нелетучего вещества в летучем растворителе |
А6. Изобарный потенциал системы, приходящийся на 1 моль компонента, это:
| 1) криоскопическая постоянная | 2) химический потенциал | 3) химическая переменная | 4) изотонический коэффициент |
А7. Зависимость растворимости газа в жидкости от его давления (при невысоких Р) подчиняется закону
| 1) Генри | 2) Рауля | 3) Коновалова | 4) Менделеева-Клапейрона |
А8. Уравнение, описывающее закономерности осмотического давления разбавленных растворов, носит имя:
| 1) Нернста | 2) Вант-Гоффа | 3) Рауля | 4) Генри |
А9. Двойному равновесию жидкость – пар на диаграмме состояния однокомпонентной системы (в координатах Р-Т) отвечает кривая:
| 1) кипения | 2) возгонки | 3) плавления | 4) давления пара над переохлажденной жидкостью |
А10. Точка, которой заканчивается кривая кипения на диаграмме состояния однокомпонентной системы, называется:
| 1) тройной | 2) критической | 3) эвтектической | 4) фигуративной |
А11. Максимально возможное число равновесных фаз в однокомпонентной системе равно:
| 1) 1 | 2) 2 | 3) 3 | 4) 4 |
А12. Число степеней свободы в точке, находящейся на линии солидуса на диаграмме состояния двухкомпонентной системы (в координатах температура – состав), равно:
| 1) 0 | 2) 1 | 3) 2 | 4) 3 |
А13. В двухкомпонентных системах с простой эвтектикой состав эвтектики можно определить с помощью:
| 1) треугольника Таммана | 2) правила Алексеева | 3) правила Тарасенкова | 4) правила рычага |
А14. Неограниченная растворимость компонентов бинарной смеси в твердом состоянии может иметь место, если компоненты образуют:
| 1) твердые растворы внедрения | 2) твердые растворы замещения |
Задание В (записать ответ: число, формулу, уравнение, определение)
В1. Что такое насыщенный пар?
В2. Какие растворы называют идеальными?
В3. Напишите выражение, определяющее повышение температуры кипения разбавленного раствора нелетучего вещества в летучем растворителе.
В4. Что такое осмотическое давление?
В5. Напишите наиболее общее выражение ЗДМ для химических реакций, протекающих между веществами, находящимися в разных фазах.
В6. Какую зависимость передают уравнения изохоры и изобары Вант-Гоффа?
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Какую из следующих величин мы называем удельной скоростью химической реакции?
| 1) порядок реакции | 2) стехиометрический коэффициент | 3) константу скорости реакции | 4) молекулярность реакции |
А2. Какая из следующих величин меняет свою размерность в зависимости от порядка реакции?
| 1) скорость реакции | 2) время полураспада | 3) константа скорости реакции | 4) молекулярность реакции |
А3. Наиболее редким типом химической реакции являются реакции:
| 1) мономолекулярные | 2) бимолекулярные | 3) тримолекулярные |
А4. Какие из этих реакций не могут протекать как мономолекулярные?
| 1) реакции диссоциации | 2) реакции изомеризации | 3) реакции синтеза | 4) реакции ядерного распада |
А5. Реакции с участием атомов или свободных радикалов называются:
| 1) молекулярными | 2) ионными | 3) цепными | 4) гетерогенными |
А6. Какие реакции иначе называют консекутивными:
| 1) обратимые | 2) необратимые | 3) последовательные | 4) параллельные |
А7. Время, к которому прореагирует половина исходного вещества, называется:
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А8. Уравнение для константы скорости обратимой реакции первого порядка имеет вид:
1) k = 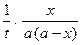
| 2) k = 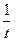 ln ln 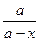
| 3) k =  ln ln 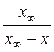
| 4) k1 + k2 =  ln ln 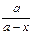
|
А9. Уравнение для времени полураспада в необратимой реакции первого порядка имеет вид:
1) t = 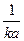
| 2) t = 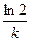
| 3) t = 
| 4) t = 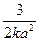
|
А10. Дифференциальное уравнение скорости необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  = k (а - х)(b - х) = k (а - х)(b - х)
| 3)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 4)  = k (a – x)2 = k (a – x)2
|
А11. Графический метод нахождения порядка реакции: для необратимой реакции третьего порядка прямолинейная зависимость наблюдается в координатах:
1) 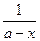 – t – t
| 2) 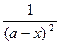 – t – t
| 3) ln(a – x) – t | 4) 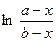 – t – t
|
А13. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) температуры | 2) концентрации реагирующих веществ | 3) величины поверхности реакционного сосуда | 4) катализатора |
А13. Основным законом фотохимии является закон:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
Задание В
В1. Что называется скоростью химической реакции? В каких единицах она измеряется?
В2. Какие реакции называют элементарными?
В3. В каких единицах измеряется константа скорости реакции первого порядка?
В4. Напишите выражение для константы скорости необратимой реакции второго порядка (при разных исходных количествах реагирующих веществ).
В5. Запишите уравнение Аррениуса в интегральной форме (неопределенный интеграл).
В6. Приведите схему цепной реакции синтеза хлороводорода на свету. Какие группы реакций можно выделить в этой схеме?
В7. Сформулируйте закон Гротгуса-Дрейпера.
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какая из перечисленных величин характеризует формально-кинетическую зависимость скорости реакции от концентрации реагирующих веществ?
| 1) стехиометрический коэффициент | 2) порядок реакции | 3) молекулярность реакции | 4) константа скорости |
А2. Какой тип химических реакций (если рассматривать их с точки зрения молекулярности) практически не встречается:
| 1) одномолекулярные | 2) двухмолекулярные | 3) трехмолекулярные | 4) четырехмолекулярные |
А3. Реакции какого типа могут быть простыми (протекающими в одну стадию)?
| 1) цепные | 2) ионные | 3) последовательные | 4) параллельные |
А4. Какие реакции иначе называют спонтанными:
| 1) элементарные | 2) мономолекулярные | 3) консекутивные | 4) обратимые |
А5. Какая из перечисленных величин может принимать отрицательные значения?
| 1) скорость реакции | 2) порядок реакции | 3) молекулярность реакции | 4) константа скорости |
А6. Постоянную скорость имеют реакции:
| 1) 1-го порядка | 2) 2-го порядка | 3) нулевого порядка | 4) цепные |
А7. Промежуток времени после начала реакции (в последовательных мономолекулярных реакциях), в течение которого конечное вещество нельзя обнаружить аналитически, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А8. Уравнение для константы скорости необратимой реакции первого порядка имеет вид:
1) k = 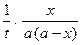
| 2) k = 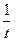 ln ln 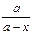
| 3) k =  ln ln 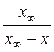
| 4) k1 + k2 =  ln ln 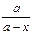
|
А9. Уравнение для времени полураспада в необратимой реакции третьего порядка имеет вид:
1) t = 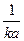
| 2) t = 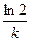
| 3) t = 
| 4) t = 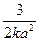
|
А10. Дифференциальное уравнение скорости двух параллельных реакций первого порядка имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  =
k1 (a – x) – k2 (b + x) =
k1 (a – x) – k2 (b + x)
| 3)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 4)  = k (a - x)2 = k (a - x)2
|
А11. Графический метод нахождения порядка реакции: для необратимой реакции второго порядка (разные исходные концентрации реагирующих веществ) прямолинейная зависимость наблюдается в координатах:
1) 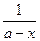 – t – t
| 2) 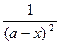 – t – t
| 3) ln(a – x) – t | 4) 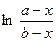 – t – t
|
А12. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) присутствия инертных веществ | 2) концентрации реагирующих веществ | 3) температуры | 4) катализатора |
А13. Наиболее общее выражение для скорости фотохимической реакции, объединяющее все законы фотохимии, имеет вид:
1) - 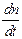 = g = g 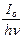 (1 - е–knl) (1 - е–knl)
| 2) g = 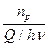
| 3) -  = KIo (1 - e–knl) = KIo (1 - e–knl)
| 4) I = Ioe–knl |
Задание В
В1. Сформулируйте и запишите основной постулат химической кинетики, дайте характеристику входящим в него величинам.
В2. В каких единицах измеряется константа скорости реакции второго порядка?
В3. Запишите выражение для константы скорости необратимой реакции n-го порядка.
В4. Какие экспериментально полученные данные указывают на то, что реакция является последовательной (протекает через промежуточные стадии)?
В5. Запишите уравнение Аррениуса в интегральной форме (определенный интеграл).
В6. Что такое кинетическая кривая? Изобразите кинетические кривые для необратимой реакции первого порядка и последовательной реакции первого порядка.
В7. Сформулируйте закон Ламберта-Бера, приведите его математическую запись.
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Какая из перечисленных величин характеризует элементарный механизм отдельных стадий сложного процесса?
| 1) стехиометрический коэффициент | 2) порядок реакции | 3) молекулярность реакции | 4) константа скорости |
А2. Реакции изомеризации и диссоциации являются:
| 1) мономолекулярными | 2) бимолекулярными | 3) тримолекулярными |
А3. Большинство химических реакций относится к
| 1) цепным | 2) последовательным | 3) параллельным | 4) необратимым |
А4. Какая из перечисленных величин не может принимать дробные значения?
| 1) скорость реакции | 2) порядок реакции | 3) молекулярность реакции | 4) константа скорости |
А5. У каких из этих реакций встречается нулевой порядок?
| 1) цепные | 2) ионные реакции в растворах | 3) гетерогенные | 4) ядерного распада |
А6. Какой порядок реакции является истинным:
| 1) временной | 2) концентрационный |
А7. Состояние последовательной мономолекулярной реакции, когда количества веществ А (исходное вещество) и В (промежуточное вещество) убывают в одинаковой степени, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А8. Уравнение для константы скорости необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) имеет вид:
1) k = 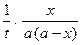
| 2) k = 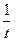 ln ln 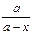
| 3) k =  ln ln 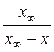
| 4) k1 + k2 =  ln ln 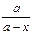
|
А9. Уравнение для времени полураспада в необратимой реакции нулевого порядка имеет вид:
1) t = 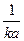
| 2) t = 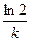
| 3) t = 
| 4) t = 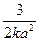
|
А10. Дифференциальное уравнение скорости необратимой реакции второго порядка (при разных исходных концентрациях реагирующих веществ) имеет вид:
1)  = k (a - x)2 = k (a - x)2
| 2)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 3)  = k (а - х)(b - х) = k (а - х)(b - х)
| 4)  =
k1 (a – x) – k2 (b + x) =
k1 (a – x) – k2 (b + x)
|
А11. Графический метод нахождения порядка реакции: для необратимой реакции первого порядка прямолинейная зависимость наблюдается в координатах:
1) 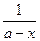 – t – t
| 2) 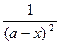 – t – t
| 3) ln(a – x) – t | 4) 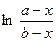 – t – t
|
А12. Для фотохимических реакций, протекающих в растворах или газах при очень малых давлениях, характерен квантовый выход:
| 1) g < 1 | 2) g = 1 | 3) g > 1 | 4) g >> 1 |
А13. Объединенный закон Ламберта-Бера (математическая запись) имеет вид:
1) - 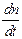 = g = g 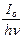 (1 - е–knl) (1 - е–knl)
| 2) g = 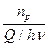
| 3) -  = KIo (1 - e–knl) = KIo (1 - e–knl)
| 4) I = Ioe–knl |
Задание В
В1. Запишите выражения для скорости химической реакции средней и истинной.
В2. Какая стадия суммарной реакции называется лимитирующей?
В3. В каких единицах измеряется энергия активации химической реакции?
В4. Запишите выражение для константы скорости необратимой реакции первого порядка.
В5. Напишите уравнение, связывающее константу скорости реакции, энергию активации реакции и предэкспоненциальный множитель.
В6. В чем состоит принцип независимости (принцип сосуществования) реакций, на котором основано изучение кинетики сложных реакций?
В7. Какие реакции называются цепными?
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. Какой тип элементарных реакций является самым распространенным?
| 1) мономолекулярные | 2) бимолекулярные | 3) тримолекулярные |
А2. В процессе синтеза хлороводорода на свету (по цепному механизму) реакция зарождения цепи является
| 1) мономолекулярной | 2) бимолекулярной | 3) тримолекулярной |
А3. Какая из перечисленных величин не может принимать ни дробные, ни отрицательные значения?
| 1) скорость реакции | 2) порядок реакции | 3) молекулярность реакции | 4) константа скорости |
А4. Реакции, в которых исходные вещества реагируют одновременно в нескольких направлениях, называются:
| 1) односторонними | 2) последовательными | 3) параллельными | 4) изолированными |
А5. Состояние последовательной мономолекулярной реакции, которому отвечает уравнение
 =
=  , называется
, называется
| 1) периодом индукции | 2) периодом полупревращения | 3) вековым равновесием | 4) переходным равновесием |
А6. Уравнение для константы скорости необратимой реакции второго порядка (при разных исходных концентрациях реагирующих веществ) имеет вид:
1) k = 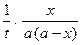
| 2) k =
 ln ln 
| 3) k =
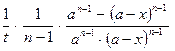
| 4) k1 + k2 =
 ln ln 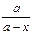
|
А7. Уравнение для времени полураспада в необратимой реакции третьего порядка имеет вид:
1) t = 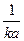
| 2) t = 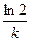
| 3) t = 
| 4) t = 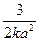
|
А8. Дифференциальное уравнение скорости необратимой реакции первого порядка имеет вид:
1)  = k (a - x)2 = k (a - x)2
| 2)  = (k1 + k2)(a – x) = (k1 + k2)(a – x)
| 3)  = k = k
| 4)  = k (a – x) = k (a – x)
|
А9. Графический метод нахождения порядка реакции: для необратимой реакции второго порядка (при одинаковых исходных концентрациях реагирующих веществ) прямолинейная зависимость наблюдается в координатах:
1) 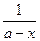 – t – t
| 2) 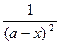 – t – t
| 3) ln(a – x) – t | 4) 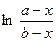 – t – t
|
А10. Что является мерой влияния температуры на скорость химической реакции?
| 1) порядок реакции | 2) энергия активации | 3) константа скорости реакции | 4) молекулярность реакции |
А11. Какие из этих реакций имеют аномальную зависимость константы скорости реакции от температуры:
| 1) мономолекулярные | 2) бимолекулярные | 3) тримолекулярные |
А12. Для фотохимической реакции соединения хлора с водородом характерен квантовый выход:
| 1) g < 1 | 2) g = 1 | 3) g > 1 | 4) g >> 1 |
А13. Закон фотохимии, согласно которому химически активны лишь те лучи, которые поглощаются реакционной смесью, носит имя:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
Задание В
В1. Что такое порядок химической реакции? Что такое молекулярность химической реакции? В каком случае они совпадают между собой?
В2. В каких единицах измеряется предэкспоненциальный множитель уравнения Аррениуса?
В3. Напишите выражение для константы скорости обратимой реакции первого порядка (если ее формально рассматривать как необратимую).
В4. Запишите уравнение Аррениуса в дифференциальной форме.
В5. Какой набор экспериментальных данных необходим для определения порядка реакции?
В6. Сформулируйте закон фотохимической эквивалентности Штарка-Эйнштейна. Всегда ли выполняется этот закон?
В7. Какие реакции называются сенсибилизированными?
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. Какое из перечисленных выражений можно рассматривать как выражение материального баланса (закона сохранения вещества)?
| 1) уравнение реакции | 2) запись основного постулата химической кинетики | 3) выражение закона действующих масс | 4) кинетическое уравнение реакции |
А2. В процессе синтеза хлороводорода на свету (по цепному механизму) реакции развития цепи являются
| 1) мономолекулярными | 2) бимолекулярными | 3) тримолекулярными |
А3. Ионные реакции в растворах, в ходе которых хотя бы один продукт удаляется из сферы реакции, являются
| 1) цепными | 2) обратимыми | 3) необратимыми | 4) молекулярными |
А4. Последовательные реакции иначе еще называют:
| 1) сопряженными | 2) спонтанными | 3) консекутивными | 4) элементарными |
А5. Какая из перечисленных величин не может входить в кинетическое уравнение реакции?
| 1) время | 2) концентрация | 3) термодинамическая активность | 4) объем |
А6. Для какого типа реакций нельзя получить в явной форме выражение для константы скорости реакции?
| 1) обратимые реакции | 2) параллельные реакции | 3) последовательные реакции | 4) реакции нулевого порядка |
А7. Какой из этих методов определения частных порядков реакции является дифференциальным:
| 1) метод подбора уравнений | 2) метод Оствальда-Нойеса | 3) метод Вант-Гоффа | 4) графический метод (поиск линейной функции концентрации от времени) |
А8. Уравнение для константы скорости обратимой реакции первого порядка имеет вид:
1) k = 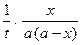
| 2) k = 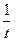 ln ln 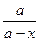
| 3) k =  ln ln 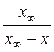
| 4) k1 + k2 =  ln ln 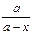
|
А9. Уравнение для времени полураспада в необратимой реакции второго порядка имеет вид:
1) t = 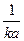
| 2) t = 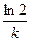
| 3) t = 
| 4) t = 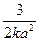
|
А10. Дифференциальное уравнение скорости необратимой реакции нулевого порядка имеет вид:
1)  = k (a - x) = k (a - x)
| 2)  = k (а - х)2 = k (а - х)2
| 3)  = k = k
| 4)  = k (a – x)n = k (a – x)n
|
А11. Графический метод нахождения порядка реакции: для необратимой реакции первого порядка прямолинейная зависимость наблюдается в координатах:
1) 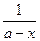 – t – t
| 2) 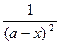 – t – t
| 3) ln(a – x) – t | 4) 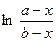 – t – t
|
А12. Особенностью цепной реакции, отличающей ее от прочих химических реакций, является зависимость ее скорости от:
| 1) давления | 2) концентрации реагирующих веществ | 3) температуры | 4) присутствия инертных веществ |
А13. Закон фотохимии, согласно которому количество химически измененного вещества прямо пропорционально количеству поглощенной веществом световой энергии, носит имя:
| 1) Ламберта-Бера | 2) Гротгуса-Дрейпера | 3) Штарка-Эйнштейна | 4) Вант-Гоффа |
Задание В
В1. Кинетическая классификация реакций: по каким принципам классифицируют химические реакции, на какие типы?
В2. В каких единицах измеряется скорость химической реакции?
В3. Запишите выражение для константы скорости необратимой реакции 2-го порядка (при одинаковых исходных концентрациях реагирующих веществ).
В4. Всегда ли выполняется принцип независимости реакций, на котором основано изучение кинетики сложных реакций?
В5. Запишите выражение, определяющее температурный коэффициент скорости реакции.
В6. Что такое квантовый выход? На какие группы делятся фотохимические реакции в зависимости от величины квантового выхода? Приведите примеры.
В7. Что называется энергией активации химической реакции?
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. Какая из этих особенностей характерна для электрохимической реакции, в отличие от химической?
| 1) необходимость контакта реагирующих частиц | 2) ненаправленность электронных переходов | 3) пространственное разделение участников реакции | 4) маленький путь электрона при переходе от восстановителя к окислителю |
А2. Какой из этих классов веществ относится к проводникам первого рода?
| 1) расплавы солей | 2) жидкие металлы | 3) растворы солей в воде | 4) растворы кислот и оснований в воде |
А3. Какое из этих веществ не относится к ионофорам?
| 1) NaCl | 2) NaOH | 3) Na2SO4 | 4) H2SO4 |
А4. Какое свойство растворителя является определяющим в его способности ионизировать растворённое вещество (помимо его способности к химическому взаимодействию с этим веществом)?
| 1) вязкость | 2) диэлектрическая проницаемость | 3) температура кипения | 4) плотность |
А5. Теплота гидратации какого из этих ионов будет иметь наибольшую величину?
| 1) Li+ | 2) Na+ | 3) K+ | 4) Cs+ |
А6. Сколько эмпирических постоянных содержит 3-е приближение теории сильных электролитов Дебая-Гюккеля?
| 1) 1 | 2) 2 | 3) 3 | 4) ни одной |
А7. Какова область применимости эмпирического закона ионной силы Льюиса-Рендалла?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А8. Абсолютная подвижность иона – это:
| 1) скорость движения иона, выраженная в электростатических единицах | 2) скорость движения иона при напряженности поля, равной 1 | 3) скорость движения иона при бесконечном разведении | 4) скорость движения иона в насыщенном растворе |
А9. Какой из этих ионов будет обладать наибольшей подвижностью в водных растворах?
| 1) J– | 2) Br– | 3) Cl– | 4) F– |
А10. Эффект торможения, связанный с возникновением дополнительной силы трения при движении противоположно заряженных ионов в разные стороны, называется:
| 1) эффектом асимметрии | 2) эффектом релаксации | 3) электрофоретическим эффектом | 4) эффектом Вина |
А11. Если к раствору малорастворимой соли добавить хорошо растворимое соединение, имеющее общий ион с малорастворимой солью, то произведение растворимости малорастворимой соли, выраженное через активности:
| 1) уменьшится | 2) не изменится | 3) увеличится |
Задание В
В1. Какова основная отличительная особенность электрохимических реакций по сравнению с химическими?
В2. Приведите математическую запись 1-го закона Фарадея и сформулируйте этот закон.
В3. Что такое число сольватации иона, как оно зависит от радиуса иона и его заряда?
В4. Что такое эквивалентная электропроводность, в каких единицах она измеряется?
В5. Напишите выражения, определяющие числа переноса.
В6. Напишите выражение, связывающее среднюю ионную активность электролита и его концентрацию (моляльность).
В7. Какие водные растворы мы называем кислыми?
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какая из этих особенностей характерна для химической реакции, в отличие от электрохимической?
| 1) необходимость контакта реагирующих частиц | 2) зависимость скорости реакции от потенциала | 3) пространственное разделение участников реакции | 4) энергетический эффект процесса проявляется в виде электрической энергии |
А2. Какой из этих классов веществ не относится к проводникам второго рода?
| 1) расплавы солей | 2) металлы | 3) растворы солей в воде | 4) растворы кислот и оснований в воде |
А3. Какое из этих веществ относится к ионофорам?
| 1) HCl | 2) NaCl | 3) NH4OH | 4) H2SO4 |
А4. Какова область применимости первого приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А5. Какое из допущений, сделанных Дебаем и Гюккелем при выводе первого приближения их теории электролитов, не ограничивает область применения теории областью разбавленных растворов?
| 1) ионы отждествляются с материальными точками | 2) диэлектрическая проницаемость раствора принимается равной проницаемости растворителя | 3) электролит считается полностью диссоциированным | 4) между ионами действуют только электростатические силы |
А6. Свойством растворителя, обусловливающим увеличение подвижности ионов с ростом температуры, является:
| 1) вязкость | 2) диэлектрическая проницаемость | 3) температура кипения | 4) плотность |
А7. Предельная подвижность иона – это:
| 1) скорость движения иона, выраженная в электростатических единицах | 2) скорость движения иона при напряженности поля, равной 1 | 3) скорость движения иона при бесконечном разведении | 4) скорость движения иона в насыщенном растворе |
А8. Какой из этих ионов будет обладать наибольшей подвижностью в водных растворах?
| 1) Li+ | 2) Na+ | 3) K+ | 4) Cs+ |
А9. Какое из этих четырех словосочетаний не является синонимом трем остальным?
| 1) частотный эффект | 2) эффект Вина | 3) дисперсия электропроводности | 4) эффект Дебая-Фалькенгагена |
А10. Какая пара соединений не может образовать буферный раствор?
| 1) СН3СООН + СН3СООNa | 2) NH4OH + NH4Cl | 3) СН3СООН + NH4OH | 4) NaH2PO4 + Na2HPO4 |
А11. Какая из этих констант диссоциации не зависит от концентрации растворенного вещества и от присутствия посторонних ионов в растворе:
| 1) классическая | 2) термодинамическая | 3) концентрационная |
Задание В
В1. Дайте одно или несколько определений электрохимической реакции.
В2. Приведите математическую запись второго закона Фарадея и сформулируйте этот закон.
В3. Что такое ионная атмосфера? Существует ли она в слабых электролитах?
В4. Что такое удельная электропроводность, в каких единицах она измеряется?
В5. Напишите выражение, связывающее мольную активность электролита и среднюю ионную активность электролита.
В6. Напишите выражение третьего приближения теории сильных электролитов Дебая и Гюккеля. Какие величины в нем являются эмпирическими?
В7. Какие водные растворы мы называем щелочными?
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Наиболее важная часть электрохимической системы – это:
| 1) электролит | 2) электроды | 3) внешняя цепь |
А2. Какое из этих веществ не относится к ионогенам?
| 1) Na2SO4 | 2) HBr | 3) NH4OH | 4) H2SO4 |
А3. Теплота гидратации какого из этих ионов будет иметь наибольшую величину?
| 1) J– | 2) Br– | 3) Cl– | 4) F– |
А4. Электролит на основе какого из этих растворителей практически невозможно реализовать?
| 1) этанол | 2) вода | 3) этановая кислота | 4) гексан |
А5. Какова область применимости второго приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А6. Какое приближение теории сильных электролитов Дебая и Гюккеля не содержит эмпирических постоянных?
| 1) первое | 2) второе | 3) третье |
А7. В каких единицах измеряется эквивалентная электропроводность?
| 1) см2 /(с×В) | 2) см2 /(Ом×г-экв) | 3) см/с | 4) Ом-1×см-1 |
А8. Какой из этих параметров не влияет на число переноса иона:
| 1) концентрация | 2) температура | 3) напряженность поля | 4) растворитель |
А9. Эффект торможения, связанный с наличием асимметрии ионной атмосферы в процессе движения иона, называется:
| 1) эффектом релаксации | 2) эффектом Вина | 3) электрофоретическим эффектом | 4) эффектом Дебая-Фалькенгагена |
А10. Если к раствору малорастворимой соли добавить хорошо растворимое соединение, имеющее общий ион с малорастворимой солью, то растворимость малорастворимой соли:
| 1) уменьшится | 2) не изменится | 3) увеличится |
А11. Через какие величины должна быть выражена константа диссоциации, чтобы она не зависела от концентрации растворенного вещества и от присутствия посторонних ионов в растворе?
| 1) молярность с | 2) моляльность m | 3) активность а | 4) мольные доли N |
Задание В
В1. Какую электрохимическую систему мы называем электролизером?
В2. Напишите закон разведения Оствальда.
В3. Что такое первичная и вторичная сольватная оболочка иона?
В4. Что такое предельная подвижность ионов, в каких единицах она измеряется?
В5. Напишите выражение, связывающее удельную и эквивалентную электропроводность.
В6. Приведите математическую запись эмпирического закона ионной силы Льюиса-Рендалла и сформулируйте этот закон.
В7. Как называется механизм электропроводности ионов водорода и гидроксила в протонных средах?
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. От какого из этих параметров не зависит скорость химической реакции?
| 1) давление | 2) температура | 3) потенциал | 4) концентрация реагирующих веществ |
А2. Какое из этих веществ относится к ионогенам?
| 1) Na2SO4 | 2) NaJ | 3) HJ | 4) NaOH |
А3. Электролит на основе какого из этих растворителей можно легко реализовать?
| 1) бензол | 2) ксилол | 3) этанол | 4) гексан |
А4. Какова область применимости третьего приближения теории Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 – 2,0 | 4) m £ 10 |
А5. Какое из допущений, сделанных Дебаем и Гюккелем при выводе 1-го приближения их теории сильных электролитов, не ограничивает область применимости теории?
| 1) ионы отождествляются с материальными точками, и их размерами можно пренебречь | 2) диэлектрическая проницаемость раствора принимается равной проницаемости растворителя | 3)электролит считается полностью диссоциированным (a = 1) | 4) взаимодействие между ионами исчерпывается кулоновскими силами |
А6. В каких единицах измеряется удельная электропроводность?
| 1) см2 /(с×В) | 2) см2 /(Ом×г-экв) | 3) см/с | 4) Ом-1×см-1 |
А7. Какой из этих параметров не влияет на подвижность иона в растворе:
| 1) напряженность поля | 2) концентрация | 3) число переноса иона | 4) температура |
А8. Самым подвижным ионом в водных растворах является ион:
| 1) ОН– | 2) Li+ | 3) Cs+ | 4) Н3О+ |
А9. Зависимость какой из этих величин от температуры не проходит через максимум?
| 1) удельная электропроводность k | 2) степень диссоциации a | 3) константа диссоциации слабого электролита КС | 4) электропроводность при конечной концентрации l |
А10. Эффект увеличения электропроводности электролита до предельного значения при повышении напряженности электрического поля до величин порядка 200000 В/см, называется:
| 1) эффектом релаксации | 2) эффектом Вина | 3) электрофоретическим эффектом | 4) эффектом Дебая-Фалькенгагена |
А11. Какая из этих солей не будет подвергаться гидролизу в водном растворе?
| 1) NaCN | 2) NaClO4 | 3) NH4ClO4 | CH3COONH4 |
Задание В
В1. Какую электрохимическую систему мы называем гальваническим элементом?
В2. Что такое проводники первого рода? Приведите примеры. Каков знак температурного коэффициента их электропроводности?
В3. Чему равно число Фарадея, в каких единицах измеряется?
В4. Что такое подвижность ионов, в каких единицах она измеряется?
В5. Напишите выражение, определяющее ионную силу раствора.
В6. Напишите выражение первого приближения теории сильных электролитов Дебая и Гюккеля.
В7. Какие водные растворы мы называем нейтральными?
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. От какого из этих параметров зависит скорость электрохимической реакции, но не зависит скорость химической реакции?
| 1) давление | 2) температура | 3) потенциал | 4) концентрация реагирующих веществ |
А2. Проводники первого рода обладают следующим видом проводимости:
| 1) ионная | 2) смешанная | 3) электронная | 4) униполярная |
А3. Законы электролиза (законы Фарадея) для проводников второго рода
| 1) всегда строго выполняются | 2) выполняются не всегда |
А4. С ростом концентрации электролита диэлектрическая проницаемость раствора
| 1) увеличивается | 2) уменьшается | 3) не изменяется |
А5. Какова область применимости предельного закона Дебая и Гюккеля?
| 1) m £ 0,01 | 2) m £ 0,1 | 3) m £ 1,0 | 4) m £ 10 |
А6. Какое из допущений, сделанных Дебаем и Гюккелем при выводе первого приближения их теории электролитов, ограничивает область применения теории областью разбавленных растворов?
| 1) распределение ионов вокруг центрального иона подчиняется распределению Больцмана | 2) между ионами действуют только электростатические силы | 3) электролит считается полностью диссоциированным |
А 7 . Ионная электропроводность – это:
| 1) скорость движения иона, выраженная в электростатических единицах | 2) скорость движения иона при напряженности поля, равной 1 | 3) скорость движения иона при бесконечном разведении | 4) скорость движения иона в насыщенном растворе |
А8. Какой из этих электролитов (при прочих равных условиях) обладает наименьшей эквивалентной электропроводностью (растворитель – вода)?
| 1) K2SO4 | 2) Na2SO4 | 3) KOH | 4) H2SO4 |
А9. Зависимость какой из этих величин от температуры может проходить через максимум?
| 1) удельная электропроводность k | 2) предельная подвижность ионов lо+ , lо– | 3) эквивалентная электропроводность l¥ | 4) электропроводность при конечной концентрации l |
А10. Эффект увеличения электропроводности электролита при повышении частоты переменного тока называется:
| 1) эффектом релаксации | 2) эффектом Вина | 3) электрофоретическим эффектом | 4) эффектом Дебая-Фалькенгагена |
А11. Степень гидролиза какой из солей практически не зависит от разбавления (от концентрации соли)?
| 1) соль образована сильной кислотой и слабым основанием | 2) соль образована сильным основанием и слабой кислотой | 3) соль образована слабой кислотой и слабым основанием |
Задание В
В1. Что такое проводники второго рода? Приведите примеры. Каков знак температурного коэффициента их электропроводности?
В2. Приведите математическую запись объединенного закона Фарадея и сформулируйте этот закон.
В3. Что такое абсолютная подвижность ионов, в каких единицах она измеряется?
В4. Напишите два закона Кольрауша для эквивалентной электропроводности.
В5. Что такое число переноса иона?
В6. Напишите выражение второго приближения теории сильных электролитов Дебая и Гюккеля. Какая величина в нем является эмпирической постоянной?
В7. Какие растворы мы называем буферными?
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А1. От какого из этих параметров не зависит стандартная ЭДС обратимого гальванического элемента:
| 1) природа электродов | 2) концентрация электролита | 3) температура | 4) давление |
А2. Какой из этих электрохимических элементов является необратимым?
| 1) элемент Якоби-Даниэля | 2) свинцовый кислотный аккумулятор | 3) элемент Вольта | 4) водородно-кислородный топливный элемент |
А3. Какой из этих электролитов можно использовать в качестве солевого мостика?
| 1) NaCl | 2) KCl | 3) KNO3 | 4) K2SO4 |
А4. Металлоксидные электроды относятся к электродам:
| 1) первого рода | 2) второго рода | 3) амальгамным | 4) простым редокси |
А5. Потенциал каких электродов зависит от активности частиц только одного сорта?
| 1) газовых | 2) первого рода | 3) второго рода | 4) редокси-электродов |
А6. Какой из этих электродов может быть обратим по отношению к катионам щелочного металла?
| 1) первого рода | 2) второго рода | 3) водородный | 4) амальгамный |
А7. Какой из этих электродов предпочтительнее использовать в качестве электрода сравнения, если надо измерить потенциал калиевого амальгамного электрода с K2SO4 в качестве электролита?
| 1) хлорсеребряный | 2) каломельный | 3) ртутно-сульфатный | 4) ртутнооксидный |
А8. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) физические | 2) концентрационные первого рода | 3) концентрационные второго рода | 4) простые химические |
А9. Электрохимические цепи, в которых электроды отличаются лишь активностями участников электродной реакции, называются
| 1) физическими | 2) концентрационными | 3) химическими | 4) сдвоенными |
А10. Элемент Якоби-Даниэля относится к цепям:
| 1) концентрационным первого рода | 2) концентрационным второго рода | 3) простым химическим | 4) сложным химическим |
А11. Какой из этих аккумуляторов имеет наибольшее значение ЭДС:
| 1) свинцовый кислотный | 2) кадмиево-никелевый | 3) железо-никелевый | 4) серебряно-цинковый |
Задание В
В1. Какое устройство называется гальваническим элементом?
В2. Какую величину называют стандартным электродным потенциалом, от каких параметров она зависит?
В3. Какие электроды можно использовать как индикаторные при определении рН раствора?
В4. Приведите схематическую запись металлоидного электрода 1-го рода, напишите выражение для его потенциала, приведите примеры.
В5. Приведите схематическую запись простого редокси-электрода и напишите выражение для его потенциала.
В6. Приведите схематическую запись свинцового кислотного аккумулятора.
В7. Какие растворы получили название нулевых растворов?
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А1. Какой процесс протекает на положительном полюсе гальванического элемента?
| 1) окисление | 2) восстановление |
А2. Какой из этих электролитов нельзя использовать в качестве солевого мостика?
| 1) NaCl | 2) KCl | 3) NH4NO3 |
А3. От какого из этих параметров не зависит стандартный электродный потенциал:
| 1) природа электрода | 2) концентрация электролита | 3) температура | 4) давление |
А4. Какой из этих электродов нельзя реализовать как электрод первого рода:
| 1) цинковый | 2) серебряный | 3) никелевый | 4) калиевый |
А5. Какие электроды обратимы и по отношению к катионам электродного металла, и по отношению к анионам раствора?
| 1) первого рода | 2) второго рода | 3) газовые | 4) редокси-электроды |
А6. Какой электрод нельзя использовать как индикаторный при определении рН раствора?
| 1) первого рода | 2) стеклянный | 3) металлоксидный | 4) водородный |
А7. Какой из этих электродов предпочтительнее использовать в качестве электрода сравнения, если надо измерить потенциал натриевого амальгамного электрода с NaCl в качестве электролита?
| 1) хлорсеребряный | 2) водородный | 3) ртутно-сульфатный | 4) ртутнооксидный |
А8. Какие их данных электрохимических цепей являются цепями без переноса:
| 1) простые химические | 2) сложные химические | 3) концентрационные второго рода |
А9. ЭДС каких цепей имеет максимальное значение:
| 1) физических | 2) концентрационных | 3) химических |
А10. Простые газовые цепи являются:
| 1) физическими | 2) концентрационными первого рода | 3) концентрационными второго рода | 4) химическими |
А11. В каком из этих аккумуляторов электролит не участвует в реакциях заряда и разряда?
| 1) свинцовый кислотный | 2) кадмиево-никелевый | 3) железо-никелевый | 4) серебряно-цинковый |
Задание В
В1. Чем гальванический элемент отличается от аккумулятора?
В2. Какую величину называют стандартной ЭДС гальванического элемента, от каких параметров она зависит?
В3. Как называется применяемый в настоящее время метод измерения ЭДС?
В4. Приведите схематическую запись сложного редокси-электрода , напишите выражение для его потенциала, приведите пример.
В5. Приведите схематическую запись газового водородного электрода, напишите выражение для его потенциала.
В6. Приведите схематическую запись каломельного электрода.
В7. Что такое потенциал нулевого заряда?
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А1. Гальванический элемент, у которого к конечным электродам присоединены проводники первого рода из одного и того же материала, называется:
| 1) обратимым | 2) необратимым | 3) правильно разомкнутым | 4) электролизером |
А2. Положительный полюс гальванического элемента является:
| 1) катодом | 2) анодом |
А3. Потенциал какого из этих электродов был принят за нуль в водородной шкале потенциалов Нернста?
| 1) Н+ (а = 1) ïН2 (р = 1) ïPt | 2) Н+ (с = 1) ïН2 (р = 1) ïPt | 3) Н+ (а = 1) ïН2 (f = 1) ïPt |
А4. При повышении давления соответствующего газа в отрицательную сторону сдвигается потенциал электрода:
| 1) водородного | 2) кислородного | 3) хлорного | 4) фторного |
А5. Какой электрод нельзя использовать как индикаторный при определении рН раствора?
| 1) газовый водородный | 2) газовый кислородный | 3) хингидронный | 4) металлоксидный второго рода |
А6. Правило Лютера связывает между собой потенциалы электродов:
| 1) первого и второго рода | 2) первого рода и простых редокси | 3) простых и сложных редокси-электродов | 4) первого рода и амальгамных |
А7. Какие электроды используются в лабораторной практике в качестве электродов сравнения?
| 1) первого рода | 2) второго рода | 3) амальгамные | 4) редокси-электроды |
А8. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) сдвоенные химические | 2) простые химические | 3) сложные химические | 4) физические |
А9. Электрохимические цепи, в которых источником электрической энергии служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние, называются
| 1) физическими | 2) концентрационными | 3) химическими | 4) сдвоенными |
А10. Амальгамные цепи являются:
| 1) физическими | 2) концентрационными первого рода | 3) концентрационными второго рода | 4) химическими |
А11. Какой из этих аккумуляторов имеет наиболее компактные размеры?
| 1) свинцовый кислотный | 2) кадмиево-никелевый | 3) железо-никелевый | 4) серебряно-цинковый |
Задание В
В1. Из каких частей состоит простейший электрохимический элемент?
В2. От каких параметров зависит ЭДС обратимого электрохимического элемента?
В3. Какими способами можно устранить диффузионный потенциал на границе двух жидких растворов?
В4. Какой принцип лежит в основе классификации электродов?
В5. Приведите схематическую запись электрода 2-го рода и напишите выражение для его потенциала.
В6. Приведите схематическую запись амальгамного электрода, напишите выражение для его потенциала.
В7. Приведите схематическую запись элемента Якоби-Даниэля и напишите выражение для его ЭДС.
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А1. Гальванический элемент, в котором при прохождении тока в разных направлениях на поверхности электродов протекает одна и та же реакция, но в разных направлениях, называется:
| 1) обратимым | 2) необратимым | 3) правильно разомкнутым | 4) электролизером |
А2. Потенциал какого из этих электродов был принят за нуль в условной водородной шкале потенциалов?
| 1) Н+ (а = 1) ïН2 (р = 1) ïPt | 2) Н+ (с = 1) ïН2 (р = 1) ïPt | 3) Н+ (а = 1) ïН2 (f = 1) ïPt |
А3. Кадмиевый амальгамный электрод используется для изготовления:
| 1) элемента Даниэля-Якоби | 2) элемента Вестона | 3) элемента Вольта | 4) свинцового кислотного аккумулятора |
А4. Какие электроды обратимы по отношению к частицам трех сортов: анионам раствора, катионам гидроксония и анионам гидроксила?
| 1) металлоксидные второго рода | 2) первого рода | 3) амальгамные | 4) простые редокси-электроды |
А5. Потенциал какого из этих электродов не зависит от рН раствора?
| 1) первого рода | 2) газового водородного | 3) сложного редокси-электрода | 4) металлоксидного второго рода |
А6. Какой электрод можно использовать и как электрод сравнения, и как индикаторный электрод при определении рН раствора?
| 1) хлорсеребряный | 2) хингидронный | 3) водородный | 4) амальгамный |
А7. Какой из этих электродов предпочтительнее использовать в качестве электрода сравнения, если надо измерить потенциал газового кислородного электрода с КОН в качестве электролита?
| 1) хлорсеребряный | 2) водородный | 3) ртутно-сульфатный | 4) каломельный |
А8. Какие их данных электрохимических цепей являются цепями без переноса:
| 1) физические | 2) сложные химические | 3) концентрационные второго рода |
А9. ЭДС каких цепей имеет минимальное значение:
| 1) физических | 2) концентрационных | 3) химических |
А10. Измерение ЭДС каких цепей позволяет находить стандартные потенциалы электродов и коэффициенты активности электролитов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А11. Какие электрохимические системы можно использовать в качестве аккумуляторов?
| 1) необратимые | 2) обратимые |
Задание В
В1. Что является важнейшей количественной характеристикой гальванического элемента?
В2. Что такое диффузионный потенциал, где он возникает, по какой причине?
В3. Какие принципы лежат в основе классификации электрохимических цепей?
В4. Приведите схематическую газового кислородного электрода, напишите выражение для его потенциала.
В5. Приведите схематическую запись металлического электрода первого рода и напишите выражение для его потенциала.
В6. Приведите схематическую запись элемента Вестона.
В7. Можно ли экспериментально измерить абсолютное значение потенциала какого-либо отдельно взятого электрода?
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А1. Какой из этих параметров оказывает наибольшее влияние на величину электродного потенциала:
| 1) природа электрода | 2) концентрация электролита | 3) температура | 4) давление |
А2. Диффузионный потенциал на границе двух растворов является:
| 1) равновесным | 2) неравновесным |
А3. Какой из этих электродов можно назвать стандартным водородным электродом?
| 1) Н+ (а = 1) ïН2 (р = 1) ïPt | 2) Н+ (с = 1) ïН2 (р = 1) ïPt | 3) Н+ (а = 1) ïН2 (f = 1) ïPt |
А4. В каком из этих электродов металл электрода контактирует со своим труднорастворимым соединением:
| 1) первого рода | 2) второго рода | 3) газовом | 4) амальгамном |
А5. Какой из этих электродов можно использовать как индикаторный при определении рН раствора?
| 1) первого рода | 2) амальгамный | 3) каломельный | 4) хингидронный |
А6. В каком из этих электродов в качестве металла электрода не используют платину?
| 1) первого рода | 2) амальгамный | 3) газовый | 4) редокси-электрод |
А7. Какие их данных электрохимических цепей являются цепями с переносом:
| 1) концентрационные первого рода | 2) концентрационные второго рода | 3) простые химические | 4) сдвоенные химические |
А8. ЭДС каких цепей зависит от величин стандартных электродных потенциалов образующих ее электродов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А9. Измерение ЭДС каких цепей используют для нахождения чисел переноса ионов:
| 1) физических | 2) концентрационных первого рода | 3) концентрационных второго рода | 4) химических |
А10. ЭДС каких цепей нельзя теоретически рассчитать (имеется ввиду точный расчет)?
| 1) физических гравитационных | 2) концентрационных первого рода | 3) простых химических | 4) сложных химических |
А11. Какие электрохимические цепи можно использовать в качестве аккумуляторов?
| 1) физические | 2) концентрационные первого рода | 3) концентрационные второго рода | 4) химические |
Задание В
В1. Какой электрохимический элемент называется правильно разомкнутым?
В2. Какая величина называется электродным потенциалом?
В3. Как связаны межу собой стандартная ЭДС гальванического элемента и константа равновесия протекающей в нем реакции? (Написать уравнение).
В4. Приведите схематическую запись водородно-кислородного топливного элемента.
В5. Приведите схематическую запись хлорсеребряного электрода, напишите выражение для его потенциала. Каково применение этого электрода?
В6. Можно ли экспериментально измерить скачок потенциала на границе электрод-раствор?
В7. Какие электроды называют биполярными?
Вариант 1
Задание А (выбрать только один ответ из предложенных):
А11. Замедленность стадии построения (разрушения) кристаллической решетки является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А12. При электролизе водных растворов солей щелочных металлов (электроды – платина) на катоде происходит:
| 1) выделение щелочного металла | 2) одновременное выделение металла и водорода | 3) выделение водорода из воды | 4) выделение водорода из ионов гидроксония |
А13. Металлы с высоким значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А14. Какая из этих стадий процесса катодного выделения водорода из кислых растворов протекает без торможения (не является лимитирующей):
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В
В7. Запишите уравнение электрохимической реакции выделения кислорода на аноде из щелочных растворов.
Вариант 2
Задание А (выбрать только один ответ из предложенных):
А11. Замедленное протекание стадии разряда-ионизации (стадии перехода электрона через границу раздела электрод-электролит) является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А12. При электролизе водных растворов щелочей (электроды – платина) на катоде происходит:
| 1) выделение щелочного металла | 2) одновременное выделение металла и водорода | 3) выделение водорода из воды | 4) выделение водорода из ионов гидроксония |
А13. Металлы со средним значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А14. Какая из этих стадий процесса катодного выделения водорода из кислых растворов может протекать по нескольким параллельным путям:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В
В7. Запишите уравнение электрохимической реакции выделения кислорода на аноде из кислых растворов.
Вариант 3
Задание А (выбрать только один ответ из предложенных):
А11. Замедленное протекание химической реакции, предшествующей акту разряда (или следующей за ним), является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А12. При электролизе водных растворов кислородсодержащих солей щелочных металлов (электроды – платина) на аноде происходит:
| 1) выделение щелочного металла | 2) окисление анионов соли | 3) выделение кислорода из воды | 4) выделение кислорода из ионов гидроксила |
А13. Металлы с низким значением перенапряжения выделения водорода – это:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А14. Какой из этих факторов способствует снижению перенапряжения выделения водорода из кислых растворов:
| 1) повышение плотности тока | 2) повышение рН раствора | 3) добавление в раствор индифферентной соли | 4) повышение температуры |
Задание В
В7. Запишите уравнение электрохимической реакции выделения водорода на катоде из кислых растворов.
Вариант 4
Задание А (выбрать только один ответ из предложенных):
А11. Замедленность стадии доставки (или отвода) участников электрохимической реакции к электроду является причиной:
| 1) концентрационной поляризации | 2) химического перенапряжения | 3) электрохимического перенапряжения | 4) фазового перенапряжения |
А12. При электролизе водных растворов солей таких металлов, как Fe, Co, Ni, Cr, Zn, Pb, Sn, на катоде происходит:
| 1) выделение водорода | 2) выделение металла | 3) одновременное выделение водорода и металла | 4) разряд анионов соли |
А13. Наибольшее значение постоянной а уравнения Тафеля для процесса катодного выделения водорода из кислых растворов имеют металлы:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А14. Какая из этих стадий процесса катодного выделения водорода на платине из растворов кислот является лимитирующей:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В
В7. Запишите уравнение Тафеля.
Вариант 5
Задание А (выбрать только один ответ из предложенных):
А11. Какой из этих четырех терминов не является синонимом трем остальным?
| 1) электрохимическое перенапряжение | 2) перенапряжение транспортировки | 3) перенапряжение замедленного разряда | 4) перенапряжение электронного перехода |
А12. При электролизе концентрированного водного раствора соляной кислоты (электроды – платина) на аноде происходит:
| 1) выделение водорода из ионов гидроксония | 2) выделение кислорода из воды | 3) выделение газообразного хлора | 4) выделение кислорода из ионов гидроксила |
А13. Наименьшее значение постоянной а уравнения Тафеля для процесса катодного выделения водорода из кислых растворов имеют металлы:
| 1) Pb, Tl, Hg, Sn | 2) Pt, Pd, Au | 3) Cu, Fe, Co, Ni |
А14. Какая из этих стадий процесса катодного выделения водорода на ртути из растворов кислот является лимитирующей:
| 1) диффузионная стадия | 2) стадия разряда | 3) стадия удаления адсорбированного атомарного водорода | 4) стадия удаления молекулярного водорода в газовую фазу |
Задание В
В7. Запишите уравнение электрохимической реакции выделения водорода на катоде из нейтральных и щелочных растворов.
| Вариант 1 1. Записать дифференциальные уравнения скорости необратимых реакций первого и нулевого порядков. 2. Записать выражение для константы скорости необратимой реакции n-го порядка. 3. Записать выражение для времени полураспада необратимой реакции второго порядка. 4. Графический метод определения порядка реакций: в каких координатах наблюдается прямолинейная зависимость для необратимой реакции второго порядка (для случая a ¹ b), каким уравнением описывается, как по тангенсу угла наклона найти константу скорости реакции. 5. Основной постулат химической кинетики: формулировка, математическое выражение, характеристика входящих в него величин. | Вариант 2 1. Записать дифференциальные уравнения скорости необратимой реакции второго порядка (для случаев a = b и a ¹ b ). 2. Записать выражения для константы скорости необратимой реакции первого порядка и обратимой реакции первого порядка (с указанием размерности константы). 3. Записать выражение для времени полураспада необратимой реакции n-го порядка. 4. Графический метод определения порядка реакций: в каких координатах наблюдается прямолинейная зависимость для необратимой реакции первого порядка, каким уравнением описывается, как по тангенсу угла наклона найти константу скорости реакции. 5. Скорость химической реакции: определение, единицы измерения, скорость реакции средняя и истинная. |
| Вариант 3 1. Записать дифференциальные уравнения скорости необратимой реакции n-го порядка и двух параллельных реакций первого порядка. 2. Записать выражения для константы скорости обратимой реакции второго порядка и двух параллельных реакций второго порядка (с указанием размерности константы). 3. Записать выражение для времени полураспада необратимой реакции первого порядка. 4. Графический метод определения порядка реакций: в каких координатах наблюдается прямолинейная зависимость для необратимой реакции второго порядка (для случая a = b ), каким уравнением описывается, как по тангенсу угла наклона найти константу скорости реакции. 5. Кинетическая классификация реакций: по каким признакам классифицируют реакции, на какие типы. | Вариант 4 1. Записать дифференциальные уравнения скорости обратимых реакций первого и второго порядка. 2. Записать выражения для константы скорости необратимой реакции второго порядка (для случаев a = b и a ¹ b ; указать размерность константы). 3. Записать выражение для времени полураспада необратимой реакции нулевого порядка. 4. Графический метод определения порядка реакций: в каких координатах наблюдается прямолинейная зависимость для необратимой реакции третьего порядка, каким уравнением описывается, как по тангенсу угла наклона найти константу скорости реакции. 5. Зависимость скорости реакции от температуры: энергия активации (определение, единицы измерения), уравнение Аррениуса в дифференциальной и интегральной форме (неопределенный и определенный интеграл), графическое нахождение энергии активации. |
| Вариант 1 1. Теория электролитической диссоциации Аррениуса: основные положения, область применимости, причины недостатков теории. 2. Записать выражение предельного закона теории Дебая и Гюккеля и указать область его применимости. 3. Удельная электропроводность: определение, единицы измерения, зависимость от концентрации и температуры, связь с эквивалентной электропроводностью. 4. Зависимость ионной электропроводности (подвижности) от концентрации. Эффект Дебая-Фалькенгагена. | Вариант 2 1. Закон разведения Оствальда. Зависимость степени диссоциации и константы диссоциации от концентрации и температуры. 2. Теория электролитов Дебая и Гюккеля: основные положения теории. Ионная атмосфера. 3. Абсолютная подвижность ионов, подвижность ионов (ионная электропроводность), предельная подвижность ионов: обозначение, единицы измерения, физический смысл. Закон Кольрауша. Зависимость подвижности от температуры. 4. Зависимость ионной электропроводности (подвижности) от концентрации. Электрофоретический эффект. |
| Вариант 3 1. Активность и коэффициент активности электролитов: записать уравнение, связывающее общую активность электролита и его среднеионную активность, и уравнение, связывающее среднеионную активность с концентрацией (моляльностью) электролита. Чем определяется величина коэффициента L, входящего в последнее уравнение? 2. Записать выражение второго приближения теории Дебая и Гюккеля и указать область его применимости. Какая величина, входящая в это уравнение, является эмпирической постоянной, каков ее смысл? 3. Эквивалентная электропроводность: определение, единицы измерения, зависимость от концентрации и разведения, связь с удельной электропроводностью. 4. Зависимость ионной электропроводности (подвижности) от концентрации. Эффект Вина. | Вариант 4 1. Ионная сила раствора. Эмпирический закон ионной силы Льюиса-Рендалла, область его применимости. 2. Записать выражение третьего приближения теории Дебая и Гюккеля и указать область его применимости. Какие величины, входящие в это уравнение, являются эмпирическими постоянными, каков их физический смысл? 3. Зависимость подвижности ионов от их природы. Формула Стокса. Аномальная подвижность ионов гидроксония и гидроксила (механизм). 4. Зависимость ионной электропроводности (подвижности) от концентрации. Релаксационный эффект. |
| ФИО ________________________________ Вариант ____ | ФИО ________________________________ Вариант ____ |
| 1. | 1. |
| 2. | 2. |
| 3. | 3. |
| 4. | 4. |
Дата добавления: 2021-12-10; просмотров: 168; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
