Пространственная изомерия алкенов
План дистанционного обучения по химии 10 класс
Г.
Тема урока: Алкены: геометрическая изомерия, методы синтеза, свойства и применение.
Цель урока: рассмотреть электронное и пространственное строение алкенов, гомологический ряд алкенов, на примере этилена показать новый вид изомерии, формировать навыки учащихся в составлении формул алкенов, умении называть вещества, изучить области применения ацетилена.
Дорогие ребята!
На сегодняшнем уроке мы продолжим изучение органических веществ. Перед нами стоит задача – изучить гомологический ряд «Алкены». Физические и химические свойства, получение и применение этих соединений.
I Этап. Давайте с вами вспомним и запишем в тетрадях ответы на следующие вопросы:
Тестирование по теме « Алканы»
1. Первый представитель ряда алканов называется:
а) бутан; б) пропан; в) октан; г) метан.
2. Общая формула алканов:
а) Сn H2 n ; б) Сn H2 n +2 ; в) Сn H2 n –2 ; г) Сn Hn .
3. Атомы углерода в алканах находятся в состоянии:
а) sр -гибридизации; б) pр -гибридизации; в) sр 3 -гибридизации;
4. Валентный угол в алканах равен:
а) 109°28'; б) 180°; в) 90°; г) 270°.
5. Молекула метана имеет строение:
а) октаэдрическое; б) плоскостное;
в) тетраэдрическое; г) гексагональное.
6. Связи в молекуле алканов:
а) двойные; б) тройные;
в) полуторные; г) одинарные.
|
|
|
7. Вещество СН 3 –СН– СH–СН 3 называется:
ǀ ǀ
CH 3 CH 3
а) 2,3,4-триметилоктан; б) н -гексан;
в) 2,3-диметилбутан; г) 3,4-диметилпентан.
8 . Для алканов характерна изомерия:
а) положения кратной связи; б) углеродного скелета;
в) геометрическая; г) положения функциональной группы
9. Реакция 2СН3I + 2Na = 2NaI + C2Н6 носит имя:
а) Н.Н.Зинина; б) А.М.Бутлерова;
в) Ш.А.Вюрца; г) Д.И.Менделеева.
10. Взаимодействие метана с хлором – это реакция:
а) разложения; б) соединения;
в) обмена; г) замещения.
Критерии оценивания: каждый правильный ответ – 0.5 балла.
II Изучение нового материала
Изучая классификацию углеводородов, мы выяснили, что кроме предельных углеводородов, существуют непредельные. Сегодня мы рассмотрим представителей первого непредельного ряда углеводородов - АЛКЕНЫ
Строение алкенов
Запишите определение понятия и основные моменты нового материала в виде конспекта в тетради)
Этиленовые углеводороды (алкены) – это углеводороды, в молекулах которых атомы углерода связаны между собой одной двойной связью.
|
|
|
Общая формула алкенов CnH2n.
Первый представитель гомологического ряда алкенов – этилен.
Молекулярная формула – C2H4.
Структурная и электронная формулы этилена имеют вид:
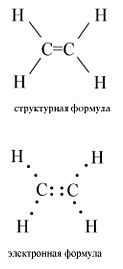
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о.
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
 Рис. 1. Строение этилена
Рис. 1. Строение этилена
 Рис. 2. Модель молекулы пропилена
Рис. 2. Модель молекулы пропилена
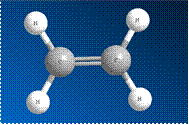 Рис. 2. Модель молекулы этилена
Рис. 2. Модель молекулы этилена
Валентный угол - 120°
Длина (- С = С -) связи – 0,134 нм
Номенклатура и изомерия
|
|
|
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.), общее название углеводородов данного ряда алкены, но за этиленом и пропиленом сохранились старые названия.
Задание!
Запишите в тетради гомологический ряд алкенов: название и формулу.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
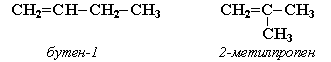
2. Изомерия положения двойной связи (начиная с С4Н8):

3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:

Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис-транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи.
|
|
|
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс-изомере.
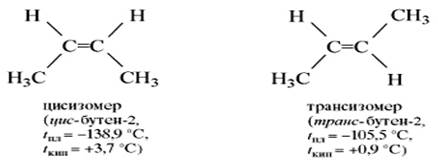 ,
,
Алгоритм составления названий изомеров алкенов
1.Номеруем самую длинную цепь с того конца, где ближе двойная связь
2.Называем радикалы, начиная с простейшего, указываем их число и местоположение.
3.Называем самую длинную цепь.
4.Указываем месторасположение двойной связи цифрой в конце названия через дефис.
Например:
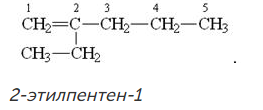
Задание! Написать в тетради следующие структурные формулы алкенов и их названия.

Физические свойства
Этилен, пропилен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества. Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом. Этилен образуется в фруктах, регулируя процесс их созревания. К классу алкенов принадлежат феромоны некоторых насекомых.
Химические свойства
Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С = С, при которых протекает разрыв пи-связи в молекуле алкена.
Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
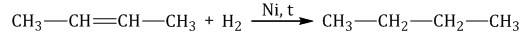
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |


Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
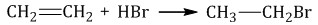
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |

Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |

Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |

Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |


Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Горение алкенов

Этилен горит ярким оранжеватым пламенем, в то время как этан — голубым. Это происходит потому, что массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода.
Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
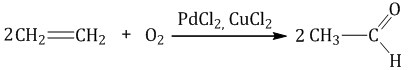
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида (оксида этилена) |

Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).

| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
Получение алкенов
Крекинг алканов
Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен). Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов. Так, крекинг бутана при 600°С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена-2) с соотношением олефинов ≈ 3,5 : 5 : 1,5 соответственно.
CnH2n+2 ---t, (400-700) → CnH2n+2 + CnH2n
алкан алкен
2. Дегидрирование алканов:
CnH2n+2 --- t, kat-Niили (Cr2O3)→ CnH2n +H2
3. Гидрирование алкинов :
CnH2n-2 + H2 --- t, kat-(Pt или Pd, Ni) → CnH2n
Получение в лаборатории
1. Дегидратация* спиртов:
R-CH2-CH2-OH ---t>140°C, H2SO4(конц.)→ R-CH=CH2 + H2O
*Правило А. М. Зайцева:
Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
Применение
Самостоятельная работа обучающихся с учебником стр.53
V Закрепление
1.Выполните тестовые задания на стр. 48, 54
V I Домашнее задание
Проработать § 10, 11, выполнить упр.5,6 – письменно стр.48
Задания выполняем в рабочих тетрадях (на период дистанционного обучения их потребуется 2 шт.). В понедельник 15.11. тетрадь с выполненным заданием необходимо принести в школу.
По возможности: прислать мне на электронную почту: tanya.gaidamaka@yandex.ua или личным сообщением в соц. c ети VK https://vk.com/shpits1991 фото выполненного задания
Дата добавления: 2021-12-10; просмотров: 19; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
