Применение І закона термодинамики к газовым процессам
Теоретический материал
Первый закон термодинамики
Внутреннюю энергию системы можно совершить двумя способами: совершить над системой работу и/или передать системе некоторое количество теплоты. Это утверждение, только выраженное в строгой математической формуле, и получило название первого закона термодинамики. Иногда встречаются определения «первое начало термодинамики».
Изменение внутренней энергии системы равно разности между количеством теплоты, подведенным к системе, и работой, совершенной системой:
ΔU = Q – A
А – работа, совершенная системой,
Q – количество теплоты, переданной системе от внешних тел,
ΔU – это изменение внутренней энергии.
Первое начало термодинамики было сформулировано задолго до того, как в науке укрепилось понятие молекул, т. е. еще не была известна молекулярно-кинетическая теория. Поэтому первый закон термодинамики часто носит название феноменологического, т. е. такого, который относится к тому или иному явлению.
А теперь посмотрим применение темы в технике «Действие внешних сил на поршень с идеальным газом».
Обозначим через  работу, выполняемую самой системой, идеальным газом, против внешних сил. Например, если газ расширяется, двигая поршень в сосуде, то этот газ совершает работу против сил тяжести поршня и против сил атмосферного давления, действующих на поршень с внешней стороны (рис. 6).
работу, выполняемую самой системой, идеальным газом, против внешних сил. Например, если газ расширяется, двигая поршень в сосуде, то этот газ совершает работу против сил тяжести поршня и против сил атмосферного давления, действующих на поршень с внешней стороны (рис. 6).
|
|
|
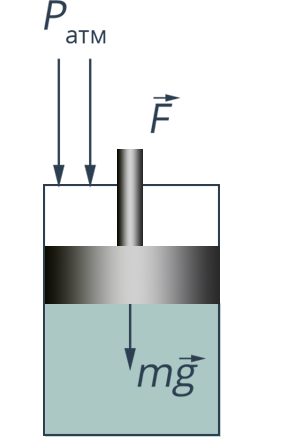 Рис. 6. Действие внешних сил на поршень с идеальным газом
Рис. 6. Действие внешних сил на поршень с идеальным газом
Совершенно очевидно, что согласно третьему закону Ньютона эта работа будет равна работе внешних сил, взятой с обратным знаком:
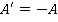
Тогда уравнение для первого закона термодинамики можно переписать в виде:
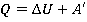
Словесная формулировка этого выражения будет звучать так: сообщенная системе теплота идет на изменение ее внутренней энергии и на совершение системой механической работы против внешних сил.
Вопрос: Можно ли создать такое устройство, которое при передаче ему некоторого количества теплоты превратит это количество теплоты в полезную механическую работу? Ответ известен, такие устройства существуют, и называются они тепловыми двигателями. Фактически, стоит задача – как максимально эффективно превратить количество теплоты, которое мы передаем такому тепловому двигателю, в механическую работу.
|
|
|
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
Опорный конспект
| Первый закон термодинамики |
| Количество теплоты, которое отдано системе, идет на увеличение ее внутренней энергии и совершение работы системой над внешними телами |
| Q = А - ΔU |
| Изменение внутренней энергии системы во время ее перехода из одного состояния в другое равно сумме работы внешних сил над системой и количеству теплоты, отданному системе |
| ΔU = А′ - Q |
Применение І закона термодинамики к газовым процессам
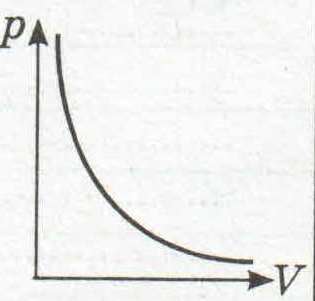
| Название процесса | Закон | Количес-тво тепло- ты | Работа газа | Изменение внутренней энергии | І закон термо-динамики | График | ||
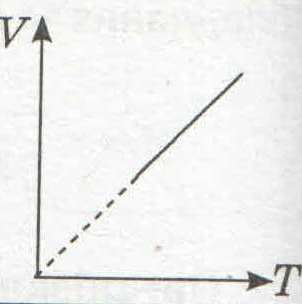
| Изотерми- ческий |
РV = const | > 0 | > 0 | 0 |
Q = A |
| ||
| < 0 | < 0 | 0 | ||||||
| Изохорный |
| > 0 | 0 | > 0 |
Q =ΔU
| | ||
| < 0 | 0 | < 0 | ||||||
| Изобарный |
| > 0 | > 0 | > 0 |
Q = A + ΔU | | ||
| < 0 | < 0 | < 0 | ||||||
| Адиабатный |
РVγ = const | 0 | > 0 | < 0 |
A ′ = ΔU |
| ||
| 0 | < 0 | > 0 |
Второй закон термодинамики указывает направление возможных энергетических превращений. Немецкий ученый Р. Клаузиус (1822-1888) сформулировал этот закон так: невозможно передать энергию (теплоту) от менее нагретой системы к более нагретой без одновременного изменения этих двух систем или окружающих тел.
и отправьте мне в контакте https://vk.com/id300455001
Дата добавления: 2021-12-10; просмотров: 34; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 = const
= const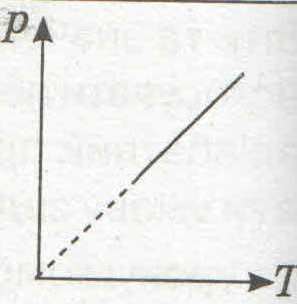
 = const
= const