Модель атома водорода по Бору.
ФИЗИКА, ГРУППА № 36, 16.11.2021 г.
Занятие № 35
Тема: Квантовые постулаты Бора. Модель атома водорода по Бору.
Цель : изучить квантовые постулаты Бора , рассмотреть модель атома водорода по Бору.
План:
1. Постулаты Бора.
2. Модель атома водорода по Бору.
Теоретический материал для самостоятельного изучения
Постулаты Бора.
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн.
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
|
|
|
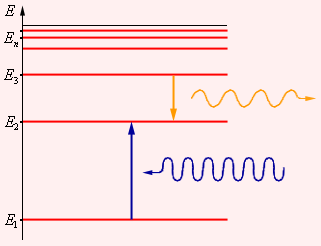
Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
|
|
|
где h – постоянная Планка. Отсюда можно выразить частоту излучения:

|
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:

При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
Свои постулаты Бор применил для построения теории простейшей атомной системы — атома водорода. Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом. Эти частоты можно найти на основе второго постулата и правила определения стационарных значений энергии атома. Это правило (так называемое правило квантования) Бору опять-таки пришлось постулировать.
|
|
|
Модель атома водорода по Бору.

| Боровская модель водородоподобного атома (Z — заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро. Переход электрона с орбиты на орбиту сопровождается излучением или поглощением кванта электромагнитной энергии (hν). |
Свои постулаты Н. Бор применил для построения теории строения простейшего атома (атома водорода).
Согласно этой теории Бор смог вычислить для атома водорода:
- возможные радиусы орбит электрона и размеры атома
- энергии стационарных состояний атома
- частоты излучаемых и поглощаемых электромагнитных волн.
Распределение энергетических уровней при излучении (испускании) и поглощении атомом водорода электромагнитных волн:


Поглощение света — процесс, обратный излучению. Атом, поглощая свет, переходит из низших энергетических состояний в высшие. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
|
|
|
Энергия в атомной физике измеряется в электронвольтах.
1 эВ – это энергия электрона, проходящего разность потенциалов в 1В.
1 эВ = 1,6 * 10-19 Дж.
При (n = 1) - основное энергетическое состояние, ему соответствует радиус орбиты электрона
r = 0,5 • 10-11 м.
При (n больше 1) - возбужденные состояния.
При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние, при этом электрон переходит на более отдаленную орбиту и его связь с ядром слабеет.
Переходы в первое возбужденное состояние (Е2) с верхних уровней соответствует частотам видимой части (кр з с с) спектра водорода.
Линейчатый спектр атома водорода состоит из линий, сгруппированных в серии.

В спектре водорода обнаружены следующие серии:
n = 1 - серия Лаймана - ультрафиолетовое излучение
n = 2 - серия Бальмера - видимое излучение
n = 3 - серия Пашена - инфракрасное излучение и т.д.
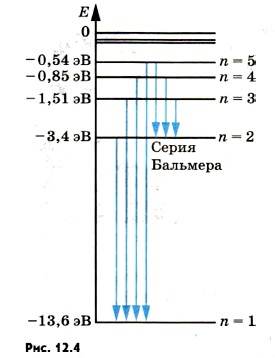
Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней образуют серию Балъмера. На рисунке выше эти переходы изображены стрелками. Красная, зеленая и две синие линии в видимой части спектра водорода соответствуют переходам:
Е3 → Е2, Е4 → Е2, Е3 → Е2, Е6 → Е2.
Движение электрона в атоме мало похоже на движение планет по орбитам.
Точнее, электрон на орбите можно назвать электронным облаком, имеющим разную плотность.
Орбитой электрона в атоме называется геометрическое место точек, в которых с наибольшей вероятностью можно обнаружить электрон.
Основная литература по теме урока:
1) Учебник «Физика 11» Г.Я. Мякишев, Б.Б. Буховцев, М. «Просвещение»
2) интернет ресурсы
Домашнее задание: изучить материал, сделать краткий конспект.
Задание скидывать в группу
36 гр. https://vk.com/club194179937
Дата добавления: 2021-12-10; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
