Предложите способы, как увеличить скорость реакции железа с соляной кислотой.
Ведущая тема нашего урока – Химические реакции. Химическое равновесие. Принцип Ле Шателье
Также на сегодняшнем уроке мы повторим, что мы уже знаем о химических реакциях И сразу же будем учиться применять полученные знания, чтобы:
- по различным признакам классифицировать реакции;
- пользоваться понятием «скорость реакции», «концентрация вещества», «химическая кинетика»;
- узнать, как можно вычислить скорость химической реакции по закону действующих масс, по правилу Вант-Гоффа, по изменению концентрации участников реакции в единицу времени, какие факторы влияют на скорость реакции (их 5!);
-познакомиться с обратимыми реакциями;
- научиться применять принцип Ле Шателье для того, чтобы определить, в какую сторону смещается химическое равновесие.
Это и будут практические задачи нашего урока.
 А теперь, после вступления, сделайте в тетради такую запись:
А теперь, после вступления, сделайте в тетради такую запись:
ЧАСТЬ ПЕРВАЯ. Повторим изученное
И начинаем мы, конечно, с повторения.
Вспомните,
1) Что такое химическая реакция?
2) На какие группы делят химические реакции? Заполните пропуски в схеме:
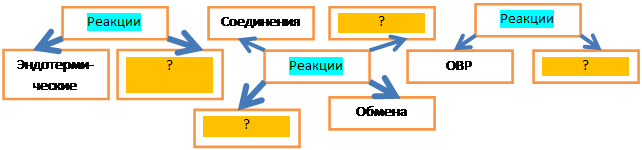
Перед тем, как переходить к основной части урока, подумайте, какие еще бывают типы химических реакций? Принципов классификации не менее 5!
ЧАСТЬ ВТОРАЯ. Осваиваем новое
А теперь можно двигаться дальше. Посмотрите видеофрагмент
https://www.youtube.com/watch?v=C88Xvj7omR4
В ходе просмотра заполните таблицу в тетради:
|
|
|
| Упражнение 1 Укажите факторы, влияющие на скорость реакций
| ||
| Факторы, влияющие на скорость реакций | Пример | Где применяются? |
| … | ||
| Концентрация реагирующих веществ | Чем больше концентрация соляной кислоты, тем быстрее протекает реакция с цинком: 2HCl +Zn = ZnCl2+ H2 | При производстве аммиака, этилового спирта, в медицине – кислородная подушка |
| … | ||
| … | ||
| … | ||
Итак, вы уже поняли, что вычислить скорость реакции можно по одной из формул: A + mB = ABm
C2 – C1 v2 (T2-T1)/10

 v = v= k∙ CA ∙ CB m = γ
v = v= k∙ CA ∙ CB m = γ
t2 – t1 v1
по изменению по закону действующих по правилу
концентраций масс Вант-Гоффа
Если при одних и тех же условиях (температура, давление) возможно одновременное протекание реакции как в одну, так и в другую сторону, то такие реакции называются обратимыми. К ним относятся омыление жиров, получение аммиака и другие. При этом скорость прямой реакции со временем падает (реагирующих веществ становится все меньше), а обратной реакции – увеличивается (продукта становится все больше. В итоге наступает момент, когда скорости прямой и обратной реакции равны. Это состояние называют химическим равновесием. Внешне кажется, что в такой системе ничего не происходит. Но стоит оказать на систему внешнее воздействие, и одна из реакций начинает ускоряться. Это происходит до тех пор, пока система снова не придет в равновесие, только уже при других условиях. Влияние внешних факторов на смещение химического равновесия описано принципом Ле Шателье.
|
|
|
Подробнее об этом вы узнаете из видеофрагмента:
https://www.youtube.com/watch?v=f1_sZm_KqUc
ЧАСТЬ ТРЕТЬЯ. Закрепим изученное
Осталось закрепить изученный материал. В качестве закрепления попробуем ответить на практические вопросы:
1. Водород вступает в две реакции - с кислородом и с азотом. В первом случае реакция идет мгновенно, со взрывом, а во втором происходит медленно, в конечный продукт превращается не более 15% исходного вещества. Как вы думаете, почему? Как это связано с классификацией реакций?
|
|
|
Предложите способы, как увеличить скорость реакции железа с соляной кислотой.
Дата добавления: 2021-12-10; просмотров: 40; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
