Молярная масса и молярный объем
Расчет молекулярной массы для газа известного состава
1. Приветствие - Добрый день
Опрос и проверка заданий и лекционного материала прошлого занятия – 10-15 мин(2-3 чел)
Вопросы для проверки по предыдущей теме:
Что такое плотность, удельный вес.
Способы определения плотности нефти.
Классификация нефти по плотности.
Какое значение имеет плотность нефти
3. Тема занятия: Расчет молекулярной массы для газа известного состава
4.Цель занятия: Расчет молекулярной массы для газа известного состава
Молярная масса газа
http://ru.solverbook.com/zakazat-reshenie/order/Отношение массы (m) вещества к его количеству (n) называют молярной массой вещества:
M = m / n.
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
|
|
|
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
| КОЛИЧЕСТВЕННЫЕ СООТНОШЕНИЯ |
Атомная масса
Массы атомов и молекул очень малы, и использовать для численного выражения их величин общепринятую единицу измерения - килограмм - неудобно. Поэтому для выражения масс атомов и молекул используют другую единицу измерения - атомную единицу массы (а.е.м.).
|
|
|
Атомная единица массы (а.е.м.) - единица измерения масс атомов, молекул и элементарных частиц. За атомную единицу массы принята 1/12 массы нуклида углерода 12С. Масса этого нуклида в единицах СИ равна 1,9927·10-26 кг.

Относительная атомная масса (устаревший термин - атомный вес) - масса атома, выраженная в атомных единицах массы (а.е.м.). Обозначается Аr.
Большинство природных химических элементов представляют собой смесь изотопов. Поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе.
Например, кислород имеет три изотопа 16О, 17О и 18O, их атомные массы и содержание в природной смеси приведены в таблице ниже.
| Изотоп | Содержание в природной смеси, атомн. % ni | Атомная масса изотопа а.е.м. Аr,i |
| 16 О | 99,759 | 15,995 |
| 17 О | 0,037 | 16,999 |
| 18 О | 0,204 | 17,999 |
Среднее значение атомной массы с учетом вклада каждого изотопа вычисляется по следующей формуле:
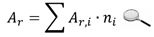
Подставив в эту формулу соответствующие значения из таблицы для атомной массы кислорода, получим:
Аr = 15,995·0,99759 + 16,999·0,0037 + 17,999·0,0204 = 15,999 а.е.м.
Атомная масса и массовое число - совершенно различные понятия: первое - масса атома, выраженная в а.е.м., а второе - число нуклонов в ядре. Атомная масса - дробная величина (имеет целое значение только для изотопа 12С), в отличие от массового числа, которое является всегда целым.
|
|
|
Численно эти величины очень близки; например, для водорода атомная масса равна 1,0078, а массовое число равно 1, для гелия атомная масса равна 4,0026, а массовое число - 4.
Относительные атомные массы имеют дробные значения по следующим причинам:
1. Большинство элементов, существующих в природе, представляют смесь нескольких изотопов, и в Периодической системе указывается среднее значение относительной атомной массы смеси природного изотопного состава.
2. Для моноизотопных элементов (например, 23Na) это значение будет также дробным, т. к. масса нуклонов, выраженная в а.е.м., не является целым числом и при образовании ядра часть массы нуклонов переходит в энергию, в соответствии с уравнением Есвязи = Δm·c2, где с = 3·108 м/с - скорость света в вакууме.
При образовании любой связи всегда выделяется энергия, на что и расходуется часть массы связывающихся частиц. В случае образования химических связей эта величина очень мала, поэтому изменением массы здесь пренебрегают и считают, что масса образовавшейся частицы равна сумме масс частиц, участвующих в ее образовании. При образовании же ядра выделяется очень большая энергия, и «дефект массы» хорошо заметен.
|
|
|
Молекулярная масса
Молекулярная масса - масса молекулы, выраженная в а.е.м. Масса молекулы практически равна сумме относительных атомных масс входящих в нее атомов.
Если же вещество состоит не из молекул, а, например, из ионов (NaCl), или является олигомером [(Н2О)n], то относительную молекулярную массу указывают для формульной единицы вещества. Под формульной единицей вещества следует понимать химический состав наименьшего количества данного вещества.
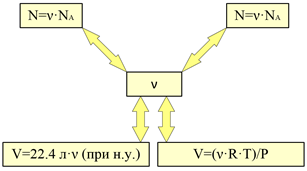
Моль - единица измерения количества вещества. Обозначается ν. 1 моль - это такое количество вещества, в котором содержится столько же структурных единиц (атомов, молекул, ионов, радикалов), сколько атомов содержится в 0,012 кг изотопа углерода 12С, а именно:
NA = 6,022·1023 моль-1 - число Авагадро
Молярная масса вещества (М) равна отношению массы этого вещества (m) к его количеству (ν):
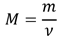
Прежнее определение: масса одного моля вещества, численно равна его молекулярной массе, но выражается в единицах [г/моль].
Различие в понятиях: «молярная масса» и «молекулярная масса», похожи по звучанию, но относятся к разному числу объектов: первое - это масса одного моля вещества (т.е. масса 6,022·1023 молекул), а второе - масса одной молекулы, и выражены они в разных единицах - [г/моль] и [а.е.м.] соответственно.
Понятие «количество вещества» и, соответственно, единица его измерения - моль используются в большинстве химических расчетов. Эта величина однозначно связана с массой, числом структурных единиц и объемом (если это газ или пары) вещества. Если задано количество вещества, то эти величины легко рассчитать.
Молярная масса и молярный объем
Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональна массе соответствующей структурной единицы, т. е. относительной молекулярной (или атомной) массе данного вещества:
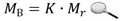
В самом деле, для изотопа углерода 12С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12 г/моль. Следовательно, численные значения двух масс совпадают, а значит, К = 1. Отсюда следует, что молярная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, молярная масса атомарного водорода равна 1,008 г/моль, молекулярного водорода - 2,016 г/моль, молекулярного кислорода - 31,999 г/моль.
Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует, что при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем. Нетрудно рассчитать, какой объем занимает один моль газа при нормальных условиях, т. е. при нормальном атмосферном давлении (101,325 кПа) и температуре 273 К. Например, экспери-ментально установлено, что масса 1 л кислорода при нормальных условиях равна 1,43 г. Следовательно, объем, занимаемый при тех же условиях одним молем кислорода (32 г), составит 32 : 1,43 = 22,4 л. То же число получим, рассчитав объем одного моля водорода, диоксида углерода и т.д.
Отношение объема, занимаемого веществом, к его количеству называется молярным объемом вещества.
Как следует из изложенного, при нормальных условиях молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,414 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называются идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах.
Молярная масса газа
Для определения относительной молекулярной массы вещества обычно находят численно равную ей молярную массу вещества (в г/моль). Если вещество находится в газообразном состоянии, то его молярная масса может быть найдена с помощью закона Авогадро. По этому закону равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные их молярные массы:
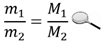
Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Например, при нормальных условиях масса диоксида углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях - 0,09 г, откуда плотность оксида углерода по водороду составит: 1,98 : 0,09 = 22.
Обозначим относительную плотность газа m1/m2 буквой D. Тогда:

откуда
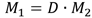
Молярная масса газа равна его плотности по отношению к другому газуу умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода с точностью до сотых равна 2 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:

Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим:
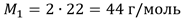
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль. Обозначив плотность исследуемого газа по воздуху через D получим следующее уравнение для вычисления молярных масс:
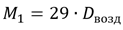
Молярную массу вещества (а следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 22,4 л этого вещества при тех же условиях. Полученная величина и выражает молярную массу вещества.
Пример: 0,7924 г хлора при 0°С и давлении 101,325 кПа занимают объем, равный 250 мл. Вычислить относительную молекулярную массу хлора. Находим массу хлора, содержащегося в объеме 22,4 л (22400 мл): m = 22400*0,7924/250 ≈ 71 г. Следовательно, молярная масса хлора равна 71 г/моль, а относительная молекулярная масса хлора равна 71.
Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака:

Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа - уравнением Клапейрона-Менделеева:

Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона-Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях:
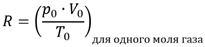
Пример: Какое значение газовой постоянной следует взять для расчета параметров газа, взятого при давлении 10 атм в объеме 100 л?
Находим значение газовой постоянной исходя из того, что нормальные условия - это такие условия, когда ро ≈ 101,3 кПа ≈ 760 мм.рт.ст. ≈ 1 торр ≈ 100 бар ≈ 1 атм. Объем же, занимаемый 1 молем газа при нормальных условиях, равен Vo ≈ 22,4 л, температура То ≈ 273 К. Тогда R = 1·22,4/273 = 0,082 атм·л/(моль·К).
Описанными способами можно определять молярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молярных масс газов. Молярные массы, определенные этими способами, не вполне точны, потому что рассмотренные газовые законы и уравнение Клапейрона-Менделеева строго справедливы лишь при очень малых давлениях. Более точно молярные массы вычисляют на основании данных анализа вещества.
Доли вещества
Массовая доля вещества А в системе - отношение его массы к массе всей системы (часто эту величину выражают в %):

Объемная доля компонента - отношение объема компонента к объему всей системы:
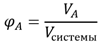
Мольная доля компонента - отношение количества вещества (моль) компонента А к общему количеству молей всех компонентов системы:
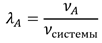
Парциальное давление газа
При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара. При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением.
Парциальное давление - это давление (pi) которое производило бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью.
Пример: Пусть над водой собрано 570 мл газа при температуре 20°С и давлении 104,1 кПа. Это давление складывается из двух величин - парциального давления самого газа и давления насыщенного водяного пара. Последнее при каждой температуре имеет вполне определенную величину, в частности при 20°С оно равно 2,34 кПа. Следовательно, парциальное давление газа в данном случае равно 104,1 - 2,34 = 101,76 кПа. Приводя измеренный объем газа к нормальным условиям, следует подставить в уравнение не общее давление газовой смеси (104,1 кПа), а парциальное давление газа (101,76 кПа):
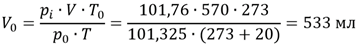
Если не учитывать поправку на давление паров воды, то вместо найденного объема получим:
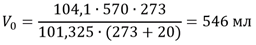
Ошибка составит 13 мл, т. е. около 2,5%, что можно допустить только при ориентировочных расчетах.
Дата добавления: 2021-12-10; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
