Обезвреживающая(барьерная, детоксикационная) функция печени
Печень является главным органом, где происходит обезвреживание естественных метаболитов (билирубин, гормоны, аммиак) и чужеродных веществ. Чужеродными веществами, или ксенобиотиками, называют вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей или в качестве источников энергии. К ним относят лекарственные препараты, продукты хозяйственной деятельности человека, вещества бытовой химии и пищевой промышленности (консерванты, красители).
Обезвреживание нормальных метаболитов
1. Обезвреживание пигментов. В клетках ретикулоэндотелиальной системы печени протекает катаболизм гема до билирубина, конъюгация билирубина с глюкуроновой кислотой в гепатоцитах и распад в гепатоцитах поступающего из кишечника уробилиногена до непигментных продуктов.
2. Обезвреживание аммиака. Аммиак – высокотоксичное соединение, особо опасное для мозга. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины в печени. Мочевина – малотоксичное соединение и легко выводится из организма с мочой.
3. Инактивация гормонов. Печени принадлежит значительная роль в инактивации гормонов. Многие пептидные гормоны гидролизуются в печени при участии протеолитических ферментов. Например, фермент инсулиназа гидролизует пептидные цепи А и В инсулина. Катаболизм адреналина и норадреналина происходит в печени путем дезаминирования моноаминооксидазой, метилирования и конъюгации с серной и глюкуроновой кислотами. Продукты метаболизма выводятся с мочой.
|
|
|
Обезвреживание большинства ксенобиотиков происходит в 2 фазы:
1. фаза химической модификации;
2. фаза коньюгации.
Химическая модификация – это процесс ферментативной модификации исходной структуры ксенобиотика, в результате которой происходит:
1. разрыв внутримолекулярных связей;
2. присоединение к молекуле дополнительных функциональных групп (-СН3, -ОН, -NH2),
3. удаление функциональных групп путем гидролиза.
Типы модификаций:
1. окисление (микросомальное, пероксисомальное);
2. восстановление;
3. изомеризация;
4. ацетилирование, метилирование, гидроксилирование;
5. гидролиз и т.д.
Система обезвреживания включает множество разнообразных ферментов (оксидоредуктазы, изомеразы, лиазы, гидролазы), под действием которых практически любой ксенобиотик может быть модифицирован. Наиболее активны ферменты метаболизма ксенобиотиков в печени.
В результате химической модификации, как правило, ксенобиотики становятся более гидрофильными, повышается их растворимость, и они легче выделяются из организма с мочой. Кроме этого, дополнительные функциональные группы необходимы, чтобы вещество вступило в фазу конъюгации.
|
|
|

Механизмы микросомального окисления .






Редуктазная цепь окисления, в которой источником электронов и протонов служит НАДН∙Н+, источником которого, в свою очередь, является гликолиз. Редуктазная цепь микросомального окисления несет вспомогательную для монооксигеназной цепи функцию, обеспечивая дополнительный приток туда водорода и электронов, что имеет очень большое значение, поскольку восстановленный НАДФ является относительно дефицитным продуктом.
Реакции коньюгации
Коньюгация – процесс образования ковалентных связей между ксенобиотиком и эндогенным субстратом. Образование связей происходит, как правило, по ОН- или NH2-группе ксенобиотика. Образовавшийся коньюгат малотоксичен и легко выводится из организма с мочой.
I тип реакций – когда предварительно активируется конъюгирующее вещество. Наиболее частый вид конъюгации. Примером реакций данного типа могут служить глюкуронидная и сульфатная конъюгации.
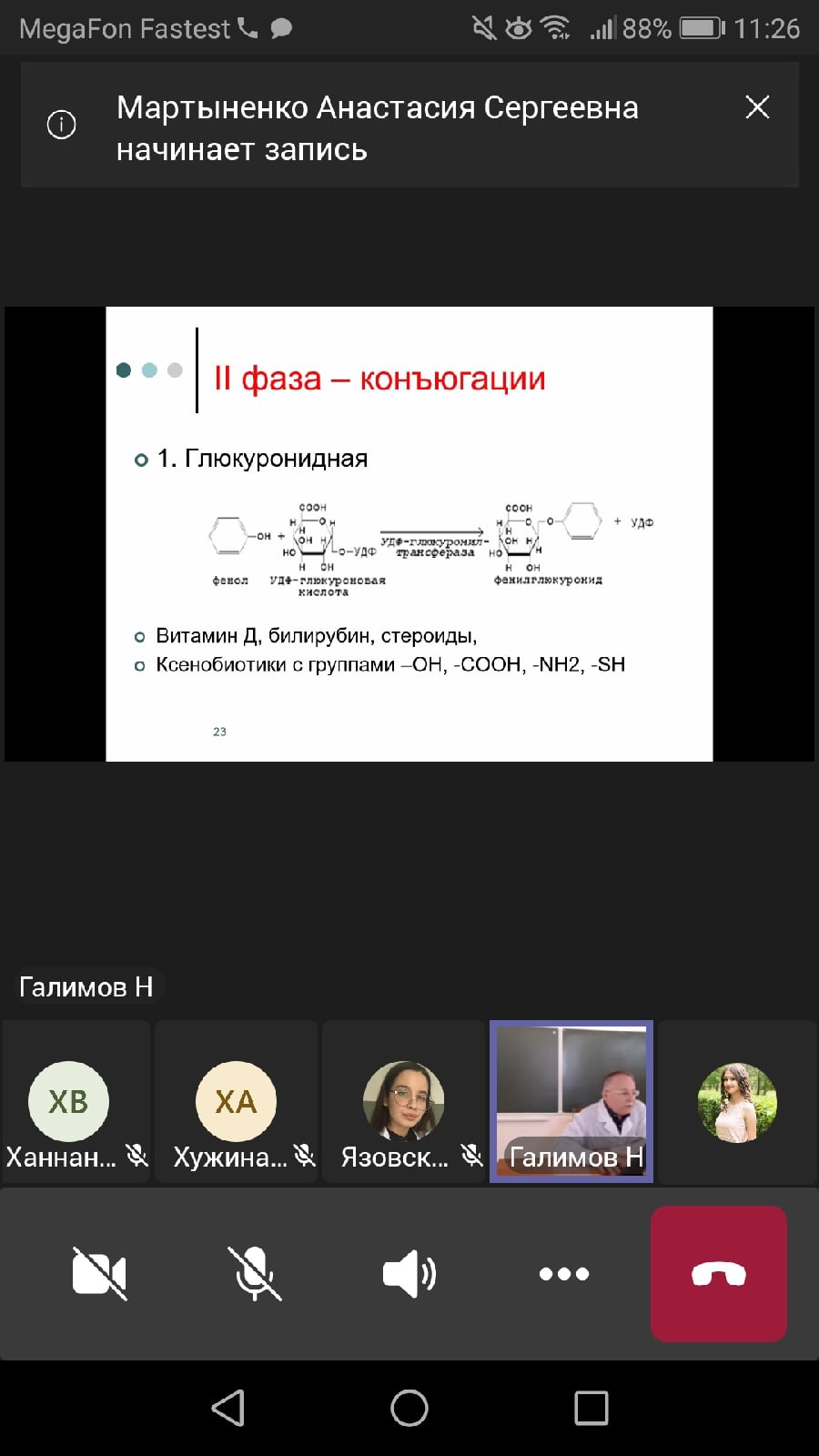
1. Глюкуронидная. Молекула глюкуроновой кислоты находится в виде УДФ-глюкуроновой кислоты (УДФГК). Фермент, который переносит глюкуроновую кислоту на молекулу конъюгируемого вещества, называется УДФ-глюкуронилтрасфераза.
|
|
|
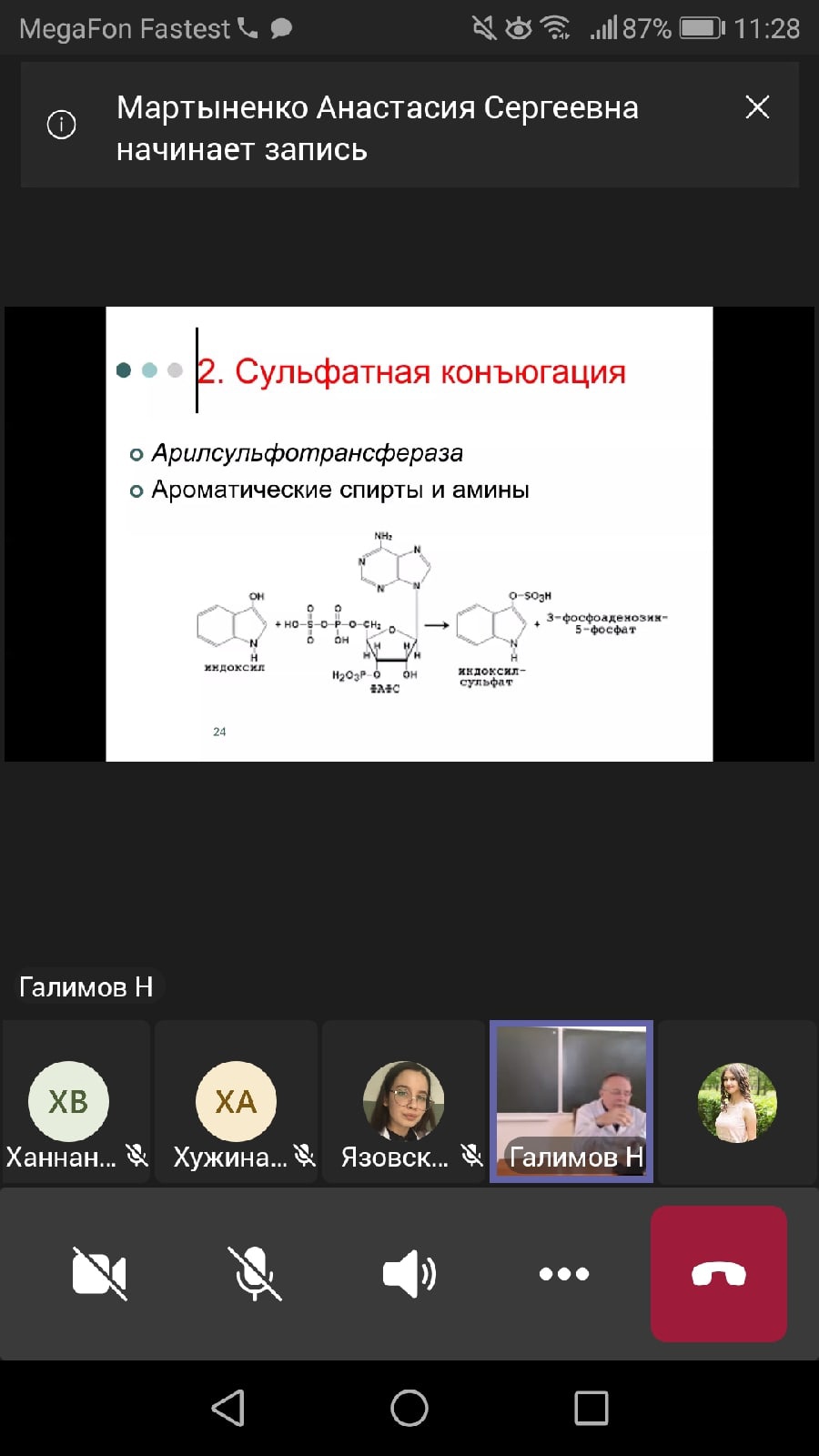
2. Сульфатная. Молекула серной кислоты находится в виде 3-фосфоаденозил-5-фосфосульфата (ФАФС). Фермент, который переносит остаток серной кислоты на молекулу конъюгируемого вещества, называется арилсульфотрансфераза.
II тип реакций. Сначала активируется ксенобиотик, который затем переносится на конъюгирующую биомолекулу с образованием конъюгата. Относительно редкий вид конъюгации. Примером реакций конъюгации данного типа является глициновая конъюгация бензойной кислоты.

Также выделяют глутатионовую, ацетильную коньюгации.
 \
\ 
9. Роль отдельных защитных белков, реагирующих на воздействие ксенобиотиков и тяжелых металлов.
Можете с лекции взять(у меня нет скрина этих слайдов), если почерк непонятный (нормальную инфу в инете не нашла) 
10. Активные формы кислорода (АФК), пути образования. Биологическая роль.
«Активные формы кислорода» – это понятие собирательное, объединяющее такие соединения, как молекулы – перекись водорода (Н2О2), озон (О3) и синглетный кислород (1О2), гипохлорит (HOCI); ионы – НО2–, пероксинитрит (ONOO–); свободные радикалы – супероксидный (О2), гидроксильный (НО•), пергидроксильный (НО2•), пероксильный (RO2•), алкоксильный (RО•) и оксид азота (NО•). Электронные структуры некоторых из этих АФК приведены на рис. 1.
|
|
|
Общим для всех этих соединений является их высокая реакционная способность. АФК отличаются друг от друга реакционной способностью, временем жизни и выполняемыми функциями (табл. 1).
АФК образуются в результате нормально протекающих процессов в организме и выполняют определенную биологическую функцию. Свободнорадикальное окисление – неотъемлемое звено таких важных биологических процессов, как транспорт электронов в дыхательной цепи, синтез простагландинов и лейкотриенов, пролиферация и дифференциация клеток, метаболизм и синтез катехоламинов, фагоцитоз, метаболизм разных ксенобиотиков. В нормально функционирующем организме они участвуют в метаболизме структурных компонентов клеточных мембран (белков, липидов, углеводов) и соответственно регулируют не только скорость их метаболизма, но и функциональное состояние самой мембраны клетки. С особенностями метаболизма АФК связывают изменение мембранной подвижности, текучести, деполяризацию мембран.
| Вид АФК | Хим. символ | Т1\2 T 37 ºC, | Свойства |
| Супероксид -радикал | О2 | 10–6 | Хороший восстановитель, умеренный окислитель. Обладает свойствами внутриклеточного мессенджера: сигнальный механизм при взаимодействии различных подтипов глутаматных и аспартатных рецепторов, регуляция активности хлорных каналов, индукция образования пор в митохондриальной мембране. Участвует в окислительной модификации SН- и NН2-групп низкомолекулярных соединений. Вазоконстриктор. Антисептик |
| Гидроксил -радикал | НО• | 10–9 | Мощный окислитель. Чрезвычайно активен в реакциях акцептирования и переноса электронов. Участвует в окислительной модификации нуклеиновых кислот, белков, липидов, простагландинов. Диффундирует на очень малые расстояния |
| Перекись водорода | Н2О2 | 10–100 | Оксидант, характеризуется малыми скоростями взаимодействия с органическими субстратами. Обладает высокой диффузной способностью. Обладает свойствами мессенджера: активация факторов транскрипции NF-κB, АР-1, редокс-регуляция экспрессии генов |
| Синглетный кислород | 1О2 | 10–6 | Мощный окислитель |
| Пероксильный радикал | ROO• | 10–2 | Характеризуется низкой окислительной активностью по сравнению с НО•, но более высокой диффузией. Участвует в регуляции гемодинамики. Вазодилататор |
| Алкоксильный радикал | RO• | 10–6 | Эффективен при взаимодействии с липидами, приводит к их окислительной модификации. Окислительные свойства на уровне НО• |
| Монооксид азота | NO• | 10–3 | Умеренный окислитель, хорошо диффундирует, хороший восстановитель. Обладает свойствами медиатора, вторичного мессенджера или нейромодулятора. Участвует в образовании межнейрональных контактов, экспрессии генов, иммуногенезе, активации гуанилилциклазы. Вазодилататор |
| Перокси- нитрит | ONOO– | 10–7 | Мощный окислитель. Участвует в реакции нитрования белкового тирозина, окислении SH-групп и металлопротеинов, разрыве цепей ДНK, активирует поли-(АДФ-рибоза)-полимеразу, регулирует уровень внутриклеточного НАД. Характеризуется более низкой, чем у NO•, но более высокой, чем у НО•, диффузной способностью |
| Гипо хлорит | OСl– | 10–6 | Мощный окислитель. Характеризуется более высокой, чем у ONOO–, диффузной способностью, участвует в окислении тиоловых и дисульфидных групп белков и ДНK, хлорировании тирозина. Является редокс-регулятором клеточного сигнала через тирозинкиназу |
В физиологических условиях АФК образуются преимущественно в следующих системах [4]:
· в дыхательной цепи митохондрий в небольшом количестве (до 100 пмоль) вследствие «утечки» 1–5 % электронов c физиологических акцепторов на молекулярный кислород (в этом случае генерируется в основном супероксид О2, скорость образования которого находится в прямой зависимости от степени сопряженности дыхательной цепи); ферментативные комплексы дыхательной цепи митохондрий, которые генерируют О2 (НАДФ-зависимая дегидрогеназа, НАД-зависимая убихинонредуктаза), могут активироваться при физических нагрузках (мышечное сокращение), энергозависимых процессах в почках, трансмембранных процессах и др.; полагают, что О2 является родоначальником всех других форм АФК in vivo;
· в процессе активации НАДФН-оксидазы; экспрессия этого фермента характерна для фагоцитирующих клеток крови (нейтрофилы, эозинофилы, макрофаги), эндотелиальных клеток, хондроцитов и астроцитов; НАДФН-оксидаза катализирует одноэлектронное восстановление О2, принимая восстановительный эквивалент от НАДН или НАДФН; активация НАДФН-оксидазы происходит под действием цитокинов (TNF-γ, TNF-β, IL-1β, некоторые ростовые факторы) и сопровождается образованием О2 и Н2О2;
· при синтезе простагландинов как по циклооксигеназному пути – в процессе превращения PgG2 в PgН2 (пероксидазная функция PgН-синтазы), так и по липоксигеназному пути – в процессе превращения гидроперекиси арахидоновой кислоты в оксикислоту; этот процесс контролируется рядом пептидных гормонов (ангиотензин), цитокинов (TNF-β) и ростовых факторов;
· в системе миелопероксидаза-Н2О2-галогены (Cl–, Br–, I–), которая запускается вследствие активации фагоцитоза и приводит к образованию О2, OCl– и НО•;
· при спонтанном или катализируемом моноаминоксидазой окислении дофамина и адреналина (при спонтанном окислении образуется О2, а при катализируемом моноаминоксидазой – Н2О2);
· при активации глутаматных рецепторов; так, активация NMDA-подтипа глутаматных рецепторов (ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат) на постсинаптической мембране приводит к открытию каналов, проницаемых для Са2+ (входящий ток) и К+ (выходящий ток); следствием активации этих рецепторов является внутриклеточная продукция АФК (О2 и НО•), а результатом активации Са2+-зависимой NO-синтазы – NO•;
· при активации АМРА/каинатных рецепторов, в основе чего лежат как Са2+-зависимые, так и митохондриальные механизмы;
· во время синтеза NO•, образуемого из гуанидинового атома азота и L-аргинина синтазой оксида азота (NOS), которая присоединяет молекулярный кислород к терминальному атому азота в гуанидиновой группе L-аргинина (NOS образует также конечный неактивный продукт – L-цитруллин).
Из книги Северина- Источники активных форм кислорода
ЦПЭ как источник активных форм кислорода
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом — основной путь образования активных форм кислорода в большинстве клеток.
Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона (рис. 8-55) — КоQН• (см. раздел 6).
Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион О2•, который, в свою очередь, может превращаться в другие активные формы кислорода:

Рис. 8-55. Реакции последовательного восстановления убихинона в дыхательной цепи.

Реакции, катализируемые оксидазами и оксигеназами
Многие оксидазы — ферменты, непосредственно восстанавливающие кислород, образуют пероксид водорода — Н2O2. Оксидазы образуют пероксид водорода по схеме:
O2 + SН2 —> S + Н2O2, где SН2 — окисляемый субстрат.
Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксисом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях.
Монооксигеназы, например, цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода.
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода — гидроксильного радикала (ОН•) по следующей реакции:
Fе2+ + Н2O2 —>Fе3+ + ОН- + ОН•.
Наличие в клетках Fе2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
11. Перекисное окисление липидов (ПОЛ), его биологическая роль
Тоже в лекции есть, но я пыталась тут пояснить получше (инфа из Северина)
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fе2+молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ — цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•) 
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи: 
Развитие цепи происходит при присоединении O2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов

Конечные продукты перекисного окисления полиеновых кислот — малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи — взаимодействие радикалов между собой:

Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
В. Повреждение клеток в результате перекисного окисления липидов
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов — всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты — вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
12. Система антиоксидантной защиты организма.
Тоже в лекции есть, но я пыталась тут пояснить получше
Ферменты антиоксидантного действия
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико.
Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2 О2• + 2 Н+ —> Н2О2 + О2.
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи.
СОД — ицдуцируемый фермент, т. е. синтез его увеличивается, если в клетках активируется перекисное окисление.
Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2 Н2О2 —> 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» (см. раздел 6).
Глутатионпероксидаза — важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (y-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSН) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Н2O2 + 2 GSH —> 2 Н2O + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ —> 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) — наиболее распространённый антиоксидант в природе — является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Рис. 8-56. Механизм антиоксидантного действия витамина Е. Витамин Е (α-токофероп) ингибирует свободнорадикальное окисление путём отдачи электрона, что приводит к инактивации радикала липида, а витамин Е превращается в стабильный, полностью окисленный токоферолхинон.

Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода — O2•, Н2O2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты — помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
Дата добавления: 2021-12-10; просмотров: 98; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
