Экспериментальные подтверждения МКТ
1. Вещество состоит из частиц – атомов и молекул. Целая наука химия основывается на модели существования атомов и молекул, и многие явления предсказаны и объяснены с помощью этой модели. А непосредственным подтверждением можно считать изображения с электронного микроскопа, на которых отдельные атомы в молекуле стали различимы (см. рис. 4).
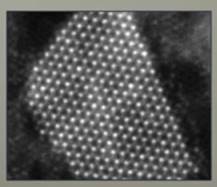
Рис. 4. Изображение атомов под электронным микроскопом
2. Все молекулы вещества находятся в постоянном хаотическом движении. Доказательством этому служит то, что газ занимает весь предоставленный ему объем. Что может заставить частицы газа переместиться в изначально незаполненные области? Да просто они и так постоянно в движении, и если их ничего не сдерживает, то они эти области заполняют (см. рис. 5).


Рис. 5. Заполнение газом всего объема
Явление диффузии (см. рис. 6) хорошо объясняется хаотичным движением частиц, которые при этом смешиваются и проникают между частицами другого вещества. Из младших классов вы помните броуновское движение – беспорядочное движение мельчайших видимых частиц вещества под действием молекул жидкости. Само броуновское движение – это не движение молекул, но, если частица вещества, например пылинка, достаточно мала, хаотичное движение молекул начинает на него влиять.

Рис. 6. Диффузия
3. Взаимодействие атомов и молекул. Наличие взаимодействия частиц подтверждают свойства твердых тел и жидкостей. В газах частицы между столкновениями почти не взаимодействуют. А вот возникновение сил упругости при деформации твердых тел, сохранение ими формы подтверждает наличие сил притяжения между молекулами. Поверхностное натяжение жидкостей (см. рис. 7) тоже свидетельствует о наличии притяжения между молекулами жидкостей.
|
|
|

Рис. 7. Поверхностное натяжение жидкостей
Инструменты для количественных характеристик молекул
Чтобы решать задачи, кроме вопросов «как?» и «что происходит?», нужно еще отвечать на вопросы «сколько?». Нужны количественные характеристики. До этого нам достаточно было массы и объема: 2 кубометра воды, 10 кг алюминия. Для удобства ввели величину плотность: сколько килограммов содержится в одном кубометре.
А теперь, когда мы заговорили об отдельных молекулах, могут возникнуть задачи, когда нам нужно знать количество этих молекул в штуках. Сколько их всего, или сколько их в каждом миллилитре объема. Мы имеем дело с огромным количеством молекул, и считать их в штуках неудобно. Мы не всегда даже вспомним названия этих секстиллионов и септиллионов, да и степени десяти записывать каждый раз тоже неудобно: «возьмем 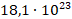 молекул воды и
молекул воды и  молекул сахара».
молекул сахара».
|
|
|
В повседневной жизни мы легко находим выход: вводим новые единицы измерения количества. Яйца считаем в десятках (а в некоторых странах – в дюжинах, то есть по 12 штук), солдат – в ротах, батальонах и т. д., картошку – в мешках. И если мешок картошки – это величина неточная, мешки бывают разного размера, как и сама картошка, то для количества вещества (его обозначили 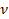 ) ввели точную единицу измерения – 1 моль. Это такое количество вещества, в котором содержится
) ввели точную единицу измерения – 1 моль. Это такое количество вещества, в котором содержится 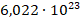 молекул.
молекул.
Это число назвали числом Авогадро:
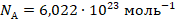
Единицу количества ввели до того, как узнали размеры молекул и смогли их сосчитать. Изначально это было такое количество вещества, в котором молекул столько же, сколько в 12 граммах углерода 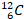 .
.
Одно и то же количество разных молекул обладает разной массой. Это понятно, молекулы отличаются по массе. И удобно определить, какова же масса одного моля для разных веществ. Эту величину – массу одного моля вещества – назвали молярной массой и обозначили 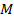 :
:
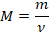
В СИ единица измерения молярной массы – 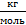 , но исторически сложилось, что часто ее выражают в
, но исторически сложилось, что часто ее выражают в  .
.
В таблице Менделеева указана масса атома каждого элемента в атомных единицах массы (а. е. м.) – так называемая относительная атомная масса 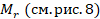 .
.
|
|
|

Рис. 8. Относительная атомная масса химических элементов в таблице Менделеева
.
Запишем определения в виде уравнений. Если в 1 моль вещества содержится  молекул, значит, количество вещества
молекул, значит, количество вещества 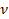 в молях означает, сколько раз это количество молекул
в молях означает, сколько раз это количество молекул 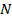 вмещает
вмещает  :
:
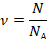
Определение молярной массы мы уже записали:
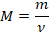
Поскольку это масса 1 моль вещества, а в 1 моль содержится  молекул, то масса одной молекулы равна:
молекул, то масса одной молекулы равна:

Количество молекул в единице объема назвали концентрацией и обозначили  :
:

Здесь нет физических закономерностей или объяснения явлений, мы просто ввели физические величины, которыми нам будет удобно пользоваться, и записали их определения математически.Мы теперь можем легко переходить от массы всего вещества к массе одной молекулы; от массы в единице объема (плотности), к количеству молекул в единице объема (концентрации) и т. д.
Понятие температуры – одно из важнейших в молекулярной физике.
Температура - это физическая величина, которая характеризует степень нагретости тел.
Беспорядочное хаотическое движение молекул называется тепловым движением.
Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться небольшой. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно диаметру молекулы. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
|
|
|
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Рассмотрим пример. Если положить нагретый металл на лед, то лед начнет плавится, а металл – охлаждаться до тех пор, пока температуры тел не станут одинаковыми. При контакте между двумя телами разной температуры происходит теплообмен, в результате которого энергия металла уменьшается, а энергия льда увеличивается.
Энергия при теплообмене всегда передается от тела с более высокой температурой к телу с более низкой температурой. В конце концов, наступает состояние системы тел, при котором теплообмен между телами системы будет отсутствовать. Такое состояние называют тепловым равновесием.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Дата добавления: 2021-12-10; просмотров: 20; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
