Реакции, идущие в однородных системах (гомогенные).
Тема занятия.
Лабораторная работа «Типы химических реакций».
Цель занятия:
· методическая:
- усовершенствовать методику проведения лабораторных работ с использованием интерактивных форм обучения;
дидактическая:
- систематизировать теоретические знания по теме «Типы химических реакций»;
- усовершенствовать практические навыки работы с лабораторной посудой и реактивами;
- развивать познавательную активность, логическое мышление студентов;
- розвивать умения наблюдать, анализировать, делать выводы по результатам выполненных опытов;
В начале нашей работы проведем химическую разминку. (слайд3)
Задание 1: 1. Что такое химические явления? Чем они отличаются от физических?
2.Укажите известные вам признаки химических реакций.
3.При каких условиях идут химические реакции?
4.Какие реакции относятся к реакциям соединения, разложения, замещения, обмена?
5.Все ли химические процессы являются окислительно-восстановительными реакциями?
6.Быстрее идут гомогенные реакции или гетерогенные?
Задание 2 (слайд4)
Дальше поработаем с химическими уравнениями. Внимание на экран.
Из приведенного перечня схем химических реакций выберите:
1 вариант – реакции соединения,
2 вариант – реакции разложения,
3 вариант – реакции обмена,
4 вариант – реакции замещения.
|
|
|
Расставьте коэффициенты в приведенных схемах реакций:
1. HgO ––> Hg + O2 2. Сu(OH)2 + HCl ––> H2O + CuCl2
3. Al + O2 ––> Al2O3 4. KBr + Cl2 ––> KCl + Br2
5. Zn + HCl ––> ZnCl2 + H2 6. Ca + O2 ––> CaO
7. СuCl2 + NaOH ––> Cu(OH)2 + NaCl 8. H2O ––> H2 + O2
1. По какому признаку определили тип реакции?
2. Что уравниваем в уравнении реакции?
3. На основании какого закона расставляем коэффициенты?
(Заслушиваем ответы студентов. Студентам предлагается оценить свою работу на первом этапе).
Ход работы
Опыт 1. (Выполняется под руководством преподавателя).
Студенты поочередно выполняют опыты, соответствующие реакциям соединения, разложения, обмена и замещения, выполняют записи соответствующих уравнений на доске. (Слушаем ответы, смотрим слайды 5,6,7,8).
Обсуждение каждого опыта сопровождается демонстрацией видеофрагментов о реакциях соединения, разложения и замещения.
(Студенты показывают и комментируют видеофрагменты5,2,1)
Опыт 2. (Выполняется под руководством преподавателя).
Здесь мы рассмотрим группу реакций, которые классифицируются по тепловому эффекту. (Студенты рассказывают об экзо- и эндотермических реакциях : поясняют причины повышения и понижения температуры в результате выполненных химических процессов; рассматривают слайды 9,10)
|
|
|
Далее смотрим и комментируем видеофрагмент о термитных смесях. (видеофрагмент 4)
Опыт 3. (Выполняется под руководством преподавателя).
При выполнении этого опыта мы еще раз вспомнили о реакциях с различным агрегатным состоянием реагентов и продуктов реакции.
(Рассказ о гомогенных и гетерогенных реакциях. Слайды 11,12. Видеофрагмент 3)
Слово преподавателя.
На экране перед вами схема. Мы вместе определим тип каждой химической реакции. Аналогичное задание вы получите на дом. Из букв, которыми обозначены правильные ответы, должны получить: фамилию французского химика, сформулировавшего в 1789 году независимо от Ломоносова, закон сохранения массы веществ.
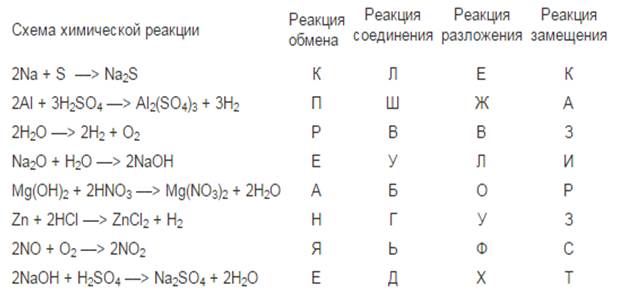
(В результате получается фамилия Лавуазье. Проверка – слайд 14).
Аналогичное задание, в котором постараетесь определить фамилию русского ученого, основоположника атомно-молекулярного учения вы получите домой. Подсказка у вас на экране.
Ход работы.
В ходе работы выполните реакции, запишите уравнения реакций, наблюдения и выводы. Все действия выполняйте в соответствии с инструкцией.
|
|
|
Опыт 1.Классификация реакций по составу реагентов и образовавшихся веществ.
Реакции соединения.
В пробирку поместите немного порошка оксида кальция, прибавьте воду, затем индикатор фенолфталеин. Почему наблюдаем изменение окраски фенолфталеина?Запишите уравнение реакции.
Реакции замещения.
В пробирку с раствором сульфата меди опустить железный гвоздь, вынуть через 2 минуты после изменения цвета. Что наблюдаем? Запишите уравнение реакции.
Реакции обмена.
В пробирку налейте 3мл раствора сульфата меди и 3мл раствора гидроксида натрия. Наблюдаем образование осадка гидроксида меди. Какого цвета осадок?Запишите уравнение реакции.
1.4. Реакции разложения. Пробирку с осадком гидроксида меди закрепить в держателе и нагреть до изменения цвета. Почему цвет изменился? Запишите уравнение реакции.
Опыт 2. Тепловой эффект химических реакций.
Экзотермические реакции.
Реакции идут с выделением теплоты. В дистиллированной воде растворить несколько таблеток гидроксида натрия. Измерить температуру в стакане до растворения и после. Что наблюдаем? Почему изменилась температура в растворе?
|
|
|
Эндотермические реакции.
Реакции идут с поглощением теплоты. В дистиллированной воде растворить2-3г нитрата аммония. Измерить температуру в стакане до растворения и после. Что наблюдаем? Почему изменилась температура в растворе?
Опыт 3. Реакции гомогенные и гетерогенные.
Реакции, идущие в однородных системах (гомогенные).
В пробирку с раствором гидроксида натрия прибавить фенолфталеин и раствор соляной кислоты. Что наблюдаем? Как называется реакция между щелочью и кислотой? Запишите уравнение реакции.
Дата добавления: 2021-12-10; просмотров: 32; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
